大鼠80%门静脉结扎残肝组织中CyclinD1和PCNA的表达与肝再生的关系分析*
2020-07-01刘俊阳普根鄢业鸿欧阳亮远李包根陈欢李剑峰肖建生
刘俊 ,阳普根 ,鄢业鸿 ,欧阳亮远 ,李包根 ,陈欢 ,李剑峰 ,肖建生
(1.江西省宜春市人民医院,宜春 336000;2.南昌大学第一附属医院,南昌 330006)
我国是肝癌病率最高的国家之一,每年因患肝癌死亡的人数超过10万余人[1]。临床上主要治疗方式为手术切除,但大多数病人已是中晚期,且合并有肝硬化剩余健康肝脏较少,手术切除过多肝脏后会使得患者肝组织无法满足全身机体的代谢需要[2]。上世纪已有门静脉结扎术,但尚未引起普遍重视。辛昊扬等[3]研究表明:对巨大肝癌病人肝切除术前采取结扎或栓塞肿瘤侧肝脏的门静脉。可以使得肝脏肿瘤萎缩,未栓塞侧的肝组织增生肥大进而扩大肝脏容积,可在一定程度上减少肝功能衰竭的发生率。本实验建立大鼠80%门静脉结扎(PVL)组和80%肝切除(PH)组模型,初步探讨80%门静脉结扎残肝组织中CyclinD1和PCNA的表达与肝再生的关系,为临床提供理论依据。
1 材料
1.1 动物 雄性SD大鼠72只,体重(220±20)g,由南昌大学实验动物中心提供。大鼠饲养于清洁动物饲养室,室温控制在20℃-25℃,采用常规分笼,自由进食普通饲料、自来水,定期更换清洁饲料,维持12小时昼夜节律。该实验经过动物伦理委员会批准同意。
1.2 药物与试剂 兔抗大鼠PCNA单克隆抗体购自武汉博士德生物公司;PV-6002购自北京中杉金桥生物公司;总蛋白提取试剂盒购自上海贝博生物;兔抗大鼠CyclinDl抗体购自北京博奥森生物技术有限公司;辣根过氧化物酶标记山羊抗兔IgG、0.9%氯化钠注射液、5%葡萄糖注射液、苄星青霉素、5%水合氯醛、10%中性福尔马林固定液、安尔碘均购自本院医学实验中心。
1.3 仪器 7600型型全自动生化分析仪购自日立公司;Bx-60型显微镜购自日本OLYMPUS公司;彩色病理图像分析系统购自日本NIKON公司;Tanon-2500凝胶成像系统购自上海天能科技有限公司;LD5-2A低速离心机购自北京医用离心机厂;低温冰箱、台式高速低温离心机购自Beckman公司;HW.SY电热恒温水浴锅购自北京长风仪器仪表公司;SH-5加热恒温磁力搅拌器购自北京金北德工贸公司。
2 方法
2.1 分组及建立模型 雄性SD大鼠72只,采用随机数字表法分为3组,每组各24只;PVL组:(n=24)行80%大鼠肝叶门静脉结扎术,80%门静脉结扎组大鼠术前禁食12h,不禁饮,5%水合氯醛按0.5ml/100g的剂量进行腹腔注射麻醉,将大鼠以仰卧位固定于自制手术台上,切口周围备皮,并以安尔碘消毒,取上腹正中切口,于剑突下切开皮肤,肌肉及腹膜,切口长约2.0-4.0cm,拉开以暴露腹腔,暴露腹腔后腰背部垫一腰桥,暴露肝脏,切断肝周韧带,将胃肠用无菌棉签推向尾侧,显露肝门后用无菌棉签于肝十二指肠韧带前筋膜分离门静脉,根据Gershbein等[4]的方法(肝左外叶30%,中叶约40%,尾状叶约10%),用6-0丝线于远离肝叶血管蒂根部依次结扎肝左外叶、肝中叶,肝尾状叶门静脉,肝动脉及胆管保持完整,保留肝右上叶、肝右下叶。检查肝脏无活动性出血,以生理盐水冲洗腹腔后,逐层丝线缝合关闭腹腔;术后皮下注射苄星青霉素的生理盐水2ml(8万μ/ml)预防感染。PH组:行80%大鼠肝叶切除术,术中用6-0丝线在远离肝叶血管蒂根部依次缝扎肝左外叶、肝中叶、肝尾状叶、肝蒂,切断肝蒂移出标本,保留肝右上叶、肝右下叶,确定肝蒂残端无出血。其余手术步骤同PVL组。Sham组:(n=24)进腹后仅翻动肝左外叶、肝中叶、肝尾状叶,游离出门静脉各分支,即关腹。若在实验过程中有大鼠死亡立即补上,保证实验各组大鼠检测个指标时总数一致(除生存率检测外)。
2.2 术后取材 术后 24h、48h、72h、120h每组分别处死6只大鼠,观察肝脏大体形态变化腔静脉抽取静脉血3ml,室温静置2h后,再以2000r/min的速度离心15min后将所得上清液血清置于-20℃冰箱保存;切取肝脏称重,分别取2块1cm×0.5cm×0.5cm大小的肝脏组织,1块立即置于液氮中保存。
2.3 检测项目
2.3.1 比较各组大鼠生生存率 术中观察大鼠肝脏的外观改变。术后定时观察大鼠的一般情况,包括一般生命体征,精神状态、饮食及反应,记录术后24h、48h、72h、96h、120h 的生存情况, 并制作生存曲线图。
2.3.2 肝脏肝再生指数检测 检测大鼠体重后处死大鼠,切取大鼠的肝脏,擦拭肝脏表面的血迹后检测肝脏质量,使用电子称测量大俗肝脏湿重,门静脉结扎组大鼠分别要减去结扎肝叶的肝重,并计算肝脏再生指数。肝再生指数=肝脏湿重/体重×100%
2.3.3 血清ALT、AST水平检测 取出腔静脉抽取静脉血3ml,室温静置2h后,再以2000r/min的速度离心15min后将所得上清液血清,使用全自动生化分析仪分别检测各组大鼠丙氨酸转氨酶(Alanine aminotransferase,ALT) 和谷草转氨酶(Aspartate transaminase,AST)含量水平。
2.3.4 Western blot检测蛋白表达水平 使用Western blot检测大鼠CyclinD1蛋白,取大鼠肝脏组织,使用胰蛋白酶消化后,提取总蛋白,使用半干法将蛋白转移到PVDF膜,置于5%脱脂奶粉室温封闭2 h后加入各需要检测蛋白的一抗,二抗,孵育2 h,以β-actin为内参蛋白,采用显色液显色后行吸光度分析,计算各蛋白相对表达量。
2.3.5 免疫组化 按说明书采用PCNA染色试剂盒进行免疫组织化学染色。实验结果的评定标准PCNA以细胞核呈界限清楚的综色反应为阳性。PCNA阳性的肝细胞是指那些在肝细胞核内呈界限清楚的综色细颗粒状物质。每张切片随机选。择10个视野每个视野记数100个肝细胞,光镜100倍下计数PCNA阳性细胞数,按下列公式计算PCNA阳性细胞指数。PCNA指数=PCNA阳性细胞数/全部肝细胞数×100%。
2.4 统计学方法 本研究数据分析采用软件为SPSS 22.0,作图采用软件为GraphPad Prism5,计量资料采用(±s)表示,两组间比较采用t检验,多组间采用单因素方差分析,生存分析通过软件绘制Kaplan-Meier生存曲线,并采用Wileoxon检验(Gehan比分法)进行生存率的比较,若P<0.05则表明数据差异有统计学意义,本研究所有检验均为双侧检验。
3 结果
3.1 各组大鼠术后生存情况 PVL组大鼠120h生存率为87.50%显著高于PH组62.50%,差异有统计学意义(P<0.05),见表 1。
3.1 各组大鼠肝脏再生指数比较 由表2可以看出在24h时相比PVL组,PH组大鼠肝脏再生指数显著升高(P<0.05),Sham 组无显著变化(P>0.05);48h、72h、120h时,相比PVL组,PH组和Sham组大鼠肝脏再生指数均显著降低(P<0.05)。
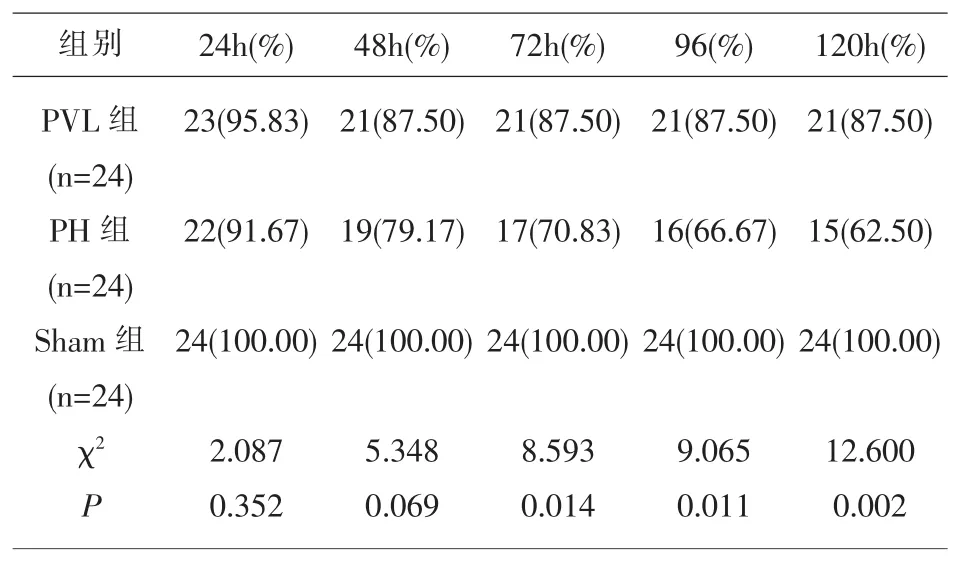
表1 各组大鼠术后生存情况(n,%)
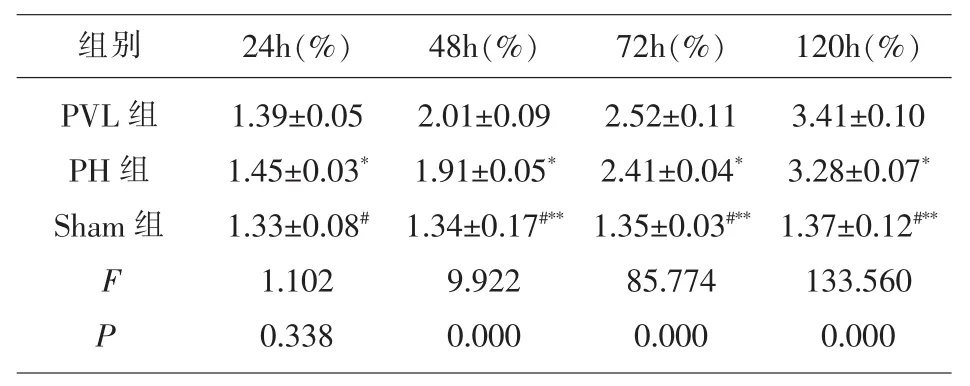
表2 各组大鼠肝脏再生指数比较
3.2 各组大鼠术后血清ALT比较 由表3可以看出,24h、48h、72h、120h 时, 相比 PVL 组,PH 组大鼠血清ALT均显著升高,Sham组大鼠血清ALT均显著降低 (P<0.05);120h时3组大鼠ALT水平均无显著差异(P>0.05)。

表3 各组大鼠术后血清ALT比较
3.3 各组大鼠术后血清AST比较 由表4可以看出,24h、48h、72h 相比 PVL 组,PH 组大鼠血清AST水平均显著升高,Sham组大鼠血清AST水平均显著降低 (P<0.05);120h时3组大鼠AST水平均无显著差异(P>0.05)。
3.4 门静脉结扎组与肝切除组大鼠术后CyclinD1相对表达量比较 由表5可以看出,相比PVL组,PH组24h大鼠肝脏CyclinD1相对表达量显著升高 (P<0.05);48h、72h、120h 大鼠肝脏 CyclinD1 相对表达量均显著降低(P<0.05)。
3.5 门静脉结扎组与肝切除组大鼠术后PCNA阳性率比较 由表6可以看出,相比PVL组,PH组24h大鼠肝脏PCNA阳性率显著升高 (P<0.05);48h、72h、120h大鼠肝脏PCNA阳性率均显著降低(P<0.05)。
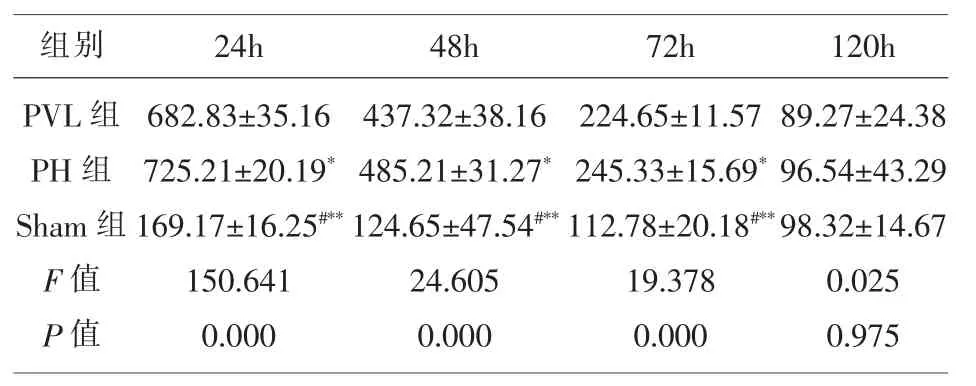
表4 各组大鼠术后血清AST比较
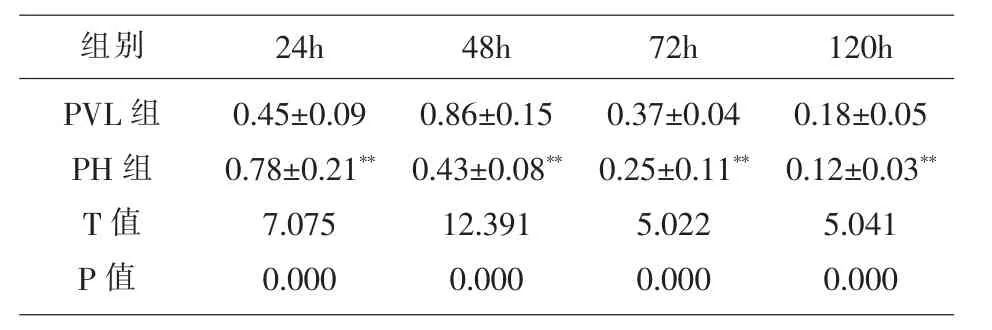
表5 门静脉结扎组与肝切除组大鼠术后CyclinD1相对表达量比较

表6 门静脉结扎组与肝切除组大鼠术后PCNA阳性率比较
4 讨论
脏容积或肝脏重量是直接反映肝脏再生最客观的指标,肝脏再生指数是较为简单和直观评价肝脏再生情况的指标[5]。本研究发现24h时相比PVL组,PH组大鼠肝脏再生指数显著升高,Sham组无显著变化 (P>0.05);48h、72h、120h 时, 相比PVL组,PH组和Sham组大鼠肝脏再生指数均显著降低。说明使用门静脉结扎相比切除肝脏可以促进肝脏再生。这可能是因为结扎部分门静脉分支后,结扎侧的肝叶出现萎缩,而非结扎侧的肝叶呈现代偿性增生肥大,可以促进非结扎侧的肝脏再生,使得肝脏再生指数显著高于其他各组。陈骋等[6]研究表明:门静脉结扎后对侧肝脏均的再生能力显著增强,与本研究得出的结论相一致。
血清ALT、AST活力的大小是检验肝脏损伤的重要指标之一[7]。王灿红等[8]研究表明:血清ALT、AST活力的大小,直接反映了肝细胞受损的程度。本实验中可以看出,24h、48h、72h时相比PVL组,PH组大鼠ALT和AST含量水平均显著升高,但在120h时三组ALT和AST含量水平无显著差异。说明门静脉结扎术在72h内会对肝脏的功能有一定的影响,但会促进肝脏的再生,使得肝脏功能逐步恢复,在120h基本可以恢复。
Cyclin D1是肝细胞进入细胞增殖周期的主要标志物,Cyclin D1的表达、活化是增殖阶段一个重要的调控位点[9,10]。PCNA是真核细胞DNA合成所需的一种DNA多聚合酶δ的辅助蛋白,它与细胞周期密切相关,直接参与细胞增殖过程中DNA的复制,其含量和表达程度变化与DNA合成情况一致,反映了细胞的增殖活性[11,12]。本研究发现相比PVL组,PH大鼠 24h肝脏 PCNA、Cyclin D1表达显 著 升 高 (P <0.05),48h、72h、120h 大 鼠 肝 脏PCNA、Cyclin D1相对表达量均显著降低。说明门静脉结扎术后48h,肝脏细胞开始增殖,肝脏开始迅速再生,且再生速度显著高于直接切除。这可能是因为肝切除术后,由于肝量突然减少肝切除比门静脉结扎肝血流动力学的变化是更迅速明显有助于更快速激活肝细胞增殖,PH导致大鼠残存的肝叶在24h时PCNA标记指数和Cyclin D1达到高峰。门静脉结扎会使得肝脏处于高动力性循环状态,通过激活诱发各种内皮细胞释放生长因子,促进肝再生,使得48h之后肝脏内的相关增殖因子表达增加,促进了肝脏的再生。同时可能与肝动脉缓冲效应 (hepatic artery buffer response HABR)有关,即当门静脉血流量减少时肝动脉代偿性扩张;反之,门静脉血流增加时肝动脉血流量减少。门静脉结扎而保留相应肝动脉的完整通过肝动脉缓冲效应从而有效的减低了门静脉压力,避免术后应门静脉压力过高所导致的肝窦机械性灌注损伤。Kawasaki等[13]研究表明:PCNA的表达在评价肝再生有等同的价值,与本研究得出的结论相一致。
综上所述,门静脉结扎可以升高术后肝脏血流动力,并促进相关生长因子的表达,实现促进肝脏再生。但本实验样本量较少,在后续的实验中将进一步扩大样本量进行实验。
