高频超声下糖尿病周围神经病变声像图表现与神经电生理特征的相关性研究
2020-07-01唐杰露李艳娇孙迎燕赵毅玲
唐杰露,李艳娇,孙迎燕,王 涛,赵毅玲
(1.牡丹江医学院;2.牡丹江医学院附属红旗医院超声科,黑龙江 牡丹江 157011)
糖尿病是最常见的慢性疾病之一,其患病率也呈逐年增加趋势[1]。2014年全球糖尿病患者人数估计为3.87亿人,预测2030年糖尿病患者人数将增加到5.78亿人[2]。40年来,我国糖尿病患病率从1980年的0.67%飙升至2013年的10.4%[3]。糖尿病周围神经病变(Diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一,发病率高达60%~90%[4]。患者被诊断为糖尿病以后,随着病情进展,常有明显的临床周围神经病变症状,其发生风险与病程有一定相关性,与遗传因素及血糖控制水平有较大相关性[3]。研究发现,糖化血红蛋白水平与DPN水平具有一定的相关性[5-7]。神经功能检查发现,60%~90%的糖尿病患者有不同程度的神经病变,其中30%~40%的患者临床症状不明显[8]。由于患者常无异常和不适感觉、未出现色素沉着以及溃疡等临床症状,且患者对该疾病的认识较少,导致临床症状不明显的DPN不能得到尽早的临床诊断与治疗,因此,本研究应用高频超声观察T2DM患者正中神经和胫神经的声像图表现,测量各神经的CSA,分析胫神经CSA与神经电生理特征的关系,探讨高频超声在早期DPN诊断中的临床应用价值,以及改善患者的远期生活质量。
1 材料与方法
1.1 一般资料选取2018年1月至2019年8月间来我院就诊的T2DM患者72例,根据2型糖尿病病程、有无周围神经病变症状及糖化血红蛋白水平分为以下四组:(1)糖尿病无症状组(A组):40岁以上、2型糖尿病病史5~10年、糖化血红蛋白4%~7%;(2)糖尿病有症状组(B组):B组进一步分为B1组及B2组。血糖控制良好组(B1组):40岁以上、2型糖尿病病史10年以上,糖化血红蛋白4%~7%,血糖控制不佳组(B2组):40岁以上、2型糖尿病病史10年以上,糖化血红蛋白>7%;选取同期来我院健康体检志愿者作为对照组(C组)。各组研究对象年龄、性别差异无统计学意义(见表1)。经牡丹江医学院附属红旗医院伦理委员会审核批准,所有入选对象签署知情同意书。

表1 一般资料
1.2 纳入、排除标准纳入标准:(1)所有T2DM患者均符合世界卫生组织2型糖尿病诊断标准[3];(2)DPN患者均符合《糖尿病周围神经病变临床诊疗规范》诊断标准[8]。排除标准:(1)1型糖尿病患者;(2)颅脑病变引起神经病变者;(3)颈椎病引起神经病变者;(4)腰椎病引起神经病变者;(5)上、下肢外伤史、手术史者;(6)患有周围神经炎者。
1.3 检查方法(1)对入选的研究对象进行基本信息采集,包括性别、年龄、糖尿病病史等相关资料;(2)研究对象取仰卧位及俯卧位,充分暴露肢体,平放于检查床上,进行双上肢正中神经、双下肢胫神经超声检查,观察记录神经外膜、神经束膜、内部回声及彩色多普勒情况,记录神经的CSA;(3)记录糖尿病有症状组胫神经神经电生理特征,即潜伏期、波幅及传导速度。
1.4 统计学分析利用SPSS 20.0统计学软件,计数资料以率(%)或相对数构成比(%)表示,行卡方检验;计量资料所有数据均以“均数±标准差”表示,A、B1、C组间各神经相应各节段的CSA采用方差分析及LSD-t检验进行比较;B1与B2组间各神经相应各节段的CSA采用t检验进行比较,以P<0.05为差异有统计学意义;采用Pearson对糖尿病有症状组胫神经的CSA与神经电生理的传导速度、潜伏期、波幅分别进行相关性分析。
2 结果
2.1 对照组与2型糖尿病组神经声像图表现比较与对照组相比,A、B组正中神经与胫神经神经束回声减低,神经外膜模糊、不光整,典型的“筛网状”结构消失。见图1、图2。
2.2 A、B1、C组正中神经及胫神经CSA比较A、B1、C三组间正中神经及胫神经的CSA差异具有统计学意义(P<0.05);与C组相比,A组及B1组正中神经CSA明显增大,差异有统计学意义(P<0.05);与C组相比,A组及B1组胫神经CSA明显增大,差异有统计学意义(P<0.05);与A组相比,B1组正中神经及胫神经CSA明显增大,差异有统计学意义(P<0.05)。见表2。
2.3 B1、B2组正中神经及胫神经CSA比较与B1组相比,B2组正中神经及胫神经CSA明显增大,差异有统计学意义(P<0.05)。见表3。
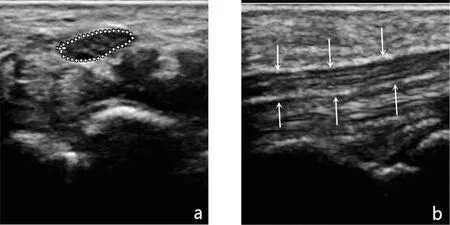
图1 对照组神经声像图表现
注:a腕部正中神经横断面(连续描记线所示),低回声的神经束被高回声的神经束膜包绕,形成典型的“筛网状”结构;b腕部正中神经纵断面(箭头所指),多发互相平行的低回声神经束被不连续的高回声神经束膜所分隔,神经外膜光滑呈高回声

图2 2型糖尿病组神经声像图表现
注:a 腕部正中神经横断面(连续描记线所示),神经束回声减低,“筛网状”结构消失,横截面积增大;b 腕部正中神经纵断面(箭头所指),神经束回声减低,神经束膜及神经外膜模糊、不光整

表2 A、B1、C组正中神经及胫神经CSA比较
注:整体比较为单因素方差分析。多重比较为LSD-t检验,与B1组、C组相比,abP<0.05;与C组相比,bP<0.05

表3 B1、B2组正中神经及胫神经CSA比较
2.4 B组胫神经CSA与神经电生理特征的相关性B组胫神经CSA与神经电生理特征具有相关性,CSA与潜伏期呈正相关,CSA与传导速度和波幅呈负相关。见表4。
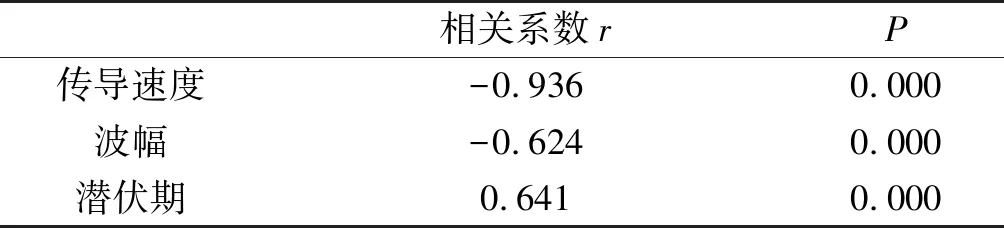
表4 C组胫神经CSA与神经电生理特征的相关性
3 讨论
我国糖尿病发病率在过去数十年中呈“爆炸式”增长,已成为全球首位糖尿病大国[9]。DPN是糖尿病严重的并发症之一,致残、致死率极高,DPN患者常见症状为肢体末端感觉异常,症状自肢体远端开始,逐步向近端进展,呈“手套、袜子”样分布,晚期运动神经可受累,出现肌力减弱、肌萎缩和瘫痪等临床表现[10],严重影响糖尿病患者的生活质量,同时也造成了极大的社会经济负担。有研究表明[11],大部分DPN患者早期无任何临床症状,这类患者如不及时采取预防性的足部护理,会直接导致肢体感染、溃疡和截肢情况的发生。
目前,临床主要通过神经电生理检查诊断DPN[12],DPN的神经电生理特征为神经的传导速度减慢、潜伏期延长、动作电位波幅降低甚至消失,然而,神经电生理不能显示神经形态结构的改变和病变的具体部位及程度。有研究报道[13],神经电生理表现很容易受皮肤温度和湿度影响,且因其耗时长、有创、可重复检查率低,在临床的诊断中具有一定的局限性。本研究在收集数据过程中,曾遇到过1例糖尿病患者,周围神经病变临床症状非常明显,但神经电生理检查结果显示正常,刘加玉[14]研究认为,某些DPN患者并不能检测出电生理异常,不建议单独应用神经电生理检查作为诊断DPN的手段,与本研究结果一致。
本文对98例研究对象进行双上肢正中神经及双下肢胫神经超声检查,结果显示,高频超声能清晰显示神经的走行、内部结构及与周围组织的关系,DPN患者周围神经声像图表现为神经外膜模糊、毛糙,神经束回声减低,与雷志辉[15]等研究一致。本课题测量各组正中神经及胫神经CSA并进行分析,结果表明,A组、B1组正中神经及胫神经CSA均明显大于C组,差异有统计学意义。因此,高频超声在未出现临床症状的糖尿病周围神经病变诊断中起到了至关重要的作用,具有一定的早期诊断价值,这与其他文献报道一致[16]。与A组相比,B1组正中神经及胫神经CSA均增大,表明随着时间的推移,糖尿病患者周围神经病变逐渐加重,
印证了早期诊断糖尿病周围神经病变的重要性。Kang等[17]研究认为,DPN组腓肠神经、腓神经、正中神经、尺神经、桡神经CSA均显著高于正常对照组(P<0.05),腓肠神经、正中神经和胫神经的CSA与电生理特征密切相关,腓肠神经CSA与糖化血红蛋白有显著相关性,与本文研究结果一致。因此,高频超声联合神经电生理检查为临床诊断糖尿病周围神经病变提供了新的思路,具有较好的临床指导意义。本研究只进行了神经的超声检查,与神经电生理特征的关系进行了分析,究竟是什么原因导致DPN患者神经内部回声、神经外膜、CSA的改变尚不清楚,且研究的样本量较小,后期还需要大样本研究进一步证实结论。
综上所述,高频超声能够显示末梢神经病变的形态学改变,能准确反应病变部位及其严重程度,且相对其他影像学检查具有简便、费用低、无创伤及可重复检查等优势。因此,高频超声可作为DPN的重要的形态学诊断方法,并作为临床和神经生理诊断DPN的一种补充手段。
