顺铂通过Notch1下调CXCR4对乳腺癌细胞增殖能力的影响
2020-07-01张炜婷刘金丽王红艳郭素芬
杨 月,张炜婷,刘金丽,,王红艳,3,刘 野,3,郭素芬
(1.牡丹江医学院病理教研室;2.牡丹江医学院附属红旗医院感染科;3.牡丹江市第二人民医院病理科,黑龙江 牡丹江 157011)
乳腺癌是全世界女性癌症死亡的主要原因。顺铂是用于乳腺癌和其他实体瘤的常规药物。CXCR4及其配体CXCR12(又称间质细胞衍生因子1,SDF-1)所构成的SDF-1/CXCR4生物学轴在细胞增殖以及内皮细胞或内皮祖细胞参与的血管形成中起重要作用。Notch信号通路影响细胞与细胞之间的直接交流,它在胚胎发育期间可以调控细胞增殖、凋亡和干细胞的存活[1]。
本实验旨在评估不同浓度顺铂对乳腺癌细胞系MDA-MB-231的药物疗效及作用机制。该实验可进一步明确顺铂的作用机制,从而为联合药物的开发及乳腺癌的治疗提供多种手段。
1 材料与方法
1.1 材料及试剂乳腺癌细胞株MDA-MB-231由本实验室保存;1640培养基、小牛血清购于美国Gibco公司;青-链霉素购自美国Hyclone公司;0.25%胰蛋白酶购自美国Gibco公司;顺铂(DDP)为齐鲁制药厂生产;Notch1(#3608)和CXCR4(#59028)抗体购自Cell Signaling Technology公司;β-actin抗体(AF0003)购自Beyotime公司;Notch1抑制剂MK0752购自Selleckchem公司;CCK-8试剂购自Bimake公司。
1.2 细胞株与细胞培养将人乳腺癌细胞系MDA-MB-231培养在含10%胎牛血清和1%青-链霉素的培养基中。将其放置在37℃,5% CO2的培养箱中,次日观察细胞贴壁情况并换液。贴壁生长良好的乳腺癌细胞经0.25%胰蛋白酶消化,选用对数生长期细胞进行实验。
1.3 细胞增殖实验取对数生长期MDA-MB-231,用0.25%胰蛋白酶消化细胞后加入含血清的培养基重悬。细胞计数后,将细胞以每孔5×103个的密度接种于96孔板中,每组设3个复孔继续培养至完全贴壁,形成单层细胞铺满孔底。将原液浓度为1.2mg/mL的DDP溶液稀释成不同终浓度(0、10、20、40μmol/L)的DDP溶液。培养24h后在倒置显微镜下观察细胞状态,并加入不同浓度的DDP溶液继续培养。48h后弃掉培养基,每孔加入10μL的CCK8溶液于37℃下孵育1h。使用酶联免疫检测仪检测492nm波长处的吸光度(OD)值。
1.4 Western Blots按照说明书步骤提取顺铂不同浓度处理的细胞蛋白,常规蛋白质印迹法将膜和抗CXCR4抗体(1∶1000)以及抗Notch1抗体(1∶1000)和β-actin抗体(1∶1000)稀释缓冲液在4°C下孵育过夜并不时轻轻晃动。5%脱脂牛奶稀释Anti-rabbit IgG,HRP-linked Antibody(1∶5000)和Anti-mouse,HRP-linked Antibody(1∶5000)与膜一起孵育,在室温下轻轻摇晃孵育1h。使用试剂A和试剂B来制备1X SignalFireTMECL Reagent显影液,在凝胶成像系统下曝光。
1.5 统计分析采用统计软件SAS9.1进行数据分析。所有数据均以“均数±标准差”表示,两样本均数比较采用t检验,多组样本均数比较采用单因素方差分析后,以Student-Newman-Keuls检验进行两两分析。以P<0.05为差异具有统计学意义。所有图形均使用GraphPad Prism 5软件程序制作。所有实验均重复三次。
2 结果
2.1 DDP抑制MDA-MB-231细胞的增殖能力CCK-8检测结果显示,与对照组相比MDA-MB-231细胞增殖均受到不同程度的抑制,并随着DDP浓度的增加,MDA-MB-231细胞被抑制程度越高。P<0.05,具有统计学意义。如图1所示。
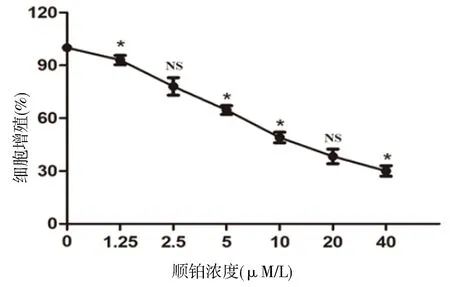
图1 不同浓度的顺铂对MDA-MB-231细胞增殖能力的影响
注:CCK-8实验结果,*P<0.05,NS表示差异无统计学意义
2.2 顺铂下调CXCR4的表达Western blot结果显示,不同浓度给药组(10、20、40μmol/L)CXCR4表达均显著低于对照组,且随着顺铂浓度的增加对CXCR4的抑制作用更为明显,且差异均具有统计学意义。结果如图2所示。

图2 顺铂对CXCR4表达的影响
注:Western blot实验结果,A:不同浓度顺铂对CXCR4表达的影响;B:CXCR4与actin蛋白表达的灰度柱状图分析。*P<0.05,**P<0.01
2.3 抑制Notch1可以下调CXCR4的表达为了证实Notch1和CXCR4之间是否有内在联系,采用Western blot方法验证MK0752的阻断效果。结果显示,与对照组相比,用MK0752作用2h后,Notch1的表达明显降低,表明MK0752有效抑制了乳腺癌细胞中Notch1的表达,差异具有统计学意义(P<0.001)。结果如图3A、3B显示。当Notch1被阻断(阻断组)后CXCR4的表达随之出现减少,但不如非阻断组(Notch1未被阻断)减少的显著,差异具有统计学意义(P<0.001)。如图3C、图3D。

图3 抑制Notch1可以下调CXCR4的表达
注:Western blot实验结果,A:MK0752对Notch1的影响;B:Notch1与β-actin蛋白表达的灰度柱状图分析;C:Notch1抑制后对CXCR4的影响;D:CXCR4与β-actin蛋白表达的灰度柱状图分析。***P<0.001
3 讨论
在西方约有1/8的女性患有乳腺癌,其中5%是由乳腺癌相关基因1(BRCA1)和乳腺癌相关基因2(BRCA2)突变引起的[2]。大多数患者在确诊后接受联合化疗,但其中约30%的患者在5年内死于肿瘤转移[3]。顺铂是一种可诱导交联的DNA破坏剂,也可通过破坏细胞质蛋白并在执行阶段诱导细胞凋亡来达到杀死细胞的目的。已有研究表明顺铂耐药与肿瘤微环境有关,趋化因子似乎在肿瘤的进展和转移中起关键作用[4]。CXCR4及其配体CXCR12所构成的SDF-1/CXCR4生物学轴在细胞增殖以及内皮细胞或内皮祖细胞参与的血管形成中起重要作用。Koshiba等人研究发现SDF-1/CXCR4生物学轴可激活一系列信号转导途径和效应因子,参与调控肿瘤细胞的周期、增殖、趋化和黏附,促进肿瘤组织内血管的形成,从而导致肿瘤的快速增长[5]。因此,靶向CXCR4的治疗吸引了越来越多研究人员的关注。
已有研究证明人类肿瘤涉及复杂的趋化因子网络,而这些趋化因子通过多种方式在肿瘤生长、侵袭和转移等方面发挥作用,例如细胞转化、血管发生、蛋白酶的分解和器官特异性转移等。Soria G等人发现乳腺癌细胞CCL5的产生与肿瘤进展有关。CCL5在正常乳腺上皮导管细胞中低表达,但在原发肿瘤部位的区域淋巴结和转移部位的肿瘤细胞中高表达[6];Emese Z等发现卵巢癌的趋化因子分布是异质的。在上皮T细胞肿瘤中淋巴细胞趋化因子CCL2、CCL4和CCL5高表达,而CXCL10、CXCL12和CXCL16几乎普遍表达[7];Schrader A J等在人肾癌组织中检测到CXCR4表达较高,而在正常肾脏组织中仅检测到少量的CXCR4[8]。研究者已经提出肿瘤细胞的CXCR4表达通过趋化梯度到表达配体SDF-1的器官,此过程在细胞转移中起关键作用。CXCR4受体的配体SDF-1促进表达CXCR4的肾癌细胞转移至表达SDF-1的特定器官。Gagliardi等人表明CXCR4是肿瘤增殖、侵袭、血管生成和调节免疫反应所必需的趋化因子[9];Liang等人报道SDF-1/CXCR4轴可以促进AKT的磷酸化进而增加VEGF的表达并且促进乳腺癌的血管形成[10]。
Notch信号通路可能在多种恶性肿瘤中促进肿瘤干细胞的增殖、存活、自我更新、分化、血管形成和迁移。在哺乳动物中有5种Notch配体[Delta-like(Dll)1、3、4和Jagged1、2]和4种Notch受体(Notch1-4),所有这些都是I型跨膜蛋白。Notch受体的活化会导致NICD释放入核,随后活化相关目的基因。Notch通路可能通过抑制分化、促进生存或加速增殖而在肿瘤发生中发挥作用[11],然而在不同肿瘤的背景下Notch信号是作为促癌因子还是抑癌因子值得我们关注[12]。Notch通路在肿瘤发展中的特殊作用可能取决于肿瘤类型。Yi等人表明在胶质母细胞瘤中Notch1有助于通过CXCL12/CXCR4途径维持干细胞的侵袭、迁移和自我更新[13]。然而CXCR4在Notch1信号传导中的作用只在几种细胞类型中有过研究。例如在间充质干细胞中,当Notch信号被c-分泌酶抑制剂(GSI)中断或敲除转录因子RBP-J时,CXCR4 mRNA水平显著增加[14],但是同样的方法作用于卵巢癌,CXCR4的表达却是下降的[15]。Tsaouli等人报道这两条受体通路在淋巴细胞转化的增殖、分化和代谢过程中与其他关键信号相互交叉[16];Cong等人发现CXCR4和Notch1共表达与肿瘤进展与淋巴血管侵袭有关,是肺腺癌预后不良的独立指标[17]。说明Notch信号和CXCR4信号在调节免疫系统、中枢神经发育系统以及干细胞中具有多种重叠功能,并且通过Notch信号调节CXCR4可能参与了复杂的调节机制。因此我们使用了药理抑制剂MK0752阻断了Notch1,发现CXCR4的表达明显降低,表明CXCR4的表达受到Notch1信号的调控。Notch1信号的异常激活可能会增强肿瘤细胞侵袭和迁移能力,从而促进其转移至特定部位,这是否暗示SDF-1/CXCR4轴本身在微环境中归巢和增殖方面起功能性作用?同时阻断Notch通路使得CXCR4下调是多个调节通路综合作用?还是仅CXCR4/SDF-1轴发挥作用?这些问题都需进一步研究。
本实验研究了顺铂对乳腺癌细胞的作用以及其对CXCR4表达的调节作用。结果发现顺铂可以有效地杀死肿瘤细胞,并降低了CXCR4蛋白水平上的表达,此外CXCR4表达的降低与Notch信号通路受体Notch1有关,这正与之前的研究一致。同时提供了有力的临床前证据支持Notch信号通路作为可选择的靶点,从而抑制肿瘤的转移。因此靶向Notch1的新型药物在乳腺癌中应用治疗将为部分解决临床治疗中乳腺癌的转移、复发、耐药等问题提供了希望,极大地提高了乳腺癌患者的生活质量。
