转录因子KLF7对酒精诱导大鼠海马神经元细胞凋亡的保护作用
2020-07-01庄丽雯李文媛孙广大安锦丹
庄丽雯,李文媛,孙广大,马 多,王 莹,安锦丹
(1.牡丹江医学院;2.牡丹江医学院形态学实验室;3.牡丹江医学院神经组织工程研究所,黑龙江 牡丹江 157011)
酒精依赖是指患者由于长期大量饮酒,对酒产生一种无法抑制的渴求状态,进而不能控制自己的饮酒行为,引发系列戒断症状[1]。酒精通过氧化应激作用诱导神经元细胞凋亡,进而损伤中枢神经系统,致使人体的学习和记忆等功能产生障碍[2-3]。因此,寻找一种有效治疗酒精依赖靶点,修复酒精造成的中枢神经系统的损伤,对于酒精依赖患者的治疗非常必要。
多项研究证实转录因子KLF7(Krüppel-like factor 7,KLF7)对于轴突再生、神经元形态、以及神经元存活[4-5]具有重要调控作用。前期研究证实KLF7显著促进中枢和周围神经损伤和功能重建[6-7],并发现KLF7能够保护感觉神经元细胞在神经损伤后存活,但在乙醇诱导海马神经元损伤中KLF7对细胞保护作用及调控机制至今未见报道。
本实验通过应用不同浓度乙醇培养基对海马神经元进行培养,构建海马神经元乙醇诱导损伤细胞模型,观察KLF7对乙醇诱导损伤海马神经元细胞活性和细胞凋亡的作用及作用机制,为临床酒精依赖性脑病损伤治疗提供新的靶点。
1 材料与方法
1.1 实验动物和试剂新生SD乳鼠6只(哈尔滨医科大学实验动物中心,许可证号:SCXK(黑)203-001)。AAV2-KLF7病毒(美国abm公司),兔抗大鼠KLF7抗体,兔抗大鼠NGF抗体,兔抗大鼠TrkA抗体、兔抗大鼠NSE多克隆抗体、抗兔Alexa Fluor®
Plus 555荧光二抗(均购自美国Sigma公司),KLF7、NGF、TrkA、Bcl2、Bax、Caspase-3和GAPDH引物(宝泰克生物科技公司合成);胎牛血清(美国Hyclone公司)、DMEM/F12培养基、B27细胞培养添加剂、Hoechst33342、PI粉末、DAPI(美国Sigma公司)、MTT试剂盒(德国宝灵曼公司)、Hoechst33342/PI细胞凋亡染色试剂盒、qRT-PCR试剂盒(均购自武汉博士德公司)。
1.2 海马神经元的分离、培养与鉴定按前期研究方法对新生24h内SD大鼠剥离并提取海马组织[3],对组织进行修剪,放入4mL无血清DMEM/F12培养液的离心管,加入0.125%胰蛋白酶消化后离心,制备1×106单细胞悬液,放入6孔培养板中培养,培养6d进行鉴定。
1.3 免疫荧光染色鉴定培养海马神经元应用4%多聚甲醛固定、PBS清洗,添加TritonX-100放置20min,PBS清洗,1h山羊血清封闭后吸弃,添加兔抗大鼠NSE多克隆抗体(浓度1∶200)4℃孵育过夜。PBST冲洗,避光环境内添加抗兔Alexa Fluor® Plus 555荧光二抗1h孵育。加入DAPI避光放置5min后漂洗并封片。
1.4 乙醇干预将海马神经元细胞放置96孔板(1×106个/孔),培养箱里孵育24h,细胞分为4组:正常组、低浓度组(100mmol/L)、中浓度组(200mmol/L)、高浓度组(400mmol/L)。将培养液替换成各组对应浓度乙醇培养基200μL,培养72h后进行MTT法检测,根据结果筛选乙醇干预最佳浓度为中浓度组(200mmol/L)。
1.5 细胞分组将海马神经元细胞分为正常组:正常培养基培养放置24孔板的海马神经元细胞;乙醇组:应用终末浓度200mmol/L含乙醇培养基培养海马神经元细胞,孵育72h;乙醇+KLF7组:正常海马神经元细胞每孔加入2μL AAV2-KLF7进行病毒转染,孵育24h后,更换终末浓度200mmol/L含乙醇培养基培养72h。
1.6 MTT法用MTT法测定细胞活力。将各组细胞在96孔板中以1×106细胞/孔接种的细胞生长到70%汇合,孵育12h、24h、48h、72h。取出培养基,用含有10μL MTT(5mg/mL)新鲜培养基替换。孵化4h,除去培养基,将噻唑蓝溶于100μL二甲基亚砜(DMSO)。570nm吸光度检测细胞活力。
1.7 Hoechst 33342/PI双染法测凋亡率各组1×106细胞/孔细胞悬液加入10μL Hoechst33342后充分混匀,在37℃温度中放置15min,4℃离心后弃上清。使用1mL PBS细胞重悬,添加5μL PI混匀后在37℃中放置15min。PBS清洗,免疫荧光显微镜检测。
1.8 qRT-PCR按照说明书步骤提取总RNA,测定相关浓度。通过逆转录试剂盒方法合成cDNA。各引物的序列为: KLF7上游5′-TTTCCTGGCAGTCATCTGCAC-3′,下游5′-GGGTCTGTTTGTTTGTCAGTCTGTC-3′;NGF上游5′-CGGTCTTCCCGCCCTAGCCTG-3′,下游5′-ATTTGCACGCCGCTCCTTTGC-3′;TrkA上游5′-AGGTTGAAGCCATTCTCCTG-3′,下游5′-TCTCGGTGGTGAACTTACGG-3′;Bcl-2上游5′-TCTTTGAGTTCGGTGGGGTC-3′,下游5′-TGCATATTTGTTTGGGGCAGG-3′;Bax上游5′-TCCACCAAGAAGCTGAGCGAG-3′,下游5′-GTCCAGCCCATGATGGTTCT-3′;Caspase-3上游5′-TGGAACAAATGGACCTGTTGACC-3′,下游5′-AGGACTCAAATTCTGTTGCCACC-3′;GAPDH上游5′-TGGTGGGTATGGGTCAGAAGGACTC-3′,下游5′-CATGGCTGGGGTGTTGAAGGTCTCA-3′。利用2-△△CT方法分析。
1.9 Western blot取各组细胞提取总蛋白并定量。通过SDS-PAGE凝胶电泳分离每组样品蛋白(30 μg),并将其转移至聚偏二氟乙烯(PVDF)膜。所有膜均用5%牛奶封闭,并与兔抗大鼠KLF7抗体,兔抗大鼠NGF抗体,兔抗大鼠TrkA抗体孵育过夜,然后在室温下用辣根过氧化物酶偶联二抗室温孵育1h。应用增强的化学发光试剂盒测定蛋白质,ImageJ 1.42q软件分析检测结果。
1.10 统计学分析所有数据使用SPSS 13.0软件进行two-tailed Student’st-test、one-wayANOVA和Tukey’sposthoc检验,计量资料以“均数±标准差”示,P<0.05为差异具有统计学意义。
2 结果
2.1 海马神经元细胞免疫荧光染色鉴定NSE免疫荧光染色可见培养海马神经元细胞均呈显著阳性染色(图1)。

图1 培养6d的海马神经元细胞NSE免疫荧光染色
2.2 MTT检测不同浓度乙醇对海马神经元细胞活力影响与正常组(100%)比较,培养基乙醇浓度100mmol/L(92.080±2.432)%、200mmol/L(82.330±2.849)%、400mmol/L(66.950±4.853)%呈剂量依赖性导致海马神经元细胞活性降低(F2,15=64.66,P<0.001)。结果显示,100mmol/L是分界点,200mmol/L时细胞活力仍>75%,细胞数量较多,故后续实验以细胞活力接近82%的乙醇浓度200 mmol/L作为乙醇组(图2)。
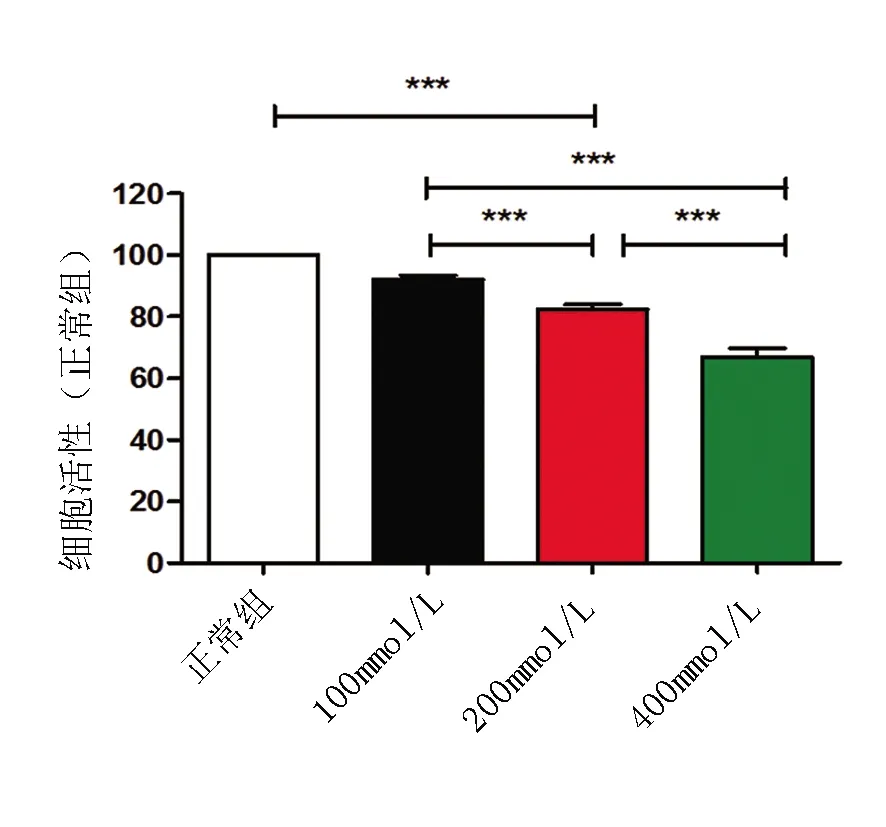
图2 不同浓度乙醇对海马神经元细胞活力影响
2.3 KLF7对海马神经元细胞形态作用镜下观察正常组海马神经元细胞突起生长显著,相互交错成神经网络。乙醇组细胞数量较正常组显著减少,突起显著萎缩,神经网络结构损伤。乙醇+KLF7组神经元数量较乙醇组显著增多,突起数量增加,神经网络结构损伤得到改善(图3A)。与正常组比较,乙醇组和乙醇+KLF7组神经突起长度显著降低,其中乙醇+KLF7组神经突起长度显著高于乙醇组(F2,6=23.70,P<0.001)(图3B)。

图3 各组海马神经元形态
2.4 RT-PCR检测结果与正常组比较,乙醇组KLF7 mRNA相对表达无显著差异,但乙醇+KLF7组内KLF7 mRNA相对表达显著高于正常组和乙醇组(F2,6=121.5,P<0.001)(图4A)。
乙醇组和乙醇+KLF7组NGF和TrkA mRNA相对表达显著高于正常组,其中乙醇+KLF7组NGF和TrkA mRNA相对表达均高于乙醇组,差异具有显著性(NGF:F2,6=146.1,P<0.001;TrkA:F2,6=62.86,P<0.001)(图4B、C)。
2.5 Western blot检测结果乙醇组KLF7蛋白相对表达较正常组无显著差异,但乙醇+KLF7组内KLF7蛋白相对表达显著高于正常组和乙醇组(F2,6=164.7,P<0.001)(图5A、B)。
与正常组比较,乙醇组和乙醇+KLF7组NGF和TrkA蛋白相对表达显著增高,其中乙醇+KLF7组NGF和TrkA蛋白相对表达均显著高于乙醇组(NGF:F2,6=99.27,P<0.001;TrkA:F2,6=157.5,P<0.001)(图5A、B、C)。

图5 Western blot检测各组细胞内KLF7(A,B)、NGF(C)和TrkA(D)蛋白相对表达
2.6 MTT法检测结果与正常组比较,乙醇组和乙醇+KLF7组细胞活性在各时间点均显著降低(P<0.05)。培养72h后,乙醇+KLF7组(0.750±0.044)细胞活性较乙醇组(0.650±0.034)显著增高(t=5.03,P<0.001)(图6)。
2.7 Hoechst 33342/PI双染法检测凋亡乙醇组(0.485±0.076)和乙醇+KLF7组(0.767±0.043)细胞凋亡率较正常组(0.173±0.060)显著增加,其中乙醇+KLF7组细胞凋亡率较乙醇组显著降低(F2,15=69.59,P<0.001)(图7A、B)。

图6 MTT法检测各组细胞增殖情况
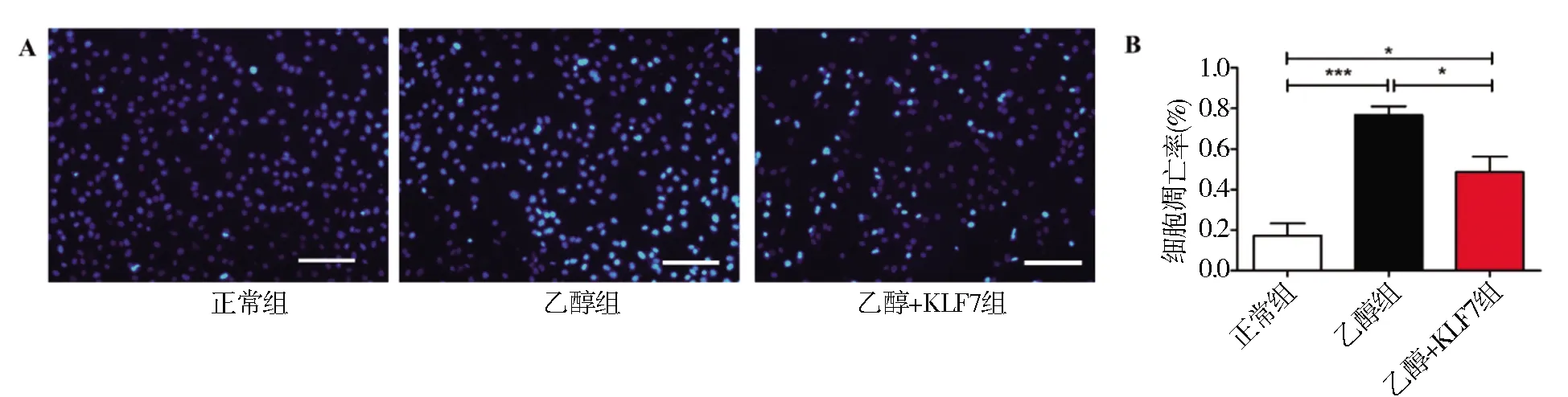
图7 Hoechst 33342/PI双染法检测各组细胞凋亡情况(A),细胞凋亡率(凋亡细胞数/细胞总数)(B)
2.8 qRT-PCR检测凋亡因子mRNA表达情况与正常组比较,乙醇组和乙醇+KLF7组Bcl-2 mRNA表达水平显著降低,其中乙醇+KLF7组Bcl-2 mRNA表达高于乙醇组(F2,15=25.97,P<0.001)(图8A)。乙醇组和乙醇+KLF7组Bax和Caspase-3 mRNA相对表达水平较正常组显著增加,其中与乙醇组比较,乙醇+KLF7组Bax和Caspase-3 mRNA相对表达显著降低(Bax:F2,15=53.81,P<0.001;Caspase-3:F2,15=127.5,P<0.001)(图8B、图8C)。

图8 qRT-PCR检测各组细胞Bcl-2(A)、Bax(B)Caspase-3(C)mRNA的表达情况
3 讨论
海马在认知功能和情感调节方面具有非常重要的作用。海马损伤常导致学习、记忆等功能障碍[8]。酒精依赖性脑病主要通过作用海马神经元,影响患者学习记忆和认知能力[9-11]。本研究选择新生鼠进行海马神经元原代培养,由于新生鼠的神经元细胞尚未分化成熟,易于体外培养。在本次实验中通过NSE免疫荧光染色可见,原代培养6d后所有海马神经元细胞均呈阳性,提示本研究培养原代海马神经元纯度较高。
海马作为一个非常重要的脑区,对于酒精极其敏感,易受酒精损伤导致突触生长、神经元形态改变[12-16]。实验通过添加低、中、高浓度乙醇培养基进行培养,并确认细胞活力82%的中剂量乙醇培养基作为乙醇组诱导损伤最佳浓度。倒置相差显微镜观察可见乙醇组海马神经元细胞数量较正常组明显减少,突起萎缩,神经网络显著减少,同时MTT法和Hoechst33342/PI双染法发现乙醇组海马神经元细胞活性显著低于正常组,而细胞凋亡显著增高。以上结果证明中剂量乙醇能够显著诱导海马神经元细胞形态损伤、细胞活力降低,促进细胞凋亡,这可能是乙醇导致酒精依赖性脑病学习记忆和认知功能障碍的主要解剖基础,证实乙醇诱导海马神经元细胞损伤可作为一种较理想的酒精依赖性脑病的体外研究模型。
KLF7作为转录激活因子,是Krüppel-like Factors家族的一员,可刺激周围神经损伤后轴突再生,对于神经系统具有重要调控作用[17-20]。KLF7参与多种重要神经生物学活动[21],如轴突生长、细胞增殖[22-24],神经元分化等。有研究证实KLF7可被神经损伤激活,调节轴突损伤反应[23]。然而KLF7在调节酒精依赖性脑损伤的作用和机制尚未见报道。
本研究通过AAV2-KLF7病毒转染乙醇培养海马神经元,发现乙醇+KLF7组KLF7蛋白和mRNA显著高于乙醇组和正常组,证实AAV2-KLF7能够有效转染乙醇培养海马神经元,镜下可见乙醇+KLF7组海马神经元细胞数量较乙醇组显著增多,突起数量增加,神经网络损伤明显改善。而且MTT法和Hoechst33342/PI发现KLF7显著促进乙醇诱导海马神经元损伤模型细胞活性,降低细胞凋亡率。因此本研究证实转录因子KLF7对酒精诱导海马神经元损伤具有保护作用。
有研究证实KLF7能够调控靶基因NGF/TrkA信号通路,改善神经损伤后功能重建。本研究发现与正常组和乙醇组比较,乙醇+KLF7组NGF和TrkA mRNA及蛋白相对表达显著增高,表明KLF7能够显著上调乙醇培养海马神经元中NGF/TrkA信号通路。另外本研究发现KLF7促进乙醇诱导损伤海马神经元Bcl-2 mRNA相对表达,下调Bax和Caspase-3 mRNA相对表达。因此本研究推测KLF7可能通过激活神经营养因子NGF/TrkA信号通路,下调乙醇诱导损伤海马神经元中Caspase-3和Bax表达,上调Bcl-2表达,进而保护海马神经元细胞凋亡。
综上所述,本研究探讨并证实KLF7对乙醇诱导损伤海马神经元细胞的保护作用,其机制可能通过激活NGF/TrkA信号通路,下调凋亡因子Caspase-3和Bax表达,上调Bcl-2表达,从而保护乙醇诱导海马神经元细胞凋亡有关。
