丹参酮ⅡA对内毒素血症小鼠心肌损伤的预防作用及机制
2020-07-01王元元马善峰丁海虎赵继利陶明飞
陶 静,王元元,马善峰,李 言,倪 虹,丁海虎,赵继利,王 锐,张 甫,陶明飞
(蚌埠医学院 1.机能综合实验室;2.生理教研室;3.病理生理教研室;4.科研中心,安徽 蚌埠 233030;5.固镇县人民医院心血管科,安徽 蚌埠 233700)
内毒素血症是临床上最为常见的一种全身炎症反应,心脏是最常被累及器官之一,目前内毒素血症引起心肌受损的机制并不明确,临床仍无特效针对性措施。丹参属于活血化瘀类药物,对于慢性炎症性疾病有明确的防治效果[1],是应用于临床防治心血管疾病的常见中药,目前,已经发现丹参可减轻心、脑缺血再灌注损伤,抑制血小板凝聚和血栓形成,抑制胶原纤维的产生和促进纤维蛋白降解,清除自由基等功效[2-3]。据文献报道丹参酮IIA(tanshinone IIA,TIIA)可抑制炎性介质、释放氧自由基,显著降低内毒素模型组小鼠的死亡率[4]。有研究证实丹参酮IIA能明显改善脂多糖诱导的小鼠心功能不全[5],也有研究提示丹参酮在对压力负荷增加的心肌纤维化的影响研究中发现,其可抑制RhoA/Rock信号通路改善心肌纤维化[6]。但丹参酮干预脂多糖诱导的小鼠心肌损伤,降低下游细胞因子的分泌,是否与RhoA/Rock(Rho激酶)通路相关,尚未见报道。本研究旨在观察丹参酮可否预防脂多糖诱导的内毒素血症小鼠心肌损伤,与Rho激酶通路是否相关,为临床应用丹参酮防治由于内毒素血症引起的心肌损伤,提供一定的理论基础。
1 材料与实验方法
1.1 实验动物与主要实验试剂雄性8~10周龄SPF级C57BL/6J小鼠,体重(20±2)g,蚌埠医学院实验动物中心提供,生产许可证号SCXK(苏2017-0001),批次NO201905758;白介素-1β(IL-1β)ELISA检测试剂盒购于上海酶联生物科技有限公司,一抗Rock1,RhoA购于武汉爱博泰克生物科技有限公司(ABclonal)。
1.2 实验分组与模型的建立8~10周龄C57BL/6J雄性小鼠,适应性常规喂养1周,随机分成四组,空白对照组(DON组)、模型组(LPS组)、丹参酮预处理组(TL组)以及丹参酮组(T组)(每组10只)。TL组,腹腔注射丹参酮10mg/(kg·d)共7d,末次注射1h后腹腔注射LPS 10mg/kg;CON组,腹腔注射与丹参酮等体积生理盐水7d;LPS组,腹腔注射与丹参酮等体积生理盐水7d,末次注射1h后腹腔注射LPS 10mg/(kg·d);T组,腹腔注射丹参酮10mg/(kg·d)7d,1h后腹腔注射等体积生理盐水。给药期间小鼠自由饮食、饮水。LPS处理后,6h做超声心动图检查;12h后做HE染色,ELISA测IL-1β水平,Western blot法检测RhoA和Rock1的蛋白含量。
1.3 小动物超声心动图检查使用FUJIFILM Visual Sonics Vevo®2100成像系统,利用超声心动图来评价LPS和丹参酮IIA预处理后的心功能变化。小鼠腹腔注射20%氨基甲酸乙酯0.1mL/10g,麻醉后固定于动物检测台,胸部脱毛,MS-400探头,取胸骨旁左心室长轴切面(B-mode、M-mode),取样容积置于主动脉根部,LV-trace工具分析左心收缩功能。检测各组小鼠心率(HR)、射血分数(EF)、短轴缩短率(FS)、每搏输出量(SV)和心输出量(CO)。
1.4 HE染色造模12h后,颈椎脱臼法处死小鼠,立即开胸取出心脏,预冷生理盐水清洗,滤纸吸干称重后,用10%福尔马林固定,石蜡包埋HE染色。光学显微镜放大400倍拍照,观察心脏组织形态学发生的改变。
1.5 酶联免疫法测白介素-1β的蛋白水平按试剂盒说明书处理心肌组织标本,依据操作步骤程序,测定各组标本目的蛋白的OD值,做出标准曲线,计算蛋白浓度,做统计学分析。
1.6 Western blot法检测小鼠心肌组织RhoA和Rock1的蛋白含量腹腔注射LPS,12h后处死小鼠,取出心脏,加入细胞蛋白裂解液及蛋白酶抑制剂提取各组细胞总蛋白。采用BCA法测定各组细胞总蛋白浓度,计算出每个样本的上样量。蛋白上样,经过10%聚丙烯酰胺凝胶电泳(SDSPAGE)分离后,转移至PVDF膜上。浸于5%脱脂牛奶溶液中封闭,60r/min室温摇床120min,TBST洗膜。一抗孵育,加入RhoA、Rock1和GAPDH抗体封膜,水浴37℃,30min,60r/min室温摇床30min,4℃冰箱过夜,次日TBST洗膜。加入辣根过氧化物酶(HRP)标记的二抗,室温孵育1h。TBST洗膜4次,共35min,将载有PVDF膜的玻璃板放入凝胶成像仪中曝光Image Lab软件分析,统计各组图片灰度值,计算出目的蛋白RhoA和Rock1与内参的灰度值比值,得出蛋白相对表达水平。
1.7 统计学方法采用SPSS 20.0统计软件处理数据,计量资料以“均数±标准差”表示,多组间进行单因素方差分析,LSD-t检验进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 超声心动图检查结果LPS组,LPS注射6h后小鼠精神不佳,萎靡不振,活动度明显下降,小鼠心率显著降低。TL组相比较于LPS组,小鼠心率有所上升(P<0.05)。LPS组小鼠左心室整体收缩功能显著下降,与CON组小鼠相比较,LPS组小鼠和TL组EF、FS、SV和CO均下降(P<0.05);与LPS组小鼠相比,TL组EF、FS、SV和CO均升高(P<0.05),显著减轻LPS诱导的小鼠心收缩功能不全。T组与CON组小鼠相比,心功能无显著性差异,提示丹参酮IIA单独作用对小鼠心功能影响不大(见图1、表1)。
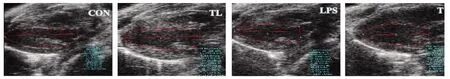
图1 二维超声心动图B膜长轴切面
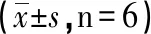

指标CON组LPS组TL组T组EF(%)90.48±2.5380.98±0.8∗∗##85.63±2.71∗∗##87.14±1.49∗##FS(%)27.74±1.8423.76±3.27∗∗27.03±0.79#26.42±0.64#CO(mL/min)11.71±0.96.3±0.93∗∗7.85±0.9∗∗#8.88±1.2∗∗##SV(μL)21.03±1.2213.38±1.11∗∗15.7±0.76∗∗#17.97±2.42∗##HR(bpm)560.83±14.27469.53±39.44∗∗521.12±11.83∗∗##533.31±12.41##
注:与CON组比较,*P<0.05,**P<0.01;与LPS组比较,#P<0.05,##P<0.01
2.2 HE染色结果光学显微镜下,CON组小鼠的心肌纤维排列整齐,横纹清晰,肌束清楚,裂隙正常,胞核明显;LPS组心肌组织横纹模糊,胞浆淡染,肌束不清晰,胞核有扭曲,有炎细胞浸润。TL组,心肌裂隙较宽,胞质疏松呈颗粒状,炎细胞不明显。T组,心肌纤维紧密排列,横纹明显,胞核胞质未见明显异常,细胞无肿胀(见图2)。
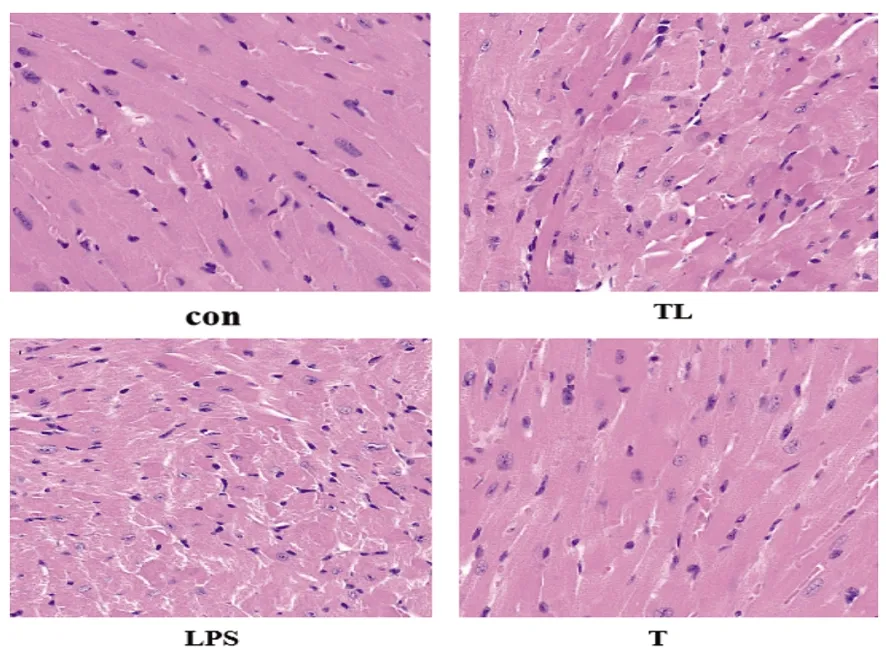
图2 各组小鼠心脏组织病理学变化(×400)
2.3 酶联免疫吸附的实验结果检测心肌组织炎性细胞因子白介素-1β(IL-1β)。与CON组小鼠相比较,LPS组小鼠和TL组心肌组织所含IL-1β均升高(P<0.01);与LPS组小鼠相比,TL组和T组心肌组织IL-1β均降低(P<0.01)(见图3)。
2.4 Western blot检测结果与CON组小鼠相比较,LPS组小鼠和TL组心肌组织RhoA蛋白表达升高(P<0.01),Rock1蛋白表达也升高(P<0.05);与LPS组小鼠相比,TL组和T组心肌组织的RhoA蛋白表达量减少(P<0.01),Rock1蛋白的表达水平亦减少(P<0.05)(见图4、图5、图6)。

图3 ELISIA检测小鼠心肌组织IL-1β含量
注:与CON组比较,*P<0.05,**P<0.01;与LPS组比较,#P<0.05,##P<0.01

图4 不同组别目的蛋白的表达水平
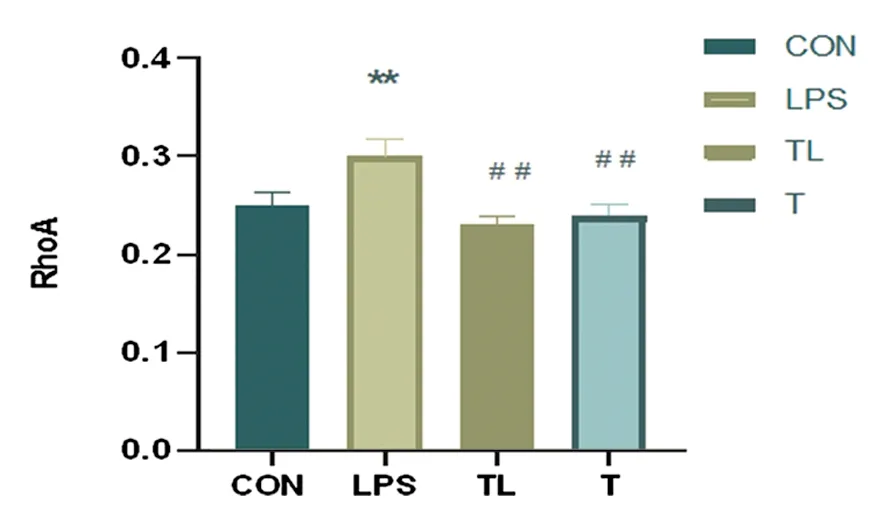
图5 蛋白质印迹法检测小鼠心肌组织RhoA水平
注:与CON组比较,**P<0.01;与LPS组比较,##P<0.01
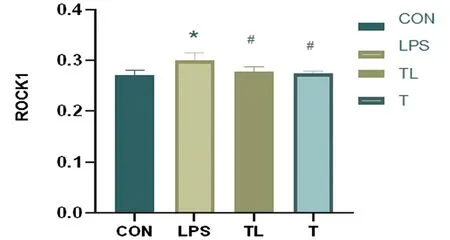
图6 蛋白质印迹法检测小鼠心肌组织Rock1水平
注:与CON组比较,*P<0.05;与LPS组比较,#P<0.05
3 讨论
内毒素血症是临床常见病,心功能不全是常见并发症,严重的心肌受损是引起患者死亡重要原因之一,临床上多集中于抗生素的应用,一定程度可控制感染,但增加了内毒素血症风险;抗炎性细胞因子的生物制剂在动物实验的疗效显著,但临床试用疗效欠佳[7]。腹腔注射LPS诱导内毒素血症的动物模型相对稳定,能引起心功能不全以及明显的心肌损伤。
RhoA/Rock通道下游效应分子Rho激酶(Rho相关卷曲螺旋形成蛋白激酶)又名Rock,是一种丝氨酸/苏氨酸蛋白激酶。Rock的分子量大约在160kDa左右,有Rock1和Rock2两种异构体,其氨基酸序列65%有同源性。它们结构相似,但在人体组织分布不太均匀。Rock1主要分布于心脏、肝脏、肾脏等脏器,在脑中几乎没有表达;而Rock2则主要在大脑表达,心脏组织也有分布[8-9]。在血管平滑肌和心脏均有两种蛋白表达[10]。大量研究表明,RhoA/Rock信号通路参与心肌肥厚、心肌缺血[11]、血管平滑肌增生和心肌纤维化,与心血管疾病密切关[12]。RhoA /Rock信号通路的激活在病理性心脏重构中起着不可忽略的作用,通过抗氧化、抗炎等多途径来保护心脏。不同亚型Rock对心脏的作用不太相同,目前常用的Rho激酶抑制剂Y27632和法舒地尔无特异性,随着广泛深入的研究,Rock抑制剂有望成为治疗或预防心脏重构新靶点,实际临床应用也还需要很多实践佐证,特异性亚型的抑制剂还需进一步研究[13]。
活血化瘀类中药治疗内毒素血症,可将对抗性与保护性治疗相结合[14-15],可通过多途径、多环节、多靶点发挥作用,既有直接拮抗内毒素作用,又能增强机体免疫,起到解毒功效,具有广阔的研发前景。丹参酮在临床上应用较为广泛,丹参酮IIA是唇形科植物丹参中的脂溶性活性成分之一,能有效抑制大鼠心脏成纤维细胞增殖和表型转化,减少细胞外基质产生,延缓心肌纤维化[16-17],但其具体作用机制仍未明确。RhoA/Rock通路蛋白在冠脉内皮细胞及心肌细胞均有表达,在缺血再灌注过程中也发挥着重要作用。谷化剑[18]等人通过实验得出,丹参中的单体丹参酮IIA对梗阻性黄疸并发内毒素血症的大鼠心肌细胞有一定的保护作用。另有研究发现丹参酮可抑制RhoA/Rock信号通路来影响心肌纤维化的进程[6],有研究发现,活血化瘀中药丹参对内毒素刺激下肝巨噬细胞分泌的细胞因子IL-1、IL-6、TNF-α有明显的抑制作用,这种抑制作用呈剂量依赖性[19]。在结扎冠状动脉左前降支的小鼠缺血模型中,丹参酮和葛根素联合使用可以减少炎细胞的浸润,减少胶原蛋合成,抑制心肌纤维化和心室重构,改善心功能[20]。丹参酮ⅡA可以减轻心肌梗死的损伤,可能与TLR4/MyD88/NF-κB信号通路相关[21],用LPS诱导细胞模型,筛选活血化瘀类中药对抗内毒素作用的过程中发现,炎症性细胞因子IL-1β在丹参酮ⅡA干预后明显下调[22-23]。诸多实验研究证明,丹参酮对心血管疾病有着明显影响,本实验结果也显示丹参酮ⅡA可以降低内毒素血症引起的心肌组织IL-1β的表达增加,结果与部分研究者相似[22]。但是否直接抑制炎性细胞因子并不清楚,具体途径和调节的节点,还有待研究。
本实验结果表明,跟空白对照组相比较,模型组小鼠心脏收缩功能下降,主要表现在HR、SV、EF、FS、CO的降低。心肌组织形态有损伤性改变,心肌组织的IL-1β,RhoA、Rock1蛋白表达明显上升,跟模型组比较,丹参酮预处理组可以明显改善心脏收缩功能和保护组织结构,下调IL-1β,RhoA、Rock1蛋白含量,丹参酮组的影响均不太明显。
4 结论
综上所述,本研究提示,脂多糖诱导
小鼠的内毒素血症时可激活RhoA/Rock通道,引起心肌组织炎症因子IL-1β表达增加,小鼠心功能不全,心肌受损。丹参酮对内毒素诱发的小鼠心功能不全,起到一定的保护作用,可以预防心肌受损,很可能跟抑制RhoA/Rock通道,减少相关炎症因子的表达,具体机制还有待进一步的探讨和研究。心肌损伤机制很多,涉及范围广,目前研究的领域也很宽,在诸多现象和研究结果中寻找规律性变化以及建立起可靠的联系,为中药开发推广提供有力理论支持,为心血管疾病机制的研究和临床用药提供一定的理论依据,是我们努力的方向。
