针刺治疗PTSD神经生物学研究进展
2020-06-30宋凯张虹熊凡捷黄爱玲
宋凯 张虹 熊凡捷 黄爱玲
摘要 近年来,随着经济社会的快速发展与社会关系的复杂化和多元化,诸如自然灾害、暴力犯罪、性侵害等创伤性事件频频发生,创伤后应激障碍(PTSD)的关注度正在逐年上升,如何防治PTSD成为重要的研究课题。针灸作为我国传统医学的瑰宝,在精神疾病的预防和治疗方面有着丰富的经验和独特的优势,临床研究证实,针刺能有效改善PTSD的相关症状,然而其神经生物学机制到底为何,至今仍无定论。基于此,本文综述了近些年发表的相关研究,企图初步揭示针刺治疗PTSD内在的神经生物学机制,为临床治疗提供参考。
关键词 针刺;穴位;治疗;创伤后应激障碍;神经生物学;神经元;机制;研究
Research Advances of Acupuncture in Neurobiology Therapy for Post-Traumatic Stress Disorder
SONG Kai,ZHANG Hong,XIONG Fanjie,HUANG Ailing
(Department of Acpuncture and Tuina,Chengdu University of TCM,Chengdu 610000,China)
Abstract In recent years,with the rapid development of the economy and society and the complexity and diversification of social relations,traumatic events such as natural disasters,violent crimes and sexual assaults have frequently occurred.Attention to post-traumatic stress disorder (PTSD) is increasing year by year.How to prevent PTSD becomes an important research topic.As a treasure of traditional Chinese medicine,acupuncture has rich experience and unique advantages in the prevention and treatment of mental diseases.Clinical studies have confirmed that acupuncture can effectively improve the symptoms related to PTSD,but its internal mechanism is still unclear.Based on this,this paper reviewed relevant studies published in recent years,in an attempt to preliminarily reveal the intrinsic neurobiological mechanism of acupuncture treatment for PTSD and provide reference for clinical treatment.
Keywords Acupuncture; Acupoints; Treatment; PTSD; Neurobiology; Neurons; Mechanism; Research
中图分类号:R245文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.24.030
创伤后应激障碍(Post-traumatic Stress Disorder,PTSD)是一种使人衰弱的精神障碍,通常暴露于诸如人为灾害、机动车事故、儿童虐待等创伤性接触事件[1]。流行病学研究显示,世界上一半以上的人口经历过创伤事件,PTSD的终生患病率和平均患病率分别为6.8%和8%[2]。在我国,由于近些年灾害性事件频发,PTSD发病率也呈上升趋势,如1998年张北地震受灾人群9个月后PTSD发病率为24.4%。2008年四川5.12地震后PTSD发生率高达37.8%[3]。精神疾病的诊断和统计手册第四版(DSM-IV)把创伤后应激障碍的特征定义为重新體验创伤记忆,回避创伤提醒,以及普遍的过度兴奋[4]。PTSD通常与其他精神疾病同时发生,最常见的并发症诊断是抑郁症[5]。目前,对于PTSD的主要治疗方法包括以认知行为疗法(CBT)为主的心理疗法和药物疗法,但这2种方法存在患者配合度差、高戒断率等缺陷。针灸是中医学的瑰宝,在治疗神志疾病方面有着丰富的经验和独到的优势。国外文献报道,针刺已经被证明在治疗创伤后应激障碍和抑郁症方面有潜在的好处[6],然而,其内在的机制仍然值得,神经生物学机制是当今阐释PTSD发病成因研究较为深入而且理论相对成熟的机制,有研究表明,PTSD发病的主要神经生物学机制可能包括:HPA轴功能失调、神经递质水平异常、谷氨酸系统失衡以及其他相关蛋白表达异常[7],针刺可能正是通过以上途径发挥其治疗效应。基于此,本文综述了目前已发表的相关研究,企图初步揭示针灸治疗PTSD内在的神经生物学机制,为后续的研究提供参考。
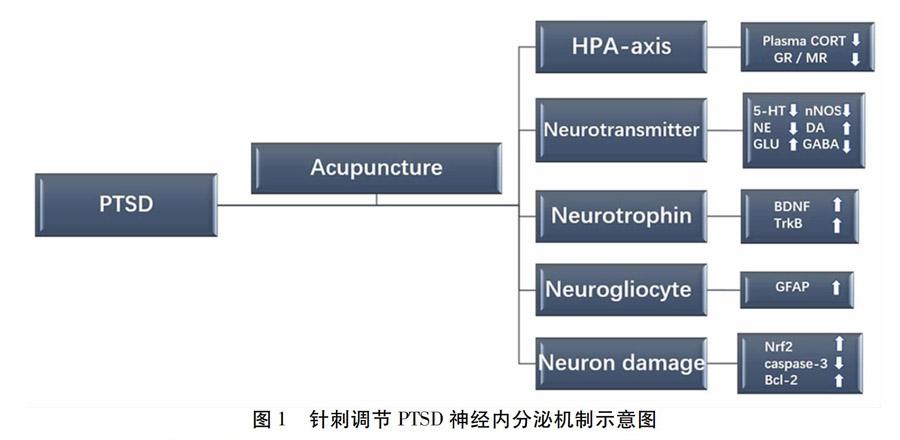
1 针刺对HPA轴的调控
下丘脑-垂体-肾上腺轴(Hypothalamus-pituitary-adrenal Gland,HPA)在应激反应调控中具有重要作用,多种急慢性应激均可通过激活HPA轴而发病。研究发现,PTSD患者存在明显的HPA轴功能紊乱,这主要表现为促肾上腺皮质激素释放因子(CRF)改变、糖皮质激素和皮质类固醇受体改变[8]。越来越多的研究指出,糖皮质激素负反馈抑制作用增强和持续性低皮质醇反应可能是PTSD患者HPA轴功能紊乱的病理核心。相关研究表明,针刺可以实现对HPA轴的良性调节,可促进ACTH的分泌,增加肾上腺皮质重量,升高血中皮质醇含量[9],因此调控HPA轴相关激素水平的变化可能是针刺治疗PTSD的重要靶点之一。
方氏研究发现[10],电针可以减轻PTSD模型大鼠的焦虑情绪的作用,这可能与电针降低血清皮质酮水平,从而降低HPA轴活性有关。姚氏等[11]探讨针刺对慢性情绪应激焦虑大鼠肾上腺ANP、CNP及血浆CORT水平的影响,发现针刺治疗慢性应激焦虑障碍可能与减少CORT的释放、抑制HPA轴有联系。盐皮质激素受体(MR)和糖皮质激素受体(GR)参与调节血中皮质酮水平,二者共同参与HPA轴的负反馈调节[12],GR/MR比值的增加,可能是PTSD表型的生物标志物之一[13]。候氏等人的研究表明[14],采用低频电针刺激PTSD模型大鼠“百会”“足三里”穴可以改善其空间学习记忆能力,这与电针修复受损的海马神经元,影响MR和GR的表达,调节它们之间的平衡,进而影响HPA轴的活性有关。
2 针刺对异常神经递质水平的调节
根据目前的相关研究,5-羟色胺(5-HT)、去甲肾上腺素(NE)、多巴胺(DA)和谷氨酸能神经相关递质可能是PTSD神经生物学机制中最重要的几类神经递质,上述神经递质水平的失调可能会引起PTSD的相关病理变化[15]。针刺可能通过调控这些神经递质水平的变化治疗PTSD,这也是近年来关注较多的研究领域。
2.1 5-羟色胺(5-HT)
5-羟色胺是当前治疗PTSD一线药物SSRIs(5-HT再摄取抑制剂)治疗效应的主要靶点,在创伤后应激障碍的研究中备受关注。5-HT在前脑的主要来源是中缝背核,在包括情绪、社交和奖励相关的许多功能中发挥作用,并可能与CRF和CORT信号相互作用,从而导致应激与压力等相关疾病[16]。林氏等采用连续单一刺激构建PTSD大鼠模型[17],探讨5-HT1A受体调控PTSD大鼠空间记忆的机制,结果表明,与对照组比较,PTSD模型组大鼠海马CA1区5-HT1A受体的表达显著增加,这最终导致了PTSD大鼠空间记忆能力减退。
丁氏观察了针刺与艾灸对慢性不可预见性温和应激抑郁模型大鼠前额皮质5-HT能系统的影响[18],发现针刺及艾灸大椎、百会三周后,可以降低模型大鼠前额皮质5-HT的分解代谢水平,并改善前额皮质突触后膜5-HT1A受体的低敏状态。祁氏等以焦虑模型大鼠为观察对象[19],发现电针与五行音乐均能对焦虑模型大鼠高架十字迷宫行为学产生影响,并且降低模型大鼠下丘脑5-HT含量发挥抗焦虑效应。袁氏在情绪应激焦虑大鼠中枢5-羟色胺(5-HT)水平的调节作用及对其代谢产物含量的影响的研究中也得出了类似的结论[20],电针“百会”“三阴交”穴治疗21 d后,运用荧光分光光度法测定大鼠下丘脑、杏仁核区5-HT的含量,结果显示电针可降低模型大鼠以上2个脑区5-HT及5-HIAA的含量。
2.2 去甲肾上腺素(NE)与一氧化氮(NO)
NE从LC(蓝斑核)释放到前脑,在觉醒和注意力方面起着关键的调节作用。其功能障碍可能导致创伤后应激障碍的症状,尤其是那些涉及觉醒的症状,如过度警惕、惊吓、睡眠中断和创伤提示反应等[21]。临床和基础研究证明,去甲肾上腺素能系统在情绪记忆的调控中起着关键的作用,尤其是与PTSD密切相关的条件性恐惧记忆的编码和异常巩固。相关研究表明,针刺可能通过抑制去甲肾上腺素能系统的高活动,减弱对刺激的反应及创伤记忆的过度巩固,从而阻止PTSD的形成。魏氏以慢性情绪应激焦虑模型大鼠为观察对象[22],电针大鼠“百会”,“三阴交”穴后,运用荧光分光光度法分别测定大鼠下丘脑、杏仁核区去甲肾上腺素(Norepinephrine,NE)的含量,结果显示电针组两脑区儿茶酚胺类神经递质含量下降(P<0.05)。表明电针抗焦虑效应可能与降低中枢儿茶酚胺类神经递质有关。
另有研究表明,一氧化氮(NO)以及神經元型一氧化氮合酶(nNOS)可能参与了PTSD突触可塑性损伤、学习记忆能力下降等病理过程。谢氏等观察了电针对PTSD模型大鼠蓝斑核神经元型一氧化氮合酶(nNOS)表达的影响[23]。结果显示低频电针大鼠“百会”,“足三里”穴后,大鼠蓝斑nNOS(P<0.01)阳性细胞数明显减少,平均灰度值显著增加P<0.01)。
候氏采用SPS法制作PTSD模型大鼠[24],造模后电针大鼠“百会”,“足三里”,RT-PCR方法和免疫组织化学结果显示,电针组大鼠海马nNOS mRNA表达恢复性下调,海马CA1区、CA3区、nNOS蛋白表达恢复性下调(P<0.05)。表明调nNOS的表达可能是电针治疗PTSD机制之一。
2.3 多巴胺(DA)
最近的证据表明DA可能在与创伤后应激障碍相关的行为中扮演着独特的角色,包括恐惧学习和消退、成瘾和快感缺乏症。多项临床研究表明DA功能障碍与PTSD有关[25]。
潘氏研究发现[26],对情绪应激模型大鼠针刺后,与模型组比较,外周血的DA含量明显上升,差异有统计学意义(P<0.01)。王氏研究发现针刺可以有效地上调海马DA的水平[27],改善应激导致的大鼠焦虑和抑郁状态,可能的机制是通过调节DA系统对伤害性刺激的紧张性抑制作用,减轻应激对机体的损伤。
2.4 谷氨酸能神经递质
谷氨酸(Glu)与γ-氨基丁酸(GABA)作为重要的中枢神经系统兴奋性和抑制性递质,二者的平衡对维持神经系统正常功能具有重要意义。其中,Glu可与NMDA受体相互作用,在突触可塑性、长时程增强等涉及PTSD学习记忆功能中发挥重要作用。常氏观察了针刺对慢性束缚应激模型大鼠额叶和海马中谷氨酸受体2/4(Glu R2/4)表达的影响[28],针刺“百会”“印堂”“三阴交”后,用Western Blot检测大鼠海马和额叶中Glu R2/4表达,结果提示针刺组Glu R2/4在海马、额叶的表达显著上升(P<0.01)。张氏以GLU/GABA兴奋/抑制平衡调节系统为切入点[29],研究针刺抗抑郁的中枢机制及分子靶点,针刺大鼠“百会”“内关”“三阴交”后,海马脑区GLU和GABA的含量失衡得以逆转,进一步的研究表明,这种作用可能与减少海马NMDA受体亚单位NR1和NR2A的蛋白表达,从而减轻GLU的兴奋性毒性有关。潘氏观察了针刺“四神聪”“内关”“三阴交”穴对慢性不可预见性轻度应激抑郁模型的影响,结果提示,经过针刺干预,使慢性应激抑郁大鼠模型海马脑区GLU含量明显升高(P<0.01),GABA含量明显降低(P<0.01)。而且针刺后谷氨酸脱羧酶(GAD65,GAD67)、谷氨酸转运体(EAAT3)、GABA转运体1(GAT1)等蛋白表达均发生变化[26],因此推测针刺抗抑郁机制可能与兴奋性氨基酸谷氨酸及其受体的表达有关。
3 针刺对神经营养因子的调节
神经营养因子(NTFs)是一组对神经细胞起特殊营养作用的多肽分子,是诸多细胞生长调节因子中的一类。近年来的研究表明,神经营养因子具有抑制神经元损伤,调节突触可塑性和神经递质的传递等功能。目前,在PTSD的研究领域,对神经营养因子BDNF以及相关信号通路研究较为深入。许多研究表明,针刺可能通过调节BDNF在相关脑区的表达以及下游信号通路相关蛋白的变化参与PTSD的治疗过程。丁氏观察了电针对PTSD大鼠杏仁核BDNF-TrkB-ERK信号通路的影响[30],结果显示,电针干预后PTSD大鼠杏仁核BDNF、TrkB表达上调,这可能最终影响了PTSD大鼠恐惧的获得、消退和重建,从而对PTSD发挥治疗作用。李氏的研究得到了相似的结论[31],电针可上调PTSD大鼠海马BDNF、GAP-43、SYN表达,促进受损海马功能恢复,从而恢复海马学习记忆及海马突触可塑性。李氏以慢性温和不可预知应激模型大鼠为研究对象,探讨手针“百会”,“印堂”干预对脑源性神经营养因子表达的影响[32],结果表明手针通过增加BDNF蛋白表达,改善模型大鼠抑郁样行为,从而发挥抗抑郁效应。朱氏等观察了电针对PTSD大鼠内侧额叶皮质与杏仁核BDNF表达的影响[33-34],采用连续单一刺激构建PTSD模型,电针“足三里”穴和“百会”穴,频率为2Hz,时间30 min,1次/d,连续电针21 d,用免疫组织化学方法观察电针干预后相关脑区BDNF的表达,结果显示,电针可抑制PTSD大鼠内侧额叶皮质和杏仁核BDNF的下调,从而调节神经元活性,恢复相关神经环路功能。郏氏等探讨了电针对急性应激的调节作用[35],采用急性束缚2 h制备急性束缚性应激模型,电针大鼠双侧足三里和三阴交后,采用Western bolt技术检测大鼠海马组织中BDNF/Trk B蛋白表达水平,结果显示,与其他组别比较,电针组海马组织BDNF和Trk B mRNA表达水平明显上升(P<0.05),这可能是电针抗急性应激的内在机制。见图1。
4 针刺对神经胶质细胞的调节
神经胶质细胞广泛分布于中枢和外周神经系统中,具有支持、营养和修复的作用,对发挥神经元保护、稳定机体内环境意义重大。研究发现,星形胶质细胞与诸多神经营养因子和突触可塑性密切相关,其中星形胶质细胞细胞表面标志物胶质纤维酸性蛋白(GFAP)可能是针刺治疗PTSD等诸多脑病的重要靶点之一。董氏观察了针刺对慢性束缚应激模型大鼠海马GFAP表达的影响[36],针刺模型大鼠“百会”“印堂”、双侧“三阴交”后,用免疫蛋白印迹
(Western Blot,WB)法检测大鼠海马GFAP含量。结果显示,针刺可显著上调模型大鼠AST(海马星形胶质细胞)中GFAP的表达。姜氏探讨电针在修复星形胶质细胞损伤介导的抗抑郁作用机制[37],采用慢性不可预见性温和刺激联合孤养建立抑郁大鼠模型,电针四关穴3周后,大鼠海马GFAP含量和GFAP mRNA表达升高,与正常对照组比较差异有统计学意义(P<0.05)。提示电针修复星形胶质细胞损伤可能与提升海马组织GFAP含量有关。
5 针刺对神经元凋亡/氧化应激的调节
研究发现,PTSD的发病与海马形态改变、神经元发生减少和椎体神经元丢失有关[38]。PTSD动物模型显示神经元凋亡增加和氧化损伤可能是海马结构和功能损伤的原因。因此,抑制氧化损伤和抗海马神经元凋亡有利于创伤后应激障碍的恢复,这可能是针刺发挥治疗效应的另一个重要靶点。Zhou氏等研究发现[39],采用ESPS构建PTSD大鼠模型,造模14 d后,测定海马组织Nrf2、keap1、HO-1以及AMPK的表达。结果表明,电针能增加Nrf2和HO-1的表达,提高AMPK的活性。电针预处理可通过调节keap1/Nrf2抗氧化防御通路,改善了ESPS诱导的焦虑样行为,并且对创伤后应激障碍大鼠海马神经元发挥保护作用。孙氏观察了针刺对慢性束缚应激模型大鼠海马凋亡相关因子的影响[40],针刺组于每日应激前1 h针刺“百会”,“印堂”和双侧“三阴交”,用Western Blot法检测大鼠海马组织细胞色素C、caspase-3和AIF的蛋白表达水平,用荧光探针技术检测大鼠海马组织活性氧ROS)的含量。结果显示针刺干预能显著降低抑郁模型大鼠海马组织凋亡途径的关键因子细胞色素C、caspase-3和AIF蛋白表达水平,其机制可能与下调线粒体ROS含量有关。梁氏等以慢性应激构筑抑郁模型大鼠,用免疫组化的方法检测海马组织中抗凋亡因子Bcl-2的表达[41],结果显示,电针组干预后Bcl-2含量升高,差异有统计学意义(P<0.05)。提示电针可能通过调节海马神经元凋亡与再生从而改善模型大鼠的行为学表现。
6 结语
近年来,随着医学模式向生物-社会-心理模式转变,经济社会的快速发展与社会关系的复杂化、多元化。诸如交通事故、暴力犯罪、性侵害等创伤性事件频频发生,各种自然灾害、局部战争也屡见报端,创伤性应激障碍正在变得越来越常态化。课题组在前期关于地震后PTSD患者多中心、大样本随机对照研究中,我们发现针灸疗法优势明显,电针单用或者联合灸法或耳穴优于或相当于PTSD一线治疗药物帕罗西汀,但针刺起效的内在机制到底为何,至今仍未研究透彻,笔者在梳理相关文献后,发现针刺治疗PTSD的神经生物学主要与HPA轴调控、神经递质、神经营养因子、神经胶質细胞和神经元氧化应激与凋亡等有关。总的来说,针灸干预PTSD神经生物学机制的相关报道仍然很少,而且干预手段较为单一,除电针外,很少有研究涉及灸法、推拿、拔罐等疗法的应用,此外,关于针刺手法和辨证选穴的研究也鲜有提及,这可能是后续研究的方向之一。PTSD发病机制十分复杂,除了神经生物学外,尚需要从免疫机制、基因组学、电生理学等多学科、多维度来阐释针灸的作用机制,以期为针灸预防和治疗PTSD的临床实践提供更多的依据。
参考文献
[1]Kessler RC,Sonnega A,Bromet E,et al.Posttraumatic stress disorder in the national comorbidity survey[J].Arch Gen Psychiatry,1995,52(12):1048-1060.
[2]Liu H,Petukhova MV,Sampson NA,et al.Association of DSM-IV Posttraumatic Stress Disorder With Traumatic Experience Type and History in the World Health Organization World Mental Health Surveys[J].JAMA Psychiatry,2017,74(3):270-281.
[3]WANG L,ZHANG Y,WANG W,et al.Symptoms of posttraumatic stress disorder among adult surviors three months after earthquake in China[J].J Trauma Stress,2009,22(5):444-450.
[4]Foa EB,Riggs DS,Gershuny BS.Arousal,numbing,and intrusion:Symptom structure of PTSD following assault[J].Am J Psychiatry,1995,152(1):116-120.
[5]Flory JD,Yehuda R.Comorbidity between post-traumatic stress disorder and major depressive disorder:alternative explanations and treatment considerations[J].Dialogues Clin Neurosci,2015,17(2):141-150.
[6]Pilkington K.Acupuncture therapy for psychiatric illness[J].Int Rev Neurobiol,2013,111:197-216.
[7]王慶松,谭庆荣.创伤后应激障碍[M].北京:人民卫生出版社,2015:109-111.
[8]Yehuda R,Southwick S M,Nussbaum G,et al.Low urinary cortisol excretion in patients with posttraumatic stress disorder[J].J Nerv Ment Dis,1990,178(6):366-369.
[9]蔡宛儒.针灸疗法对抑郁症HPA轴影响的研究进展[J].养生保健指南,2019,18(34):282-284.
[10]方杨琪,蔡定均.电针、重复经颅磁刺激干预PTSD样大鼠焦虑行为及血清皮质酮的比较研究[J].南京中医药大学学报,2012,28(84):357-359.
[11]姚弘,魏大能.针刺对慢性情绪应激焦虑大鼠肾上腺ANP、CNP及血浆CORT水平的影响[J].中国针灸,2016,36(2):169-174.
[12]杜喆,韩芳.PTSD样大鼠海马MR和GR变化的研究[J].中国组织化学与细胞化学杂志,2007,16(6):695-700.
[13]Harris A P,Holmes M C,de Kloet E R,et al.Mineralocorticoid and glucocorticoid receptor balance in control of HPA axis and behaviour.Psychoneuroendocrinology,2013,38(5):648-58.
[14]侯良芹,熊克仁.电针对创伤后应激障碍大鼠行为学和海马糖皮质激素受体表达的影响[J].针刺研究,2013,38(2):140-145.
[15]Davis L,Hamner M,Bremner JD.Pharmacotherapy for PTSD:effects on PTSD symptoms and the brain.In:Posttraumatic Stress Disorder:From Neurobiology to Treatment[J].Douglas Bremner J,2016,24(2):385-412.
[16]Puglisi-Allegra Stefano,Andolina Diego.Serotonin and stress coping[J].Behav Brain Res,2015,277:58-67.
[17]林玲,刘国良.海马CA1区5-HT1A受体调控PTSD大鼠空间记忆的作用[J].中国病理生理杂志,2017,33(1):98-103.
[18]丁宁.针刺与艾灸对抑郁大鼠行为学及前额皮质5-HT能系统作用的差异性研究[D].北京:北京中医药大学,2016.
[19]祁静.电针与五行音乐对焦虑模型大鼠行为学及神经递质5-HT的影响[D].贵阳:贵阳中医学院,2008.
[20]袁旭,蔡定均.电针对慢性情绪应激焦虑大鼠中枢5-HT含量及其代谢物水平的影响[J].时珍国医国药,2014,25(11):2787-2788.
[21]Southwick SM,Bremner JD,Rasmusson A,et al.Role of norepinephrine in the pathophysiology and treatment of posttraumatic stress disorder[J].Biol Psychiatry,1999,46(9):1192-204.
[22]魏大能,周奇志.电针对慢性情绪应激焦虑大鼠中枢儿茶酚胺类神经递质的调节作用研究[J].中国中医基础医学杂志,2014,20(11):1542-1546.
[23]谢康楠,唐国庆.电针对创伤后应激障碍模型大鼠蓝斑nNOS表达的影响[J].医学理论与实践,2015,28(18):2421-2423.
[24]侯良芹,刘嵩.电针对创伤后应激障碍模型大鼠海马神经元型一氧化氮合酶表达的影响[J].中国针灸,2013,33(7):632-636.
[25]Camardese G,Di Giuda D,Di Nicola M,et al.Imaging studies on dopamine transporter and depression:a review of literature and suggestions for future research[J].J Psychiatr Res,2014,51:7-18.
[26]潘清潔.针刺对CUMS抑郁大鼠模型行为学及作用机制的研究[D].广州:广州中医药大学,2016.
[27]王春生.针刺对不同应激源所致心理行为影响的实验研究[D].北京:北京中医药大学,2008.
[28]常磊,姜会梨.针刺对慢性束缚应激模型大鼠额叶和海马谷氨酸受体2/4表达的影响[J].中华中医药杂志,2018,33(6):2327-2330.
[29]张黎恒.针刺对抑郁模型大鼠海马GLU/GABA兴奋/抑制调节系统的作用研究[D].昆明:云南中医学院,2016.
[30]丁宁.基于杏仁核BDNF-TrkB-ERK信号通路探究“安神醒脑调肾”电针法对PTSD大鼠恐惧记忆的影响[D].成都:成都中医药大学,2018.
[31]李欣.“安神醒脑调肾”电针法对PTSD大鼠学习记忆及海马突触可塑性相关蛋白表达影响的研究[D].成都:成都中医药大学,2018.
[32]李想,许明敏.手针干预对慢性温和不可预知应激模型大鼠前额叶皮层细胞外调节蛋白激酶1/2脑源性神经营养因子表达的影响[J].针刺研究,2018,43(11):705-710.
[33]朱秀玲,鲁亚平.电针抑制PTSD对内侧额叶皮质BDNF的下调和GABAARa1的上调[J].中国组织化学与细胞化学杂志,2016,25(1):54-58.
[34]朱秀玲,鲁亚平.电针抑制PTSD对杏仁核TH的上调和BDNF的下调[J].皖南医学院学报,2019,38(2):115-119.
[35]郏丹赟,李芝慧.电针对急性束缚性应激大鼠海马BDNF/TrkB表达的影响[J].中国中西医结合杂志,2018,38(7):865-869.
[36]董莎.针刺对慢性束缚应激模型大鼠海马/额叶GFAP和血清IL-10表达的影响[D].北京:北京中医药大学,2018.
[37]姜硕.电针修复慢性应激致抑郁大鼠海马星形胶质细胞损伤的机理研究[D].广州:广州中医药大学,2013.
[38]Cohen H,Kozlovsky N,Matar MA,et al.Distinctive hippocampal and amygdalar cytoarchitectural changes underlie specific patterns of behavioral disruption following stress exposure in an animal model of PTSD[J].Neuropsychopharmacol.2014,24(12):1925-44.
[39]Zhou CH,Xue F.Electroacupuncture Pretreatment Ameliorates PTSD-Like Behaviors in Rats by Enhancing Hippocampal Neurogenesis via the Keap1/Nrf2 Antioxidant Signaling Pathway[J].Front Cell Neurosci,2019,13:275.
[40]孙阳,图娅.针刺对慢性束缚应激抑郁模型大鼠海马凋亡相关因子的影响[J].针刺研究,2019,44(6):412-418.
[41]梁佳,李卫东.电针对慢性应激抑郁模型大鼠海马神经元凋亡与再生的影响[J].中华中医药杂,2012,27(4):47-950.
(2020-03-23收稿 责任编辑:徐颖)
基金项目:国家自然科学基金面上项目(81873384)——基于BDNF-TrkB通路探讨疏肝调肾针法对PTSD大鼠海马、杏仁核突触可塑性损伤修复的机制研究作者简介:宋凯(1993.01—),男,博士研究生,研究方向:针灸治疗PTSD的临床和实验研究,E-mail:mrsongkai@163.com通信作者:张虹(1960.01—),女,本科,教授,研究方向:针灸治疗脑病的临床和实验研究,E-mail:hzhang0123@foxmail.com
