AlH3热分解释氢机理研究进展
2020-06-30蔚明辉李和平庞爱民徐星星刘建忠周禹男徐江荣
蔚明辉,李和平,庞爱民,唐 根,徐星星,刘建忠,周禹男,徐江荣
(1.杭州电子科技大学 能源研究所,杭州 310018;2.浙江大学 能源清洁利用国家重点实验室,杭州 310027;3.湖北航天化学技术研究所 航天化学动力技术重点实验室,襄阳 441000)
0 引言
固体火箭发动机广泛应用于导弹和小型卫星发射等领域,固体推进剂是固体火箭发动机的动力源,其能量水平的高低对战略和战术导弹的作战能力产生深远影响[1-4]。对未来固体推进剂的发展而言,研制和开发出高能量的推进剂是主要方向,并且需要降低生产成本以及减少对环境的污染[5]。
目前,提高推进剂比冲的有效方法是通过降低燃烧室内燃气的平均分子质量[6]。因此,将储氢材料用作推进剂的添加组分,其在燃烧室中受热时会释放氢气并参与燃烧,能显著提高固体推进剂的能量水平。常见的金属氢化物属于典型的固态化学吸附储氢材料,主要包括LiH、NaH、MgH2、AlH3等,且AlH3由于其质量储氢为10.08 %和体积氢含量为1.48 g / cm3,两者都分别超过2015年美国能源部(DOE)定的质量储氢5.5%和体积含氢为1.3 g / cm3的系统目标,已被美国能源部认定为领先的储氢材料[7-8]。且与传统的铝粉相比,AlH3由于吸热释氢的反应降低了燃烧温度(在1 MPa的空气中AlH3为3310 K,Al为3912 K);AlH3降低了燃烧产物中CO2,OH,H2O的平均分子量(燃气的平均分子量AlH3为10.8%,Al为11.5%)从而减弱了喷喉烧蚀并提高了固体推进剂的比冲[9]。但由于AlH3在空气气氛中易氧化、对水敏感、化学稳定性和热稳定性差,将其加入固体推进剂中会导致感度高、危险性大等问题,严重影响了AlH3在固体推进剂中的应用[10-12]。为了使AlH3能够得到更广泛的应用,国内外学者围绕AlH3的释氢机理及影响因素进行了大量研究。
本文主要针对AlH3的热分解释氢特性、释氢动力学特性、释氢影响因素及调控机制、稳定化改性方法等方面对国内外部分研究工作的成果进行综述,并分析现阶段研究的研究现状和未来仍需研究的重点问题。
1 AlH3热分解释氢过程及机理
自20 世纪40 年代初, Finholt等采用LiH和AlCl3在乙醚溶液中反应首次制得AlH3以来,科研人员对AlH3的合成研究一直方兴未艾[10-13]。其合成方法主要包括乙醚法、氢化镁研磨法、NaAlH4-THF 法、二烷基氢化铝还原法等。在掌握合成制备方法的基础上,国内外学者开始对其热分解过程及机理进行研究。
1.1 AlH3热分解释氢特性
AlH3具有多相性,每一种晶型都有各自固定的原子排列方式,具有独特的热力学性质,其中α-AlH3稳定性最高,最具有应用前景[14-15]。因此,研究AlH3不同晶型的热分解特性对揭示其释氢机理有重要作用。相关研究[16-17]发现α′、β、γ-AlH3与α-AlH3相比较下稳定性较差,在较高温度下(≥100 ℃)发生过渡转变为α相的放热反应,且在过渡转变过程中不会有氢损失,不同晶型过渡转变的能量分别为:-1.1 kJ/mol(α′→α)、-1.0 kJ/mol(β→α)和-1.9 kJ/mol(γ→α);在低温下较不稳定的晶型热分解过程较为复杂,一部分直接分解成Al单质和H2,另一部分过渡转变为稳定的α相,然后再分解释氢。
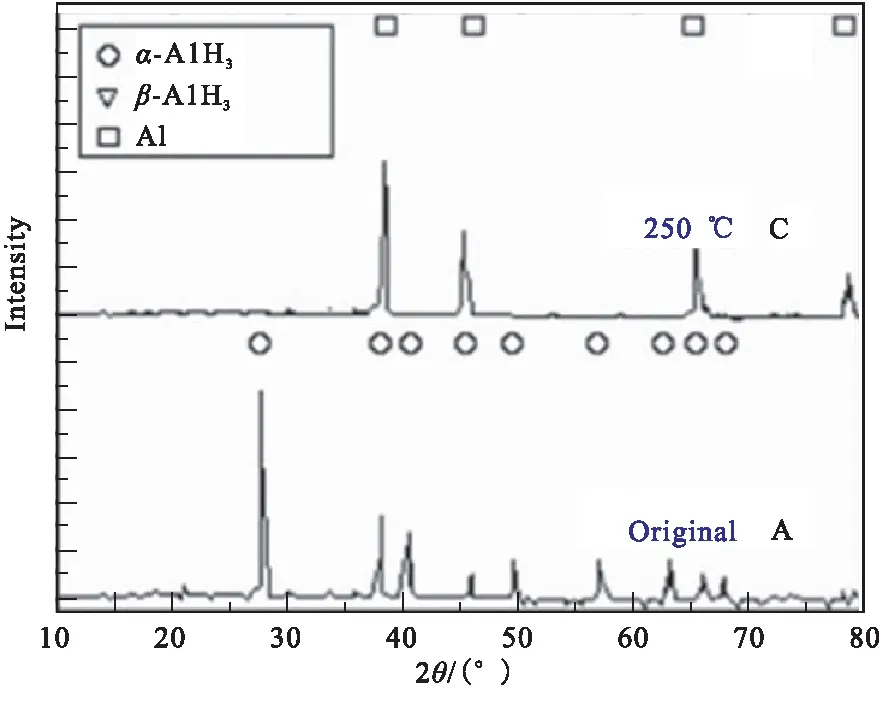
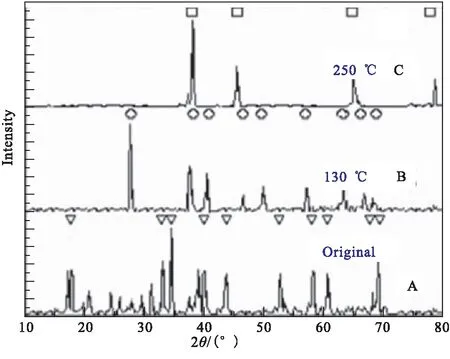
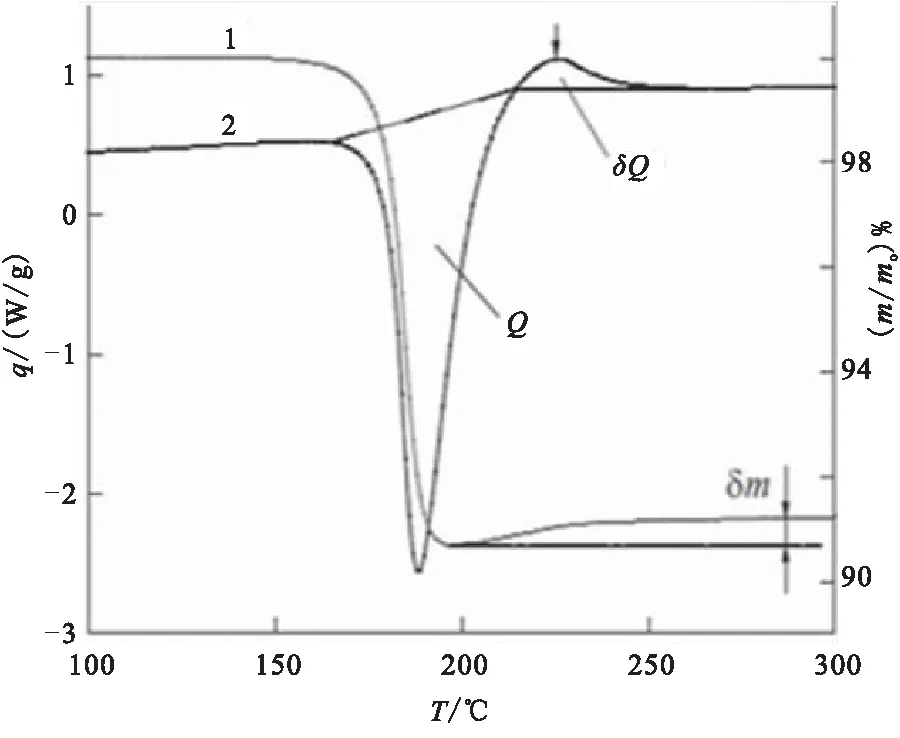
Xu等[18]使用TG-DSC和非原位XRD法研究了通过有机金属合成方法制备的α-AlH3和β-AlH3的热性能。非等温热解过程的TG-DSC曲线如图1所示,并由TG曲线得到α-AlH3和β-AlH3的失重分别为9.81%、9.75%,与固态AlH3含氢量10.1%相一致。α-AlH3的DSC图在165 ℃左右由于α-AlH3的分解仅显示单个吸热峰;β-AlH3的DSC曲线中除了在163 ℃附近观察到吸热峰之外,还在约100 ℃出现明显的放热峰,通过非原位XRD发现是β相向α相转变引起的。对α-、β-AlH3分别在不同温度下进行了热性能实验,研究发现α-AlH3比β-AlH3更稳定;根据图2两种晶型AlH3在不同温度时的XRD图,同样得到了相似结论:在较高温度(≥100 ℃)下,β-AlH3立即转变为α相,然后α相分解成Al和H2(β-AlH3→α-AlH3→Al+ 3/ 2H2);在较低温度(<100 ℃),β相一部分直接分解为Al和H2(β-AlH3→Al+ 3/ 2H2),而更大的部分过渡转变为α相,然后再分解。
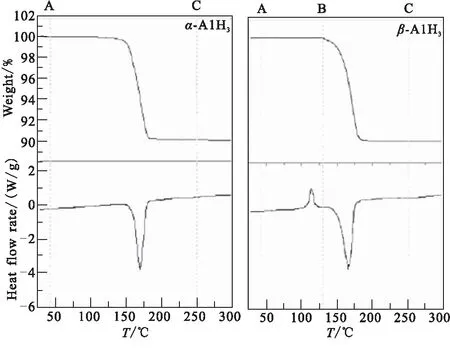
(a)α-AlH3 (b)β-AlH3
Maehle等[19]通过同步辐射X射线衍射(SR-XRD)和热解吸光谱(TDS)法研究了α-AlH3和γ-AlH3在不同加热速率下的热分解特性。图3所示为加热速率为1 K/min时α-AlH3向Al转化过程的SR-XRD图,发现在加热过程中α-AlH3峰的强度逐渐降低,表明α相氢化物的逐渐分解,但这种下降并没有伴随任何明显峰值的扩大,主要是由于形成无定形铝的原因;Al的衍射峰强度首先在约135 ℃开始出现,表明Al的成核和生长过程,且随温度升高Al的衍射峰逐渐增大。在145 ℃,氢化物峰完全消失,表明AlH3向Al转化的完成。通过图4中γ-AlH3分解过程中各相百分比含量可发现:γ-AlH3在80 ℃开始分解,且α相和Al含量开始增加,温度间隔1(25~80 ℃)主要是γ相含量;温度间隔2(80~88 ℃)是α相快速生长,Al生长,γ相减少;温度间隔3(85~95 ℃)是α相生长减慢,γ相减少,Al相快速生长;温度间隔4(95~115 ℃)是α相在115 ℃减少到0,γ相在100 ℃减少到0,Al稳定生长。也说明γ-AlH3热分解存在两个分解过程:(1)γ-AlH3→Al+H2;(2)γ-AlH3→α-AlH3+H2。
(a)α-AlH3
(b)β-AlH3
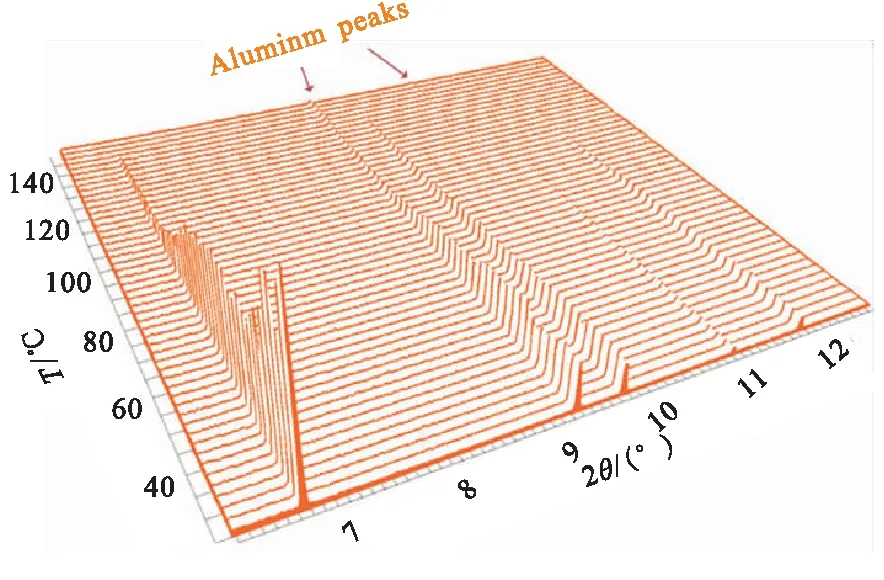
图3 α-AlH3热分解原位SR-XRD图(加热速率1 ℃/min)[19]
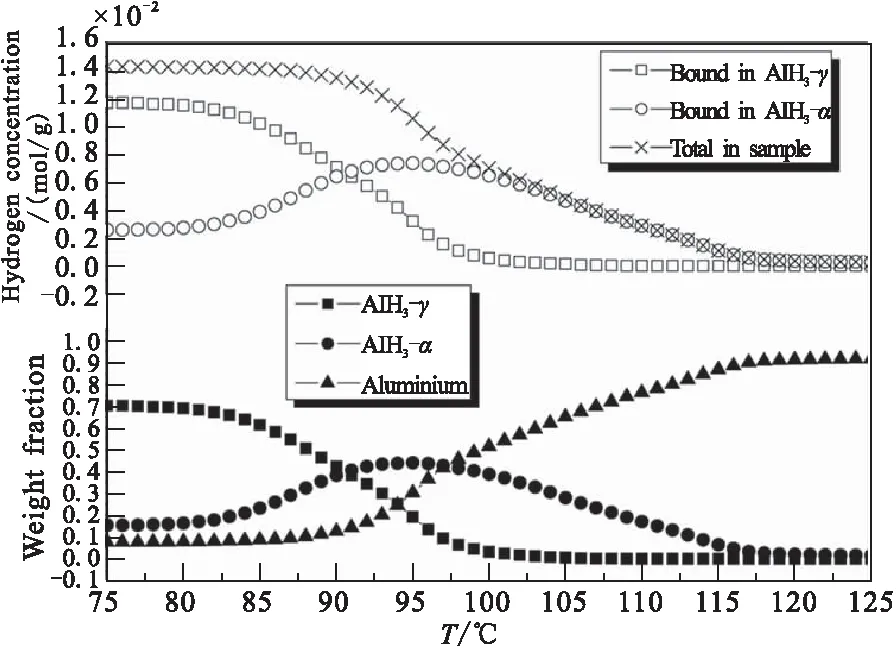
图4 γ-AlH3热分解过程中各相百分比和氢浓度[19]
1.2 AlH3热分解释氢动力学特性
近年来,动力学模型的重大发展帮助研究人员能够更好地开展化学动力学和机理反应的研究,国内外研究者通过动力学方程及模型对AlH3的释氢动力学及机理进行大量的实验研究及动力学参数计算。Herley及Tarasov等[16,20-22]研究表明,AlH3释氢过程中的分解分数(α)与时间之间呈“S”型,曲线如图5所示,可将AlH3的热分解分为三个阶段:第一阶段为诱导阶段(α=0.05),该阶段的反应速率方程为k1=1/τind,反应活化能为97 kJ/mol;第二阶段为加速阶段(α=0.1~0.6),该阶段反应速率方程为α1/3=k2t,反应活化能为108 kJ/mol;第三阶段为衰退阶段(α=0.6~0.9),该阶段的反应速率方程为ln(1-α)-1=k3t,反应活化能为112 kJ/mol。
Ismail和Hawkins等[23]利用真空热稳定性(VTS)和热重分析法(TGA)研究了AlH3非等温分解反应。使用ASTM方法分析动力学数据,得到活化能为(97.0±3.1) kJ/ mol。使用Friedman方法提出了由成核和生长组成的两步反应模型,发现成核步骤是反应速率的限制步骤,其活化能为83.8 kJ/ mol或99.0 kJ/ mol。秦明娜等[24]以LiAlH4和AlCl3制得纯度较高且晶型较好的α-AlH3,并用TG/DTG-DSC联用技术研究其热分解过程。发现在氩气气氛中,线性升温条件下,α-AlH3热分解反应遵循随机成核和随后生长反应动力学模型,计算得到其反应活化能为110.89 kJ/mol,指前因子lnA=26.94 s-1。
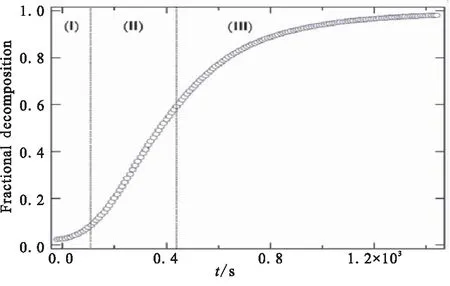
图5 α-AlH3在180 ℃下等温分解曲线图[16]
Graetz等[25]通过有机金属合成制备氢化铝多晶型物(α-AlH3,β-AlH3和γ-AlH3),通过测量60 ℃和140 ℃之间等温释氢过程来研究释氢动力学特性。其分解分数曲线使用二阶和三阶Avrami-Erofeyev方程显示出了良好的拟合结果,表明通过二维和三维的Al相的成核和生长控制分解动力学。且三种晶型的AlH3都呈现相似的分解曲线:较短的诱导期(α<0.04),随后是H2逸出速率增加的加速期(0.04<α<0.7),最后是衰退期(α>0.7)。
1.3 AlH3热分解微观释氢机理
AlH3热分解动力学研究发现分解释氢过程可分为3个不同的阶段,但无法了解释氢过程中样品的微观形貌及氢气释放的方式。基于热分解动力学的研究结果,国内外学者进行了微观释氢机理的研究。
AlH3为典型的核壳结构,内核为氢化铝,外层被一层非晶结构的氧化铝膜包裹,且致密的氧化层抑制了氢气的解吸[26]。由于AlH3的热膨胀系数(5×10-5K-1)远大于Al2O3的热膨胀系数[(0.9~2)×10-5K-1],在受热膨胀时,只有氧化膜发生破裂才会发生氢气的解析[19,27]。Kato等[28]通过原位XPS并结合TDS研究了AlH3在氢解析过程中的样品表面的变化。图6所示为AlH3中氢气在表面解析过程的机理示意图:(a)表面的Al2O3膜抑制氢气的释放;(b)在受热膨胀过程由于氢化物和氧化物的不同热膨胀系数,使得氧化层破裂,AlH3暴露在气体界面处;(c)在氢化物/气体界面处发生氢气的解析以及金属Al相的生长。
Gabis等[29-30]使用等温气压法、TDS和SEM方法研究AlH3的脱氢动力学,发现在一些氢解析后,金属铝核随即出现,且由于Al金属中的Al-Al键的距离短于α-AlH3中Al-Al键的距离,所以氢从金属中解析速率比从离子共价氢化物中快得多[28]。因此,金属铝核可作为更容易脱氢的通道,使出现在氢化物-金属边界处的氢在金属中扩散到氢化物/气相边界,并很快地解析成气体,从而非金属氢化物相的体积减小,金属相的体积增大,完成氢气的释放。

(a)Restraining (b)Fracture (c)Release
Nakagawa等[31]通过原位电子显微镜(TEM)观察纳米尺度的α-AlH3和γ-AlH3的脱氢过程。图7为样品热过程的TEM和EDS图,发现两者初始状态都有约5 nm厚的Al2O3的膜。α-AlH3的初始形状为立方体,γ-AlH3的初始形状为棒状。加热5 min时(图7(b)),在α-AlH3的单晶内观察到纳米尺度(约1 nm)的Al颗粒,说明α-AlH3脱氢发生在颗粒的表面上;当加热30 min时(图7(c)),只有Al存在,且Al颗粒通过积聚生长为大小为50~100 nm的大颗粒。这些结果表明α-AlH3在脱氢过程中存在Al颗粒的沉淀和生长。而γ-AlH3分解过程与α-AlH3十分相似,且最终分解为10~100 nm的Al颗粒。
Ismai等[23]发现AlH3在氩气气氛中的分解最先在外表面和存在的孔隙和裂缝中发生并释放氢气,随着晶体颗粒尺寸变小,晶体的孔隙度逐渐增加。且可用固态转化动力学中的成核和生长机理来解释AlH3在氩气中的热分解更为合理。图8为AlH3在100 ℃下热分解过程中成核和生长的速率对比:由于生长速率远高于成核速率,所以成核(表面)反应是控制AlH3整体分解的速率决定步骤;这表明如果成核位置在颗粒外表面上,成核速率将会降低,AlH3分解速率将会减慢。所以,AlH3的热分解过程分为样品外表面较慢的成核反应和铝核向颗粒中心生长的反应。且在整个分解过程中成核反应速率占据主导地位,成核反应过程的动力学可由Avrami型(KJMA)方程控制。

(a)α-AlH3,Original (b)α-AlH3,5 min (150 ℃) (c)α-AlH3,30 min (150 ℃)

(d)γ-AlH3,original (e)γ-AlH3,5 min (150 ℃) (f)γ-AlH3,30 min (150 ℃)
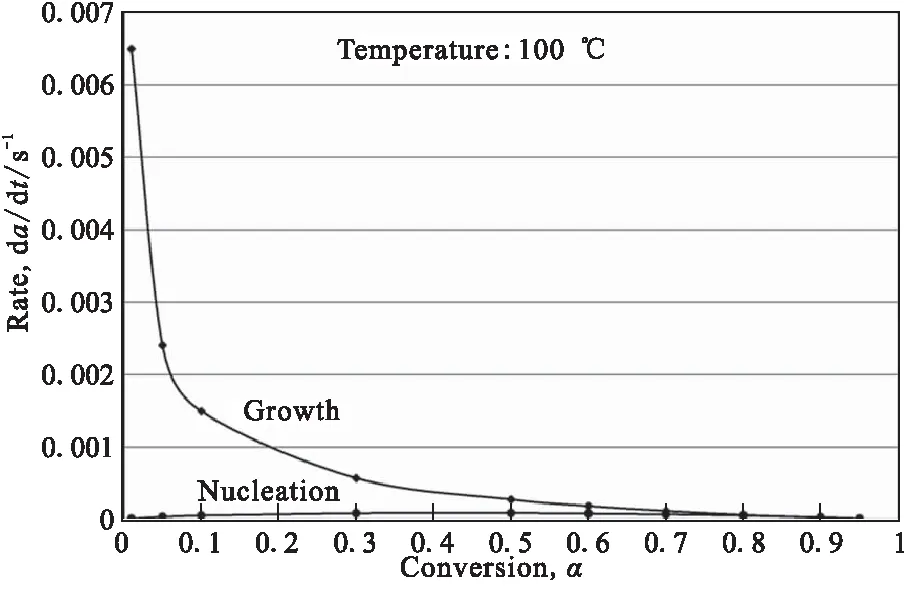
图8 AlH3热分解过程成核和生长速率对比(100 ℃)[23]
综上所述,AlH3只有在表面氧化层破裂后才会发生氢气的解析和金属Al相的生长,分解曲线为典型的“S”型曲线,可分为诱导阶段、加速阶段及衰退阶段,且AlH3不同多晶物在不同的温度下分解路径不同;AlH3的热分解过程分为2个步骤:步骤1是在外表面形成铝核较慢的成核反应,且是整个分解过程中反应速率的决定步骤,反应动力学由Avrami型(KJMA)方程控制;第2个步骤是铝核形成的铝层向颗粒中心的生长过程。
2 AlH3释氢特性影响因素
AlH3热分解释氢过程是一个复杂的过程,很多因素都将对其释氢特性产生影响,基于许多学者的研究结果,从AlH3自身理化特征及外界环境条件对AlH3热分解释氢的影响作用进行综述,明确AlH3释氢特性的影响因素。
2.1 Al2O3厚度的影响
Kato等[28]指出氧化层的存在阻碍了氢气的解析,并明确表明H2从AlH3表面解析需要氧化层的破裂,且解析速率由样品表面的氧化层厚度决定。氢气解析作用产生的多孔Al结构为氢气从金属氢化物边界扩散到外界提供较短的扩散路径,加速分解。Wang等[32]研究了Al2O3表面层的氢输送速率,发现氢输送速率随氧化物厚度(1~3 nm)的增加迅速降低。更加佐证了氧化膜的存在会抑制氢气的解析。Thampan等[33]通过AlH3形成Al2O3氧化层来实现稳定化,并通过本征XPS和原位TEM观察到氧化层阻止H2的释放,造成AlH3不完全分解。该现象可通过H2解析和Al氧化的竞争机制来解释,当H2解析率低时,微量的O2将与暴露的Al核位点反应并形成封闭的氧化层,从而阻止H2的解析,并且氧化层一旦在低温下形成,即使随后暴露在较高温度下,该氧化层也不会被破坏来释放H2。这一解释与Kato等[28]的研究相一致,说明氧化层的存在阻碍氢气的释放。
Nakagawa等[31]研究了表面氧化膜对AlH3脱氢动力学的影响,通过将颗粒暴露于空气中来改变Al2O3的厚度。图9显示了AlH3颗粒表面氧化层的TEM图及图10(a)显示了氧化层厚度与暴露在空气中时间的关系,发现暴露时间越长,氧化层的厚度越厚,表明Al2O3厚度的生长通过扩散控制;图10(b)表示随着暴露时间的增加,脱氢的峰值温度几乎保持稳定在150 ℃,表明氢从Al2O3膜中的扩散不是速率限制步骤。图10(b)下方显示研磨后AlH3的脱氢峰值温度约135 ℃,远低于未进行研磨时的150 ℃,说明研磨后表面无氧化层将增强脱氢动力学,这些结果表明,Al2O3膜的存在抑制了脱氢动力学。

(a)0 d (b)1 d (c)7 d
2.2 粒径、晶型的影响
粒径的大小对AlH3的释氢特性也具有显著影响。Tarasov等[20]通过NMR法在380 K恒温条件下研究了不同粒径AlH3的热分解特性,热分解曲线如图11所示。发现晶粒尺寸的增加,增加了诱导期的长度,并降低金属相成核速率,粒径大于150 μm的AlH3,完全分解将近350 min;而粒径小于50 μm时,完全分解释氢仅需90 min。粒径越小,分解越快完成。文献[34]报道Dow化学公司合成的粒径为50 μm的AlH3颗粒,在210 ℃左右开始分解,但新合成的小颗粒AlH3,170 ℃就开始分解。Sandock等[29]将原始粒径为100 μm的AlH3通过机械球磨法分别得到1、0.3 μm的样品并研究其放氢性能,发现100、1、0.3 μm的样品对应的起始释氢温度分别为150、125、100℃。可见,粒径减小有效地降低了起始放氢温度,显著提高了放氢性能。
综上所述,晶型排列方式不同,热分解特性也不同。Humphries等[8]对α-,α′-和γ-AlH3的样品进行热力学研究,得到AlH3多晶物的稳定性顺序为β<γ<α,<α。
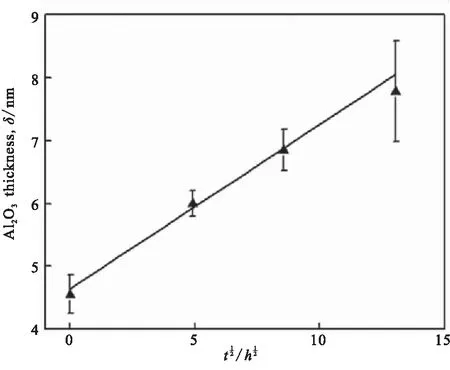
(a)Al2O3 thickness
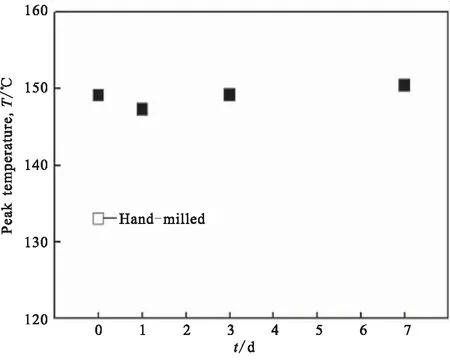
(b)Peak temperature
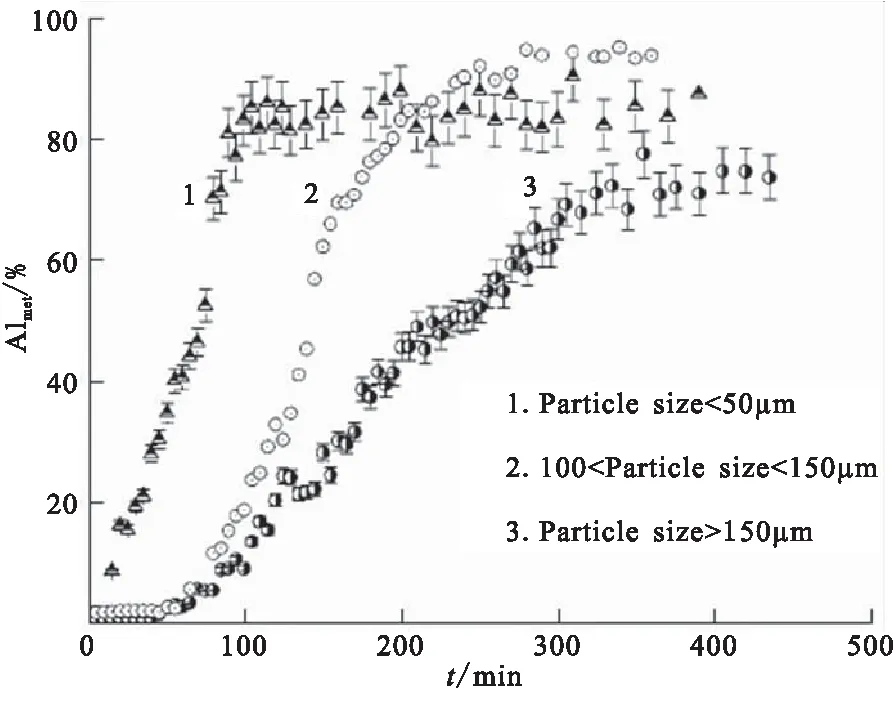
图11 (AlH3)n在380 K恒温下的热分解曲线[20]
2.3 加热速率的影响
Gabis等[29]运用非等温法研究加热速率对α-AlH3热分解过程的影响,图12为分别以0.01、0.02、0.05、0.1、0.2 K/s的加热速率升温到170 ℃的热分解曲线,发现加热速率越小,起始释氢温度越低,终止温度也越低。Ismail等[23]也在氩气气氛中对AlH3分别以0.49、0.98、2.0、4.9、9.9、20.2 ℃/ min的加热速率研究热分解反应,其TGA结果如图13所示。在20.2 ℃/ min时,分解开始于180 ℃,在215 ℃分解完成,最终减重为9.9%;主要的趋势是随着加热速率的降低,最终的失重变小。因为AlH3以较低的加热速率分解时,分解不彻底,一部分氢滞留在颗粒内部,导致失重减少。
2.4 热分解气氛的影响
由于AlH3的分解受很多因素的影响,不同的工况下其分解特性不同。Milekhin等[35]通过热重分析TG和差示扫描量热法DSC分别在氮气、氩气的气氛中加热AlH3,研究其化学反应及物理转化。确定了AlH3样品在氮气气氛的分解热和释氢量,分别为(318±25) J/g和质量分数9.32%±0.24%。
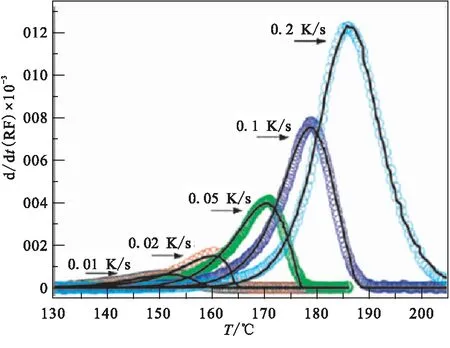
图12 不同加热速率下的热分解曲线[29]
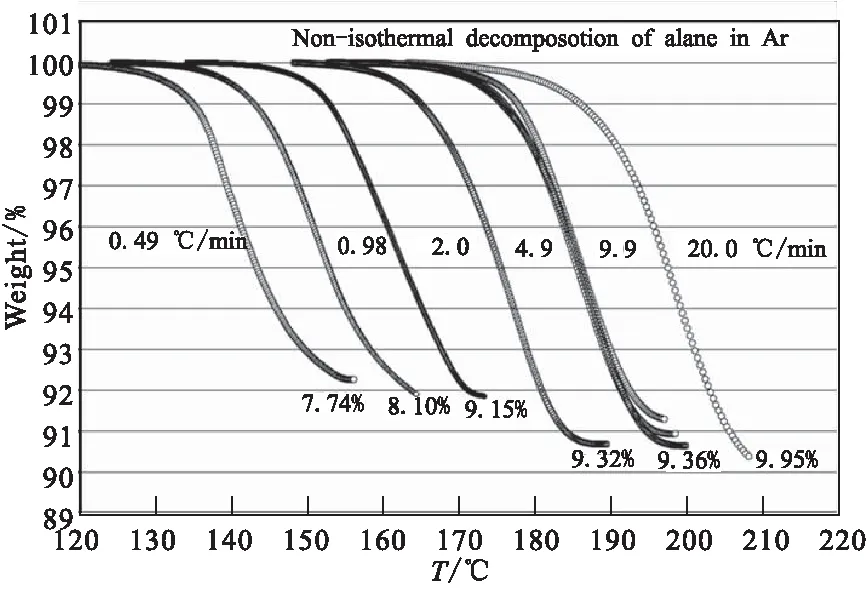
图13 在氩气气氛中不同加热速率下的热分解曲线[23]
图14分别为AlH3在氮气、氩气气氛中TG-DSC曲线图,均在150~195 ℃附近发生失重,对应于AlH3分解释氢反应:2AlH3→2Al+3H2。释氢结束后,TG曲线有略微的增重,一方面是在氮气氩气吸附在释放氢气后剩余的残余物(铝)颗粒中的孔隙和裂缝结构中;另一方面,氮气气氛中是由于温度继续升高进而发生了生成氮化铝的反应:Al+1/2N2→AlN。在DSC曲线存在一个放热峰,且放热几乎与沉淀物质量的增加同时发生,认为是由于吸附过程以及在从AlH3中释放氢后,铝从完全或部分的非晶状态中结晶出来引起的[19]。
(a)Nitrogen atmosphere
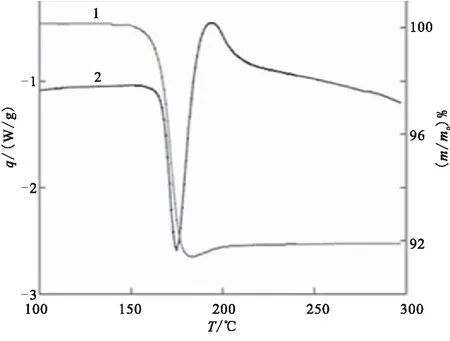
(b)Argon atmosphere
2.5 球磨与掺杂的影响
氧化层的存在抑制了AlH3的脱氢动力学,因此可通过研磨和掺杂的方法来改变脱氢动力学。刘海镇等[13]通过球磨法研究γ-AlH3放氢性能发现,球磨10 h后,完全放氢需82 min,远低于无球磨的280 min;通过球磨还可改变γ-AlH3的分解机制,γ-AlH3在放氢前先发生向α-AlH3的相变,这一相变转变使得AlH3的晶格活化,从而促进放氢反应的进行。Dulya等[36]通过热分析,SEM和X射线衍射法研究了AlH3添加LiH、MgH2、TiH2、VHx、LiNH2并机械处理后的组合物对分解温度的影响。结果表明,在氩气气氛中的AlH3通过球磨可降低氢化物的分解温度,而且球磨还使AlH3部分非晶化并增强其化学反应特性;LiH、MgH2、TiH2、LiNH2的添加降低了AlH3的热稳定性,将LiH与AlH3以1∶5的比例混合,起始分解温度降至112 ℃。
还有研究表明,加入如碱金属和过渡金属的添加剂可以促进H2的解析[37-38]。加入Ti可使活化能至少降低50%,当在AlH3合成期间将催化剂加入溶液中时,过渡金属催化剂(如Ti)对分解动力学的影响甚至更显著[16]。图15显示了Ti催化的α-AlH3和未催化的α-AlH3在60~192 ℃温度下的等温分解曲线。结果表明,热分解存在两个动力学增强阶段,一是分解开始时诱导期的缩短(在较高温度下明显);二是H2释放速率的增加(在较低温度下明显)。这些结果表明,Ti在α-AlH3中均匀分布时具有显著改善脱氢动力学的作用。
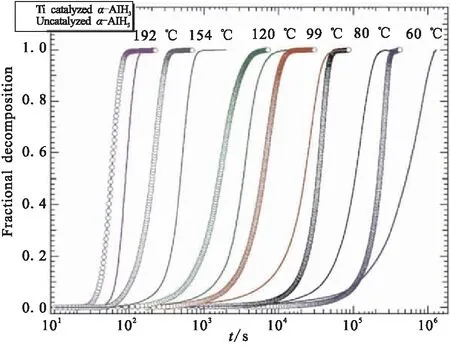
图15 α-AlH3进行Ti催化和未催化的等温分解曲线[16]
综上所述,AlH3的热分解特性受到众多因素的影响:表面Al2O3膜的存在抑制脱氢动力学;颗粒尺寸粒径越小,分解释氢速率越快;AlH3多晶物的稳定性顺序为β<γ<α′<α;加热速率下降,起始和最终的分解温度降低,失重减少;反应气氛影响热分解释氢的速率及释氢量;球磨与掺杂也会影响其脱氢性能。
3 AlH3稳定化改性方法
由于AlH3具有强的还原性,其稳定性较差,存在缓慢分解的现象,不能直接应用到固体推进剂中,所以使用前必须进行稳定化处理。近年来,由于新的制备方法且可以减缓AlH3分解速率及延长其保质期的新的稳定剂之后,更多学者对AlH3热稳定性进行了深入研究,特别是在长期储存期间热稳定性和应用到固体推进剂等方面,对AlH3的稳定化改性研究至关重要。下面介绍国内外常用的方法。
3.1 表面钝化法
Nakagawa等[31]通过TEM研究表面氧化膜对AlH3脱氢动力学的作用,发现Al2O3膜的存在抑制了脱氢动力学,故可以用生成氧化层的方法实现稳定化。Graetz等[16]对α-AlH3进行释氢的研究,发现α-AlH3在室温常压的惰性气氛中很稳定,长期存放期间只有很少量氢损失,因为α-AlH3晶体表面的Al2O3层阻碍了其进一步分解。刘明星等[11,39]运用稀酸对α-AlH3进行稳定化处理,分解温度提高了14 ℃,且放置5 d的情况下仅分解0.06%。因为稀酸性溶液(1%~25%的盐酸、硼酸、磷酸、氢氟酸等)不仅可以去除α-AlH3晶体中的杂质(LiCl、LiAlH4、LiBH4、NaBH4等)和其他不稳定的晶型,还可以在α-AlH3晶体表面形成一层Al(OH)3-Al2O3的保护层起到隔离作用,使产品热稳定性增强。
3.2 表面包覆法
可以选择合适的稳定剂对AlH3表面进行包覆,来提高其稳定性。可用具有至少包含一个苯基或稠环结构并含有不饱和键的有机物来包覆AlH3,通过吸附气态或液态的无机物质(如氮氧化物、N2F4、氧、二氧化碳、挥发性无机氯化物、挥发性无机硫化物等)对AlH3进行包覆,以增加其稳定性[40]。研究表明,分解放气主要受到了表面电子和Al+电子空穴的催化作用,故可用电子给体或电子受体通过表面络合作用来改善其稳定性。例如,金精三羧酸三铵、8-羧基奎宁和邻苯二酚等,稳定剂的用量控制在0.1%~10%之间[39]。
3.3 其他稳定化法
AlH3的合成方法众多,且不同的方法得到的产物性质略有不同,可在合成过程中添加适当的其他原子(Mg、Ca等),通过各种金属离子与氢负离子的协同作用来提高其稳定性[39]。还可以添加一些金属离子化合物(如Hg2+、R3Si+等阳离子)来提高其稳定性[40]。
综上所述,为了促进AlH3在推进剂中的应用,需要合成水解稳定性好、热稳定性好及感度低的产品。可用表面钝化法、表面包覆法及添加金属离子化合物的方法来提升产品的稳定性。
4 结束语
AlH3作为一种新型的含能材料,在固体或混合火箭推进剂、储氢材料、燃料电池氢源、聚合催化剂等一系列领域有着广阔的应用前景,成为国内外研究的热点。但也面临着进一步探索释氢反应机理、明确释氢影响因素和调控机制、寻找高效的稳定化方法等一些亟待解决的问题。未来为了促进AlH3更加广泛的应用还需要做更多工作:寻找更加高效的稳定化处理方法来满足实际应用的需要;深入研究AlH3释氢动力学机理,进一步提高其放氢性能;探索AlH3释氢影响因素,提出更加有效的调控机制;寻找实现AlH3循环利用的有效途径,实现AlH3的长远发展。
