益生菌和不同水平壳聚糖对黄金鲫非特异性免疫力及抗病力的影响
2020-06-29于景艳曾祥茜朱国霞白东清
于景艳,王 洋#,曾祥茜,吴 旋,杨 广,朱国霞,白东清
(1.天津农学院水产学院 天津市水产生态及养殖重点实验室,天津西青 300384;2.天津市水产研究所 天津市海洋牧场技术工程中心,天津滨海 300457;3.天津市静海区畜牧水产业发展服务中心,天津静海 301600)
黄金鲫是2008 年审定通过的淡水鱼类新品种,该鱼是以散鳞镜鲤做母本,以红鲫鱼作为父本进行杂交获得的三倍体品种。体型似鲫鱼,体色金黄,有一对触须。生长快、抗应激能力强、推广面积广、适合多种养殖模式。研究发现适宜的益生菌可以有效提高彭泽鲫 (齐欣等,2007;尹军霞等,2007)、重口裂腹鱼(何敏等,2008)、西伯利亚鲟(高欣等,2009)、凡纳滨对虾(胡毅等,2008)等水产动物的生长、存活、消化和肠道健康。壳聚糖作为唯一天然的碱性多糖,其分布广,无毒害,能降低大鼠和小鼠的血糖和血脂(魏涛等,2000),吸附Cd2+和 Pb2+(程珊珊等,2011),有效抑制金黄色葡萄球菌(叶磊等,2004),提高暗纹东方鲀和异育银鲫的免疫能力及生长性能(陈勇,2010;华雪铭等,2007、2006)。鉴于此,本文以淡水经济鱼类黄金鲫为研究对象,在基础日粮中添加等量枯草芽孢杆菌和不同水平壳聚糖,探究益生菌和壳聚糖对黄金鲫生长性能、消化酶活性、部分生化指标及抗病力等方面的综合影响,并选出壳聚糖的适宜添加量,为开发黄金鲫免疫增强剂提供数据。
1 材料与方法
1.1 试验材料
1.1.1 试验鱼及养殖管理 试验所需的黄金鲫鱼种采购自天津汉沽高庄渔场,初始体重 (58.94±4.29)g,初始体长(14±0.10)cm,健康无病无伤,随机分为6 个组,每组4 个重复,每个重复20 尾鱼,养殖容器为(80 cm×60 cm×65 cm) 的 PVC 白色周转箱,饲养于实验室水族缸中。放养前先用10 mg/L的戊二醛溶液对24 个水族缸浸泡消毒30 min,后用清水涮洗水族缸2 次。先用基础饲料养殖7 d,待鱼摄食正常后正式开始试验。每天定时投喂3次 (7:30、13:30、19:30),投饵率为 3%(根据水质、鱼的摄食情况做相应调整,保证鱼在30 min内吃完为宜,若30 min 没有吃完,下顿要减少投喂量)。养殖期间保证24 h 不间断充氧,控制水温在25~28 ℃,每天早上吸污一次,同时换水1/2,换入曝气2 d 的水。
1.1.2 养殖饲料 饲喂黄金鲫的基础饲料购自海大集团成品膨化料,粗蛋白质含量为33%。益生菌购自广州利洋水产科技股份有限公司,枯草芽孢杆菌≥1.0×109cfu/g,水份≤10%,杂菌数≤1.0×107cfu/g。壳聚糖(纯度≥91.3%)外观颜色为浅黄色粉剂,脱乙酰度95%,水分7%,采购自济南海德贝海洋生物工程有限公司。将益生菌和壳聚糖事先混合均匀,喷涂在饲料上,在阴凉干燥处晾干备用。本试验6 个组分别投喂基础饲料(C1组)、益生菌(C2 组)、益生菌+0.25%壳聚糖(T1组)、益生菌+0.5 壳聚糖 (T2 组)、 益生菌+0.75%壳聚糖(T3 组)和益生菌+1.0%壳聚糖饲料(T4 组)。
1.2 试验方法
1.2.1 样品处理 养殖30 d 后,禁食24 h 取样,每组取22 尾,使用麻醉剂MS-222 进行麻醉,测定每组每尾鱼体重、体长、体高和体宽,然后擦拭黄金鲫体表后,使用一次性无菌注射器进行尾静脉取血,4 ℃条件下静置 1 h,并以 4000 r/min 的转速离心15 min,制得血清样品,于-80 ℃超低温冰箱保存待测。
经尾静脉取血后的黄金鲫在冰浴条件下进行解剖,分别取头肾、中肾、肝胰脏、脾脏、肠道、鳃和脑组织。剔除其组织上附着的脂肪、结缔组织及器官内容物,置于-80 ℃冰箱内保存。用冷冻离心机在 4 ℃、3500 r/min 离心 10 min,提取上清液,于4 ℃冰箱中冷藏保存。
1.2.2 血液和组织生化指标的测定 生化指标测定试剂盒均购自南京建成生物工程研究所,参照说明书进行测定。
1.2.3 抗病力测定 养殖试验后,用嗜水气单胞菌进行攻毒,按每尾鱼腹腔注射菌液350 μL 计量(总菌数 7×107)。每个平行 5 尾鱼,每组 20 尾鱼。试验期为10 d,计算各组鱼的累计死亡率和免疫保护率。
1.3 数据统计与分析 采用SPSS 17.0 版软件进行数据统计和分析,试验数据用 “平均值±标准差”表示,显著性水平用P <0.05 表示,先对数据作单因子方差分析,如果处理期间有显著差异,则进行 Duncan’s 多重比较。
2 结果与分析
2.1 饲料中添加益生菌和不同水平壳聚糖对黄金鲫非特异性免疫力的影响
2.1.1 饲料中添加益生菌和不同水平壳聚糖对黄金鲫体内SOD 活性的影响 养殖30 d 后,各组黄金鲫体内不同组织中SOD 活性大小顺序为:肝胰脏>血清>脾脏>脑>头肾>中肾>鳃(表1)。从表1 中看出,与C1组相比,单独添加益生菌对黄金鲫体内SOD 活性影响很小,C2 组血清、 肝胰脏、脾脏、头肾、中肾、脑和鳃中SOD 酶活性仅比C1组提高 0.56%、0.66%、1.19%、14.76%、4.60%、1.28%和 1.01%(P>0.05)。随着壳聚糖添加水平的增加,体内SOD 活性均呈先上升后下降的趋势。T1~T3 组血清中SOD 活性分别提高2.92%~3.50%、6.58%~7.17%和 7.07%~7.66%,显著高于 C1 和 C2 组(P < 0.05),最高值出现在 T3 组,且与T2 组之间差别不大。T2 组肝胰脏酶活性最高,除与T3 组差别不大外,显著高于其余各组(P< 0.05);与 C1、C2、T1 和 T4 相比,T2 组酶活性分别提高7.07%、6.37%、5.80%和 6.24%。T3 组脾脏酶活性最高,显著高于 C1、C2 和 T1组,SOD 活性分别提高 25.52%、24.04%和 19.51%(P < 0.05)。头肾中酶活性最高值出现在T3 组,显著高于C1和C2 组,SOD 活性分别提高46.05%和 27.27%;T1~T4 组头肾中 SOD 活性,较 C1组分别提高27.46%、31.95%、46.05%和 28.05%(P < 0.05)。中肾中SOD 活性最高值出现在T3 组,显著高于其余各组 20.06%~39.48%(P < 0.05)。T2 组脑中SOD 活性显著高于其余各组30.54%~54.53%(P< 0.05)。T2、T3 组鳃中 SOD 活性显著高于其余各组(P < 0.05),与 C1组相比,T1~T4 组鳃中 SOD活性分别提高7.90%、13.94%、25.00%和6.61%,且其最高值出现在T3 组。可见饲料中添加0.5%~0.75%壳聚糖可有效提高黄金鲫体内SOD 活性。

表1 不同水平的壳聚糖对黄金鲫体内SOD 活性的影响
2.1.2 饲料中添加益生菌和不同水平壳聚糖对黄金鲫体内CAT 活性的影响 养殖30 d 后,各组体内不同组织中CAT 活性顺序为:肝胰脏>脑>血清>脾脏>头肾>鳃>中肾(表2)。与 C1组相比,C2组对黄金鲫体内CAT 活性影响很小,体内各部位CAT 活性约比 C1组增长 0.54%~12.29%。随着壳聚糖水平增加,体内CAT 活性均呈现先升高后降低的趋势。T2~T4 组血清中CAT 活性较C1、C2 和 T1组提高了 23.02%~26.31%、23.74%~28.24%和 9.08%~13.05%,效果显著(P < 0.05),其中以T3 组酶活性最高,且与T2 组差别不大。T2 组肝胰脏和脾脏中CAT 活性显著高于其余各组(P < 0.05),肝胰脏内 CAT 酶活性约是其余各组的 1.09~1.15 倍,脾脏中 CAT 酶活性约是其余各组的 1.18~1.43 倍。T3 和 T4 组头肾中 CAT活性显著高于其余各组(P < 0.05),T3 组和 T4 组CAT 活性分别提高32.44%~47.96%和27.07%~41.96%,CAT 活性最高值出现在T3 组。中肾中CAT 酶活性高值出现在T3 组,显著高于 C1 和C2 组(P < 0.05),分别提高 36.67%和 23.62%,而与T2、T4 组差异较小,分别提高4.24%和2.50%。T2 组脑中 CAT 活性最大,是 C1 和 C2 组的 1.27倍和 1.22 倍(P < 0.05),T3 组酶活性也显著高于C1组(P < 0.05,为 C1组的 1.16 倍)。T2 组鳃组织中CAT 活性最大,约是其余各组的1.15~1.28 倍(P < 0.05)。可见,饲料中添加 0.5%~0.75%壳聚糖能够显著提高黄金鲫体内的CAT 活性。
2.1.3 饲料中添加益生菌和不同水平壳聚糖对黄金鲫体内GSH 含量的影响 从表3 可以看出,养殖30 d 后,黄金鲫体内不同组织中GSH 含量顺序依次为: 肝胰脏>脑>血清>脾脏>中肾>头肾>鳃。与C1组相比,C2 组除肝胰脏中GSH 含量显著提高外,其余各组织中GSH 含量变化不大(P>0.05)。血清中GSH 含量随着壳聚糖水平逐渐升高,在T4 组达到最大值,较其余各组提高19.84%~43.64%,效果显著 (P < 0.05)。其余各组织中GSH 含量均随着壳聚糖添加水平的增加呈现先增加后降低的变化趋势,其中T2~T4 组肝胰脏中 GSH 含量是 C1组的 1.56 倍、1.46 倍和 1.38 倍(P < 0.05),其中以 T2 组含量最高,较 C1、C2 和T1组分别提高56.19%、18.61%和16.08%,效果显著(P < 0.05)。脾脏中 GSH 含量最高值出现在 T2组,与 C1、C2、T1、T3 和 T4 组相比,分别提高了52.91% 、49.70% 、45.45% (P < 0.05)、8.46% 和11.92%(P>0.05)。头肾、中肾、脑和鳃中 GSH 最大值出现在 T3 组,较 C1、C2 和 T1组分别提高32.02%~49.42% 、59.32%~75.00% 、38.51%~60.47%和 52.96%~60.06%(P < 0.05)。两个高水平壳聚糖组头肾中GSH 活性显著高于其余各组(P < 0.05),T3 组约为低水平和无添加壳聚糖组的1.26~1.49 倍,T4 组约为低水平和无添加壳聚糖组的 1.22~1.45 倍。T2~T4 组中肾中 GSH 含量显著高于其余各组(P < 0.05)。T2~T4 组脑中GSH 活性显著高于 C1组(P < 0.05),分别为 C1组的 1.34 倍、1.60 倍和 1.27 倍。T3 组鳃中 GSH活性分别是 C1 和 C2 组的 1.6 倍和 1.59 倍 (P <0.05)。可见,饲料中添加 0.5%~0.75%壳聚糖能有效提高黄金鲫体内GSH 含量。
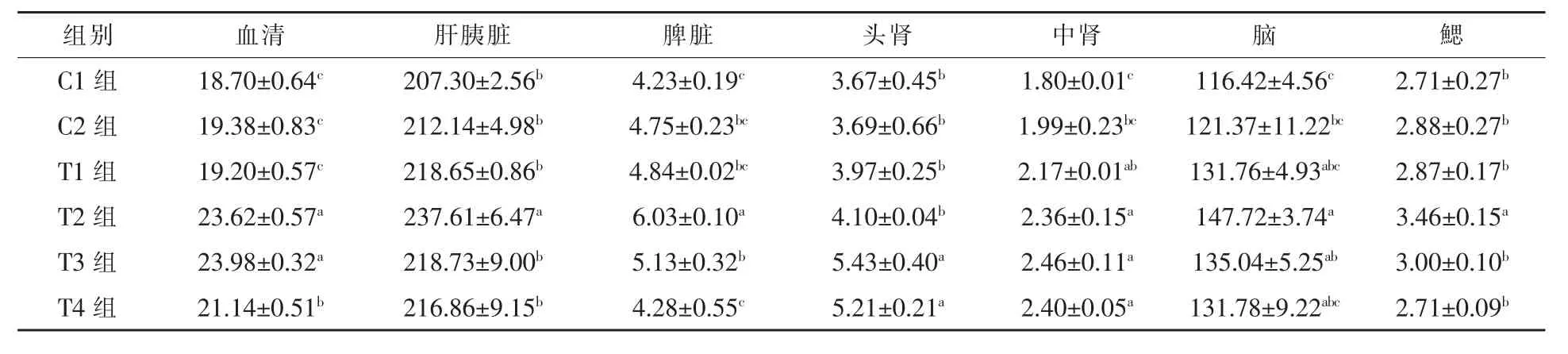
表2 不同水平的壳聚糖对黄金鲫体内CAT 活性的影响
2.1.4 饲料中添加益生菌和不同水平壳聚糖对黄金鲫体内GSH-Px 活性的影响 从表4 中可以看出,养殖30 d 后,各组黄金鲫体内的GSH-Px 活性大小顺序依次为:肝胰脏>血清>脾脏>头肾>中肾>鳃>脑。与 C1组相比,C2 组中只有头肾 GSHPx 活性显著升高(P < 0.05),其余组织变化不明显。壳聚糖对黄金鲫体内GSH-Px 活性的影响具有剂量差异性和组织差异性。体内GSH-Px 活性均随着壳聚糖水平增加呈现先增后降的趋势。血清中 GSH-Px 活性以 T3 组活性最高,较 C1、C2和 T1组分别提高 8.24%、7.60%和 6.98%(P <0.05),T2 组较 C1组提高了 6.47%,效果显著(P <0.05)。壳聚糖添加组肝胰脏中酶活性均显著高于C1组(P < 0.05),提高 5.09%~12.12%,且 T2~T4 组中酶活性还显著高于 C2 组(P < 0.05),分别提高 5.70%、8.45%和 6.84%。脾脏中GSH-Px 活性最高值出现在 T2 组,为 88.21,较 C1、C2 和 T1组 分 别 提 高 29.84% 、28.25% 和 25.35% (P <0.05)。与C1组相比,头肾中GSH-Px 酶活性均显著提高 23.47%~40.12%(P < 0.05)。T2 组和T3组中肾中酶活性显著高于无添加壳聚糖组 (P <0.05),T2 组 较 C1、C2 组 分 别 提 高 26.46% 和19.45%,T3 组较 C1、C2 组分别提高 24.83%和17.91%,其中以T2 组酶活性最高。添加壳聚糖组和 C2 组脑中酶活性均显著高于 C1组 (P <0.05),提高约 2.26%~31.82%,且 T2 组脑中GSH-Px 活性分别是 C1 和 C2 组的 1.32 倍和1.29 倍(P < 0.05);T3 组鳃中 GSH-Px 活性最高,为 10.49,分别是 C1、C2 和 T1组的 1.50 倍、1.41倍和 1.30 倍,效果显著 (P < 0.05)。上述可知,0.5%~0.75%壳聚糖能很好的提高黄金鲫体内GSH-Px 的活性。
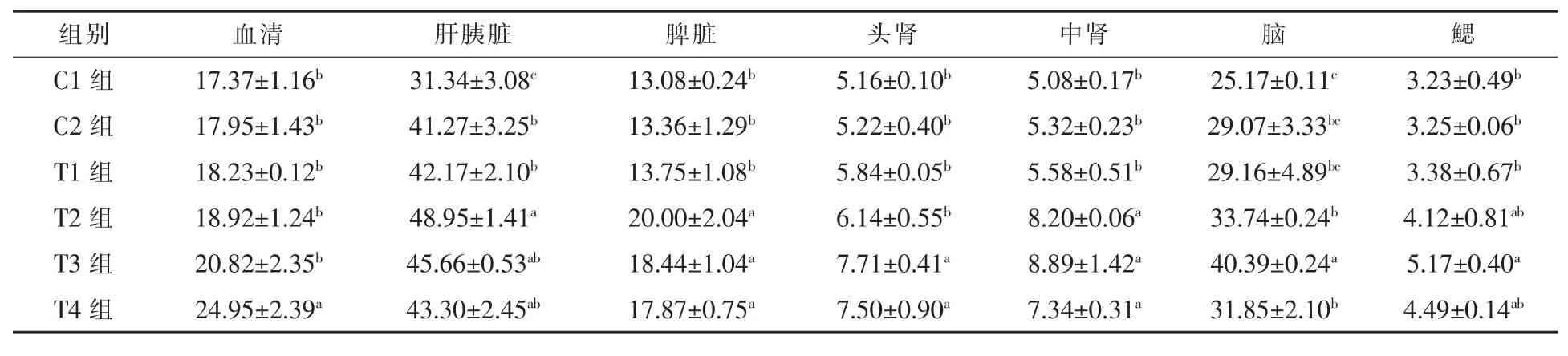
表3 不同水平的壳聚糖对黄金鲫体内GSH 含量的影响

表4 不同水平的壳聚糖对黄金鲫体内GSH-Px 活性的影响
2.1.5 饲料中添加益生菌和不同水平壳聚糖对黄金鲫体内MDA 含量的影响 从表5 可以看出,养殖30 d 后,与C1组相比,C2 组只有脑中MDA含量显著降低(P < 0.05),其他组织影响不大(P>0.05)。黄金鲫体内MDA 含量基本上随着壳聚糖水平的增加呈现降低的趋势。T2~T4 组血清中MDA 含量较 C1 和 C2 组降低 16.54%~31.50%和 13.12%~28.69%(P < 0.05),其中以 T4 组最低。T2~T4 组肝胰脏中 MDA 含量较 C1组降低33.68%~53.80%(P < 0.05)。脾脏中 MDA 最小值出现在T4 组,比 C1 和 C2 组降低了 26%和23%(P <0.05)。中高水平壳聚糖添加组在头肾中的MDA 含量显著低于无添加组和低水平添加组(P <0.05),且在 T4 组达到最小值。中肾中 MDA 最小值出现在 T4 组,比 C1 和 C2 组降低了 25%和24%(P < 0.05)。C2 组和添加壳聚糖组脑中 MDA含量均显著降低,降低幅度为21.13%~58.15%,在 T4 组达到最小值(P < 0.05)。T2~T4 组鳃中MDA 含量显著低于C1 和C2 组,其中最小组出现在 T3 组 (P < 0.05)。由此可见,饲料中添加0.75%~1.0%壳聚糖对降低黄金鲫体内MDA 含量有显著效果。
2.1.6 饲料中添加益生菌和不同水平壳聚糖对黄金鲫体内NO 含量的影响 由表6 可知,养殖30 d后,单独添加益生菌对黄金鲫体内的NO 含量影响很小(P>0.05)。血清、肝胰脏、脾脏和脑中 NO含量呈先上升后下降的趋势,并于T3 组达到最大值,较 C1组分别提高了 72.96%、52.17%、105.26%、163.64%,效果显著(P < 0.05);在头肾、中肾和鳃中呈逐渐上升趋势,均于T4 组达到最大值(P < 0.05),其中 T4 组在头肾、中肾和鳃中分别提高20.00%~140.00%、16.67%~133.33%和7.69%~27.27%。由此可见,饲料中添加0.75%~1.0%壳聚糖可有效提高黄金鲫体内NO 含量。
2.1.7 饲料中添加益生菌和不同水平壳聚糖对黄金鲫血清和肝胰脏中GOT 和GPT 活性的影响由表7 可知,养殖30 d 后,随着壳聚糖水平的增加,黄金鲫血清和肝胰脏中GOT 活性呈现下降趋势,且在 T4 组达到最小值(P < 0.05)。肝胰脏中GOT 活性下降幅度最大,为88.97%,高于血清(最大下降速度为47.93%)。GOT 活性在血清中的最低值出现在T4 组,较无添加壳聚糖组下降幅度大于 47%(P < 0.05),而肝胰脏中 GOT 活性低值出现在T3 和T4 组,较无添加组分别降低74.12%~76.41%和 87.89%~88.97%(P < 0.05)。

表5 不同水平的壳聚糖对黄金鲫体内MDA 含量的影响
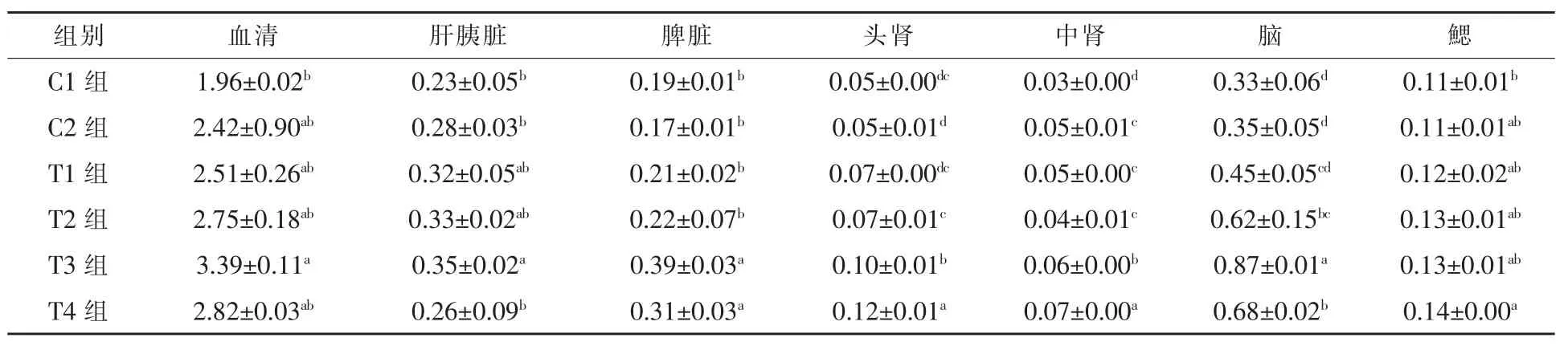
表6 不同水平的壳聚糖对黄金鲫体内NO 含量的影响
表8 显示,黄金鲫体内GPT 活性的变化规律同GOT。T4 组血清中GPT 活性较其余各组下降幅度均在 30%以上(P < 0.05);T3、T4 组肝胰脏中GPT 活性低于 C1、C2 和 T1组的 1/2 (P < 0.05),且最小值均出现在T4 组。

表7 不同水平的壳聚糖对黄金鲫血清和肝胰脏中GOT 活性的影响
2.2 饲料中添加益生菌和不同水平壳聚糖对黄金鲫抗病能力的影响 养殖30 d 后用嗜水气单胞菌进行急性攻毒试验发现,黄金鲫鳃盖、鳍、腹部和肛门均出现不同程度的出血症状,部分濒死鱼出现腹部严重肿胀,肛门发红、水肿,稍微用力挤压肛门即有黄色或红色的腹腔积水流出。解剖发现,病鱼鳃充血或出血,腹腔积水严重,肠道、肝胰脏发红充血,脾脏颜色发黑。攻毒5 d 后,只有T2 和T3 组累计死亡率降低,其他各组均为100%(表9)。T2 和 T3 组免疫保护率分别为 40%和60%,因此添加益生菌+0.75%壳聚糖(T3 组)对黄金鲫免疫保护率作用效果最佳。

表8 不同水平的壳聚糖对黄金鲫血清和肝胰脏中GPT 活性的影响
3 讨论
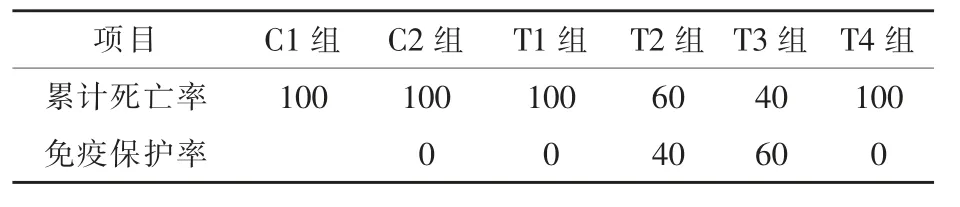
表9 不同水平的壳聚糖对黄金鲫抗病力的影响 %
3.1 壳聚糖对黄金鲫非特异性免疫力的影响Siwicki 等(1994)发现,投喂添加0.5%的壳聚糖饲料,虹鳟血清中的总抗体和总蛋白水平分别提高了 36.8%和 14.6%。Esteban 等(2001)在金头鲷饲料中添加25 g/kg 或50 g/kg 的甲壳素,可以明显提高补体活性。常青等(2006)研究证明,投喂添加0.5%壳聚糖的饲料,能明显提高花鲈补体、溶酶菌和吞噬活性。史春路(2008)研究发现,饲料中添加5 g/kg 壳聚糖能显著提高黄颡鱼血液补体C3的含量。王兰等(2009)研究发现,长江华溪蟹长期浸泡在壳聚糖中,其血清中的AKP 活力显著提高。童春等(2010)发现,饲料中添加 0.6%~0.8%壳聚糖能增强淡水白鲳免疫能力。曹振杰等(2010)研究表明,投喂不同水平的壳聚糖60 d,试验组罗非鱼生长性能和免疫能力都得到明显提高,其中0.5%壳聚糖组效果最显著(P <0.05)。张严伟等(2014)研究发现,饲料中添加50 mg/kg 的壳聚糖能显著提高福瑞鲤生长、 非特异性免疫指标和抗氧化能力。肖艳翼等(2017)得出,在饲料中添加2.5 g/kg 壳聚糖,能提高俄罗斯鲟幼鱼生长性能,增强其免疫能力。本试验结果表明,日粮中添加益生菌和不同水平壳聚糖,能显著提升黄金鲫血清及组织中抗氧化酶 (SOD、CAT、GSH-Px)活性和GSH 含量,降低黄金鲫血液及组织中MDA 含量。且添加0.75%壳聚糖(T3 组)能显著降低血清中和肝胰脏中GPT 含量,提高体内NO 含量。说明饲料中同时添加益生菌和不同水平壳聚糖能提高黄金鲫体内抗氧化能力和非特异性免疫能力。
3.2 壳聚糖对黄金鲫抗病能力的影响 叶磊等(2004) 发现,50、100、200 kD 分子量的壳聚糖均可以明显抑制金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌。且分子量越大,抑菌作用减少,相应最小抑菌浓度在 0.5 g/L 以上。闫大伟等 (2007)证实,饲料中添加0.5%~0.75%壳聚糖,可以明显提高草鱼对嗜水气单胞菌的抗感染能力。庒承纪等(1998)研究表明,在斑节对虾、罗氏沼虾苗饲料中加入 25×l0-6~100×l0-6壳聚糖,可抑制气单胞菌和弧菌繁殖,增强抗病能力,提高虾苗的成活率。孙琪等(2014)研究表明,使用25 mg/L 的壳聚糖浸泡被水霉感染的草鱼发现,壳聚糖具有促进伤口愈合,显著降低感染草鱼死亡率的作用(P <0.05)。曹振杰等(2010)得出,在接受过免疫的罗非鱼日常饲料中添加0.6%的壳聚糖,能显著提高其对嗜水气单胞菌的抵抗力。吴国忠等(2005)通过投喂不同分子量壳聚糖30 d 后,向南美白对虾体内注射弧菌和白斑病毒发现,低分子量壳聚糖能够提高南美白对虾的抗病能力。Cha 等(2008)用壳聚糖包被基础饲料投喂牙鲆(Paialichthys olivaceus)12 周发现,平均增长率比对照组提高约10%,髓过氧化酶(MPO)、中性粒细胞的呼吸爆发和皮肤黏液溶菌酶等活性均显著升高(P <0.05),累积死亡率为40%,远低于对照组的70%。在本试验中,投喂添加益生菌和壳聚糖的饲料30 d后,经腹腔注射嗜水气单胞菌7 d,0.5%~0.75%壳聚糖组死亡率明显低于对照组和益生菌组,免疫保护率也明显低于对照组。表明0.5%~0.75%的壳聚糖能明显提高黄金鲫的抗病力。至于最高水平和最低水平壳聚糖组死亡率高的原因还有待深入研究。
4 结论
饲料中添加益生菌对黄金鲫非特异性免疫力及抗病力影响不大,而同时添加益生菌和适宜水平壳聚糖可以有效提高黄金鲫体内抗氧化能力,降低肝损伤,有效提高黄金鲫的抗病力。综上,从免疫角度考虑,黄金鲫饲料中壳聚糖适宜添加水平为0.5%~0.75%。
