大豆GmVE2基因克隆及其在大豆籽粒维生素E动态积累中的表达分析
2020-06-29鲍玉月栗春霞崔智慧韩英鹏李文滨
王 伟,王 俊,鲍玉月,栗春霞,崔智慧,韩英鹏,李文滨
(东北农业大学 大豆研究所,大豆生物学教育部重点实验室,农业部东北大豆生物学与遗传育种重点实验室,黑龙江 哈尔滨 150030)
维生素E又称生育酚,是一种脂溶性维生素,主要存在于油料作物特别是大豆中,其可参与生物体内抗性胁迫、基因表达调控、信号转导等多种代谢途径。在植物体内,维生素E具有能够释放活性氢、捕获植物光合组织中自由基的能力[1],能够保护植物免受光抑制和光氧化胁迫[2]。维生素E除了具有氧化功能和对非生物逆境抗性作用外,还影响一些重要的生理过程包括种子发芽、光合同化产物的转运、植株生长、叶片衰老等[3]。另外,在动物饲料中添加也可以改善肉质,缓解动物应激反应,提高繁殖性能[4-5]。
维生素E主要有3种组分,包括α-生育酚、γ-生育酚和δ-生育酚等,大豆种子中γ-生育酚和δ-生育酚含量最多,占大豆总生育酚含量的95%左右,而活性最高的α-生育酚仅占4%[6-7]。刘焕成与罗健等[8-9]研究发现,28~34 ℃大豆籽粒维生素E含量差异主要体现在R6-R7时期积累量,该时期积累量决定大豆品种最终的维生素E含量。维生素E合成代谢途径中主要底物为莽草酸途径产生的尿黑酸(Homogentisic acid,HGA)、非甲羟戊酸途径产生的植基二磷酸(Phytyl diphosphate,PDP)和香叶酰香叶酰二磷酸(Geranylgeranyl diphosphate,GGDP),现有研究表明,通过调节底物可以调控维生素E的合成。其中,HGA的生成直接由对羟基丙酮酸双加氧酶(Hydroxy phenyl pyruvate dehydrogenase,HPPD)作用而来,在烟草中过量表达的HPPD基因(来自大麦)使转基因植物总生育酚含量提高了2倍[10],在蓝藻中过表达该基因使生育酚含量提高了5~7倍[11-12]。目前,调控维生素E合成代谢途径的研究主要集中在通过关键酶基因来控制维生素E合成,而对莽草酸途径和非甲羟戊酸途径调控维生素E却鲜见报道。
PDP作为生育酚合成的主要前体,80%由叶绿素的分解产物植醇经磷酸化反应生成,而GmVE2基因可通过参与叶绿体PSⅠ系统电子链传递,间接影响PDP这一底物的合成,进而调控维生素E合成[13]。本研究对候选基因GmVE2进行生物信息学分析预测,以高维生素E材料东农50为试材,克隆GmVE2基因CDS全长序列,结果发现,该基因表达量与生育期籽粒维生素E含量呈显著负相关(-0.951*),且维生素E含量在绿色组织中含量高于其他组织。本研究主要是对大豆基因GmVE2与维生素E含量的调控关系进行初步研究,分析GmVE2基因表达量与籽粒维生素E含量之间的相关关系,为高维生素E大豆新品种的培育提供理论依据。
1 材料和方法
1.1 试验材料
本研究选用高维生素E材料大豆品种东农50为试材,由东北农业大学大豆生物学教育部重点实验室提供。
1.2 试验方法
1.2.1GmVE2生物信息学分析GmVE2基因序列信息由Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html)获得,氨基酸理化性质用ExPASy-ProtParam在线软件(http://web.expasy.org/protparam/)进行预测;采用SignalP 4.1、TMHMM及NetPhos-3.1分别对信号肽、跨膜区和潜在磷酸化位点进行预测,利用SoPMA软件进行蛋白质二级结构预测,采用SWISS-MODEL在线软件(http://swissmodel.expasy.or1g/)预测蛋白质三级结构,同时利用Blast和MEGA 5.0软件对氨基酸进行同源性分析和构建进化树。
1.2.2 大豆各组织总RNA提取及反转录 将植物材料东农50种植在蛭石中,培养条件为水分充足,28 ℃光照16 h黑暗8 h交替,1 d取芽,14 d后于当天14:00取除大豆籽粒外的其他组织(R6期):根、茎、叶、子叶、芽,利用东洋纺RNA提取试剂提取大豆总RNA。
1.2.3 大豆GmVE2基因克隆与表达载体构建
1.2.3.1 引物设计及目的基因扩增 通过Phytozome v12.1数据库查找GmVE2基因的全长序列。GmVE2基因全长1 333 bp,CDS区全长504 bp,编码167个氨基酸。根据GmVE2基因的序列在Primer Premier 5.0数据库设计一对基因扩增引物:正向引物(F):5′-AGAACACGGGGGACTATGCTCTTTCACTTGCTTCTC-3′,反向引物 (R):5′-ATCCTCTGTTTCTAGTTATCTCTTCATAATGTCATCC-3′。产物长度534 bp。PCR扩增体系:Super-Fidelity高保真酶诺威赞公司提供,模板cDNA 1 μL,上下游引物各1 μL,Super-Fidelity 0.5 μL,5×Super-Fidelity Buffer 5 μL,dNTP 0.5 μL,ddH2O补至25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸20 s,共35个循环;最后72 ℃延伸10 min,4 ℃保存。一对荧光定量检测引物:定量引物(F):5′-TCCCTCCCATCAAACTCA-3′,定量引物(R):5′-AACCAGCATTCAGCAAGA-3′。产物长度178 bp。PCR扩增体系:定量试剂盒天根公司提供,2×Real Universal PreMix 10 μL,正反向定量引物各0.6 μL,cDNA模板1 μL,50×ROX Reference Dye 0.4 μL,RNase-free ddH2O定容至20 μL。PCR扩增程序:95 ℃ 预变性15 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;72 ℃延伸10 min,4 ℃保存。
1.2.3.2 目的基因片段回收 1%琼脂糖电泳检测PCR产物,利用全自动数码凝胶图像分析仪拍照记录后,具体根据OMEGA Gel Extraction Kit(D2500-01)凝胶回收试剂盒说明书回收目的条带,-20 ℃保存备用。
1.2.3.3 目的基因与植物表达载体连接、转化和验证 在pCAMBIA3300载体单酶切位点XbaⅠ将植物表达载体pCAMBIA3300酶切线性化。酶切反应体系为:XbaⅠ(10 U/μL)1 μL,10×Buffer Tango 1 μL,载体质粒 6 μL,ddH2O 2 μL,反应条件为37 ℃金属浴2~3 h,电泳验证酶切结果。大肠感受态(E.coli)DH5α 购自宝日医生物技术(北京)有限公司,电转法转化目的基因。In-Fusion方法将线性化pCAMBIA3300载体与目的基因片段连接反应体系为目的片段 1 μL,XbaⅠ酶切pCambia3300载体 1 μL,5×In-Fusion HD Enzyme Premix 1 μL,ddH2O 2 μL,反应总体积 5 μL,50 ℃连接15 min。
采用Master Mix方法菌液PCR方法检验阳性克隆,吸取1 mL阳性克隆菌液送往北京华大基因科技有限公司测序。
1.2.4GmVE2在大豆组织及生育时期转录水平分析 在东农50大豆品种R5-R8生育时期每间隔7 d取各时期籽粒(共9次)以及东农50大豆品种R6期各组织(根、茎、叶、子叶、芽)样本,对籽粒和组织样本用TRIzol法提取总RNA,进行反转录并以该cDNA为底物,结合Actin基因内参引物及基因特异性荧光定量引物,进行实时荧光定量PCR检验(内参基因及目的基因每种处理需设置3次重复)。相对定量ΔΔCT方法中CT值为3次重复试验取平均数,相对拷贝数计算公式为 2-ΔΔCT(ΔΔCT=CT目的基因-CT内参Actin基因)[14]。以内参基因Actin的表达量的平均值作为参考,检测GmVE2在大豆组织及生育时期基因表达情况。
1.2.5 大豆组织及籽粒中维生素E含量的测定 将东农50大豆品种组织及籽粒在60 ℃条件下进行烘干,取烘干的样品研磨成粉末,取0.4 g粉末加入0.05 g抗坏血酸和4 mL的80%色谱级乙醇,涡旋振荡20 s后磁力振荡20 min,9 000 r/min离心10 min,用注射器抽取2 mL上清液过滤灭菌进行待测,液相色谱流动相为色谱级甲醇,流速为1.2 mL/min,检测器选用FLD检测器,激发波长和发射波长分别为292,330 nm[15]。
1.2.6 数据分析 采用SPSS 2.0对基因表达量和维生素E含量作相关性分析。
2 结果与分析
2.1 GmVE2基因编码蛋白的生物信息学分析
2.1.1GmVE2一级结构及理化性质及分析 利用ExPASy-ProtParam 软件分析GmVE2基因编码的蛋白质一级结构,结果表明,GmVE2基因编码区编码167个氨基酸,其中Ile(占11.4%)的含量最多,不存在Pyl、Sec等氨基酸(图1);该蛋白分子式为C904H1326N208O246S10,分子质量为19.364 3 ku,总原子数为2 694,理论等电点(pI)为4.78,脂肪指数为87.01;蛋白正负电荷残基数分别为11和23。该蛋白的不稳定系数和GRAVY值分别为25.02,0.043,这表明该蛋白是稳定的疏水性蛋白(表1)。
A.丙氨酸;R.精氨酸;N.天冬酰胺;D.天冬氨酸;C.半胱氨酸;Q.谷氨酰胺;E.谷氨酸;G.甘氨酸;H.组氨酸;I.异亮氨酸;L.亮氨酸;K.赖氨酸;M.蛋氨酸;F.苯丙氨酸;P.脯氨酸;S.丝氨酸;T.苏氨酸;W.色氨酸;Y.酪氨酸;V.缬氨酸。
A.Alanine; R.Arginine; N.Asparagine; D.Aspartic acid; C.Cystine; Q.Glutarnine; E.Glutamic acid; G.Glycine; H.Histidine; I.Isoleucine; L.Leucine; K.Lysine; M.Methionine; F.Phenylalanine; P.Proline; S.Serine; T.Threonine; W.Tryptophan; Y.Tyrosine; V.Valine.
图1 GmVE2蛋白氨基酸组成
Fig.1 Amino acid composition of GmVE2 protein

表1 GmVE2理化性质分析Tab.1 Analysis of physical and chemical properties of GmVE2
2.1.2 GmVE2蛋白跨膜结构、信号肽及磷酸位点的预测 在SignalP 4.1软件对GmVE2氨基酸进行预测,结果表明,GmVE2蛋白为分泌蛋白,其Smean值为0.741,存在信号肽(图2)。

图2 GmVE2蛋白信号肽预测Fig.2 Signal peptide prediction of GmVE2 protein
利用TMHMM软件预测GmVE2蛋白有2个跨膜区域(图3),分别位于氨基酸2-24位和85-107位。

图3 GmVE2蛋白质跨膜结构预测Fig.3 Transmembrane structure prediction of GmVE2 protein
通过NetPhos-3.1软件预测该蛋白有13个潜在磷酸化位点(图4),包括5个丝氨酸(Serine)、4个酪氨酸(Tyrosine)和4个苏氨酸(Threonine)位点。
2.1.3GmVE2基因蛋白质二级结构和三级结构 利用SOPMA软件对GmVE2氨基酸序列进行蛋白质二级结构预测(图5),结果表明,GmVE2蛋白中最重要的构建元件是α螺旋占氨基酸残基总数的32.34%(Alpha helix),次要元件为无规则卷曲(Random coil)占31.74%,延伸链(Extended strand)和β转角(Beta turn)分别占25.15%和10.75%。利用SWISS-MODEL在线软件建立GmVE2蛋白的三级空间结构模型(图6)。
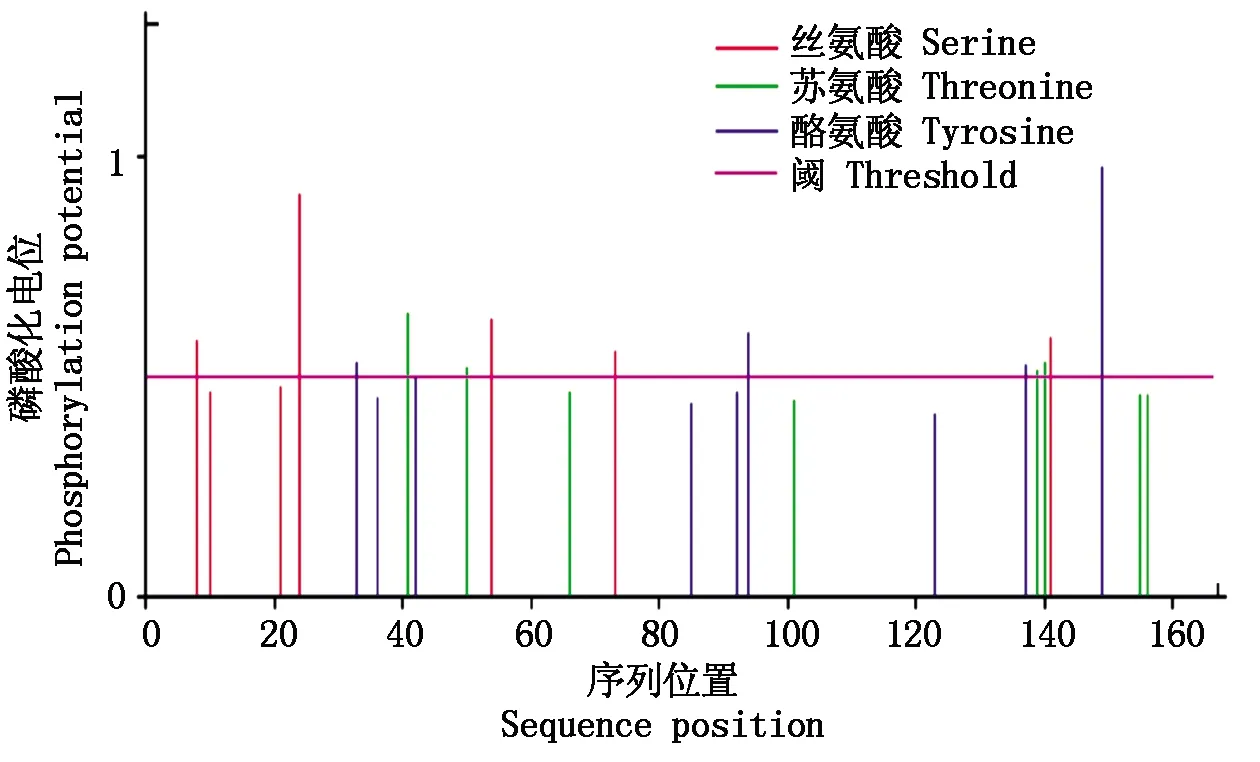
图4 GmVE2蛋白磷酸化位点预测Fig.4 Phosphorylation sites prediction of GmVE2 protein

图5 GmVE2蛋白二级结构预测Fig.5 The secondary structure prediction of GmVE2 protein
图6 GmVE2蛋白三级结构预测Fig.6 The tertiary structure prediction of GmVE2 protein
2.1.4 GmVE2蛋白的系统发生树 在NCBI数据库中使用Blast分析获得GmVE2蛋白较高同源性的氨基酸,利用MEGA 5.0构建系统发生树(图7),结果表明,在19种不同种类植物中,大豆GmVE2蛋白序列与野生大豆一致性最高,该基因在豆科植物进化过程中相对保守。
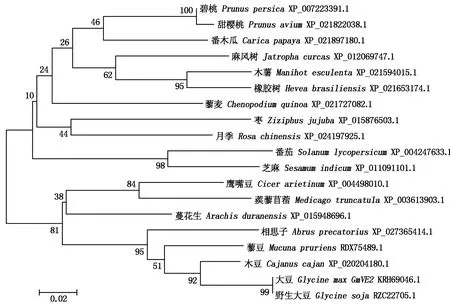
图7 GmVE2的系统发生树Fig.7 Phylogenetic tree of GmVE2 protein
2.2 GmVE2基因克隆及转化
2.2.1 东农50籽粒及组织总RNA提取 选取东农50各生育期籽粒及R6期各组织提取总RNA,通过琼脂糖凝胶电泳检测18S和28S RNA带型清晰可辨(图8),RNA完整性好、纯度高。

1-9.籽粒生育期9次动态取样籽粒总RNA(按取样时间排列,间隔7 d);10-14.各植物组织总RNA(10.根;11.茎;12.芽;13.子叶;14.叶片)。1-9.9 dynamic sampling of total grain RNA at grain growth stage (arranged by sampling time, 7 days interval);10-14.Total RNA of plant tissues(10.Root; 11.Stem; 12.Bud; 13.Cotyledon; 14.Leaf).

M.DL2000 Marker ;1-6.梯度退火温度PCR产物;退火温度51~56 ℃梯度为1 ℃。M.DL2000 Marker ;1-6.Gradient annealing temperature PCR products;Annealing temperature 51-56 ℃ gradient is 1 ℃.
2.2.2GmVE2基因的克隆 以大豆品种东农50叶片cDNA为模板,PCR扩增获得长度为504 bp的cDNA序列(图9),测序结果用DNAMAN与Phytozome数据库中GmVE2基因的公布序列进行比对,结果表明,东农50的GmVE2基因与目的序列的一致性为100%。
2.2.3 目的基因与克隆载体连接与转化 提取载体pCAMBIA3300质粒单酶切后(图10)与目的基因片段利用In-Fusion连接,获得的pCambia3300-GmVE2植物表达载体,转入DH5α大肠杆菌感受态中筛选,进行菌液PCR检测(图11)。将携带目的片段的大肠杆菌提取质粒DNA后,电转法转入根癌农杆菌EHA105感受态细胞进行筛选和验证(图12),结果表明,片段大小与目的基因大小相同。

M.DL2000 Marker;1-11.11个不同单克隆菌液。M.DL2000 Marker; 1-11.Eleven different monoclonal solutions.
2.3 GmVE2在大豆组织及籽粒基因表达模式与维生素E含量相关关系
2.3.1 籽粒动态基因表达模式及维生素E含量 将籽粒生育期动态取样(间隔7 d)提取RNA,进行反转录,以Actin引物为内参,进行荧光定量PCR分析,分析GmVE2基因在东农50籽粒积累中表达量动态(图13),其中,被测样品维生素E含量利用液相色谱法获得(图14)。对籽粒中GmVE2基因动态表达量与维生素E含量分析发现,GmVE2基因表达量在籽粒鼓粒期下调,籽粒中维生素E含量提高;籽粒在鼓粒足期到初熟期转变过程中,基因表达量上调,籽粒中维生素E含量下降;籽粒脱水到达成熟期,基因表达量下调,维生素E含量达到最高。相关分析显示籽粒中该基因表达量与维生素E含量呈负相关(-0.951*)。

1-9依次表示时期内取样次数;a-h依次表示样品间差异显著性。图14-16同。1-9. The number of samplings in a period; a-h. The significance of differences between samples.The same as Fig.14-16.

图14 R5-R8生育期籽粒中动态维生素E含量Fig.14 Dynamic vitamin E content in grain at growth stage of R5-R8
2.3.2 籽粒生殖生长时期GmVE2基因表达模式和维生素E含量相关关系 通过对籽粒在R5-R8生殖生长时期的GmVE2基因表达量和维生素E含量进行分析(图15)。结果发现,基因在R5-R6时期基因表达量下降,进入R7时期表达量显著提高,在R8时期表达量下降到最低,而维生素E含量变化趋势则与之相反。结果表明,大豆R8时期籽粒通过有机物积累后处于休眠状态,代谢缓慢,该时期籽粒中GmVE2基因表达量最低,维生素E含量最高。

图15 籽粒各生殖生长时期GmVE2基因表达量和维生素E含量Fig.15 Expression of GmVE2 gene and vitamin E content in grain at different reproductive growth period
2.3.3 植物组织中GmVE2基因表达模式和维生素E含量 采用上述定量检测对大豆组织进行处理,结果发现,GmVE2基因在大豆植物组织中的表达量在茎中最高,其次是大豆子叶和叶片,且绿色组织中GmVE2基因表达量和维生素E含量显著高于非绿色组织(图16),进一步推测该基因主要活跃位置为叶绿体。另外,维生素E含量在组织中普遍偏低,在子叶中较高,芽中含量最低。

图16 大豆植物组织中GmVE2基因表达量和维生素E含量Fig.16 Expression of GmVE2 gene and vitamin E content in soybean plant tissue
3 讨论与结论
高等植物中的叶绿体是维生素E生物合成的主要场所[16-17],有研究发现高等植物中NADH复合体介导的,围绕叶绿体PS Ⅰ的循环电子传递系统是植物适应各种自然环境胁迫的一个十分重要的保护机制[18]。其中,NADH脱氢酶和维生素E合成都与植物光合作用有关。在植物衰老过程中,从叶绿体到有色体的过渡以及在种子发育过程中维生素E的含量均增加[19-20]。Catalá等[21]学者研究观察发现,NDHA和NDHF在大麦黄化质体向叶绿体发育过程中表达量逐渐减少,NAD(P)H脱氢酶活性逐渐降低,而在衰老的叶片组织中表达量又增高;进而发现在果实成熟初期(即叶绿体转变为有色体期间),NDH积累在外果皮中,其含量和活性随着果实转红而降低[22]。干旱条件下,基因缺失烟草突变体对抗霉素比野生型敏感得多,且具有较高的维生素苯醌水平,表明其抗氧化能力减弱[23]。而GmVE2基因可通过调节叶绿体PS Ⅰ系统电子链传递间接影响ATP合成,从而调控叶绿体中磷酸化反应来影响生育酚合成底物PDP主要前体的合成,进而调控维生素E合成。本研究通过对大豆GmVE2进行生物信息学分析,预测结果表明,GmVE2基因编码区共编码167个氨基酸,分子式为C904H1 326N208O246S10,分子质量为19.364 3 ku,总原子数为2 694,理论等电点(pI)为4.78,脂肪指数为87.01;蛋白正负电荷残基数分别为11和23;GmVE2蛋白的不稳定系数和GRAVY值分别为25.02和0.043,说明GmVE2编码蛋白是稳定的疏水性蛋白并存在跨膜结构、信号肽和磷酸化位点。并从东农50中克隆GmVE2基因并构建植物表达载体,为后续验证提供载体资源。
叶片是主要生育酚合成器官,茎是生育酚主要运输器官,大豆籽粒是生育酚主要贮藏器官。生育酚主要存在于叶绿体、细胞质膜等膜性结构上,由于其结构的特殊性,头部酚羟基能够捕获并清除ROS,抑制多不饱和脂肪酸(PUFA)氧化,从而保护植物体细胞避免过度氧化产生的有害物质的毒害。保护DNA和染色体免受破坏,通过中断自由基反应从而保护细胞膜功能,还可以延缓光引起的氧化分解,保护叶绿体光合作用。植物体内抗坏血酸和谷胱甘肽可以通过植物本身Halliwell-Asada循环,将生育酚过氧化自由基重新还原成生育酚[24-25]。生育酚也参与植物信号传导、基因表达和体内糖类运输[26]。前人研究发现,植物生长R6期维生素E各组分积累量最少,R8期其含量基本稳定,大豆籽粒中最终维生素E含量主要由R6-R7期决定[9]。本研究利用东农50不同生育时期的籽粒以及各组织进行基因表达量与维生素E含量相关分析,结果表明GmVE2基因在R7生育时期的籽粒中动态表达量最高,维生素E含量在R8期的籽粒中最高,动态籽粒中GmVE2基因的动态表达量与维生素E含量呈显著负相关(-0.951*),在各绿色组织中GmVE2基因表达量及维生素E含量均显著高于其他组织。最终验证了该基因可影响维生素E含量,为高维生素E大豆新品种的培育提供理论依据。
本研究通过对大豆GmVE2进行生物信息学分析,预测该基因编码蛋白分子式为C904H1 326N208O246S10,分子量为19.336 4 ku,为稳定的疏水性蛋白,存在跨膜结构、信号肽及多个潜在磷酸化位点。并从东农50中克隆GmVE2基因并构建植物表达载体,为后续验证提供载体资源。另外,研究发现动态籽粒中GmVE2基因的动态表达量与维生素E含量呈显著负相关(-0.951*),在绿色组织中GmVE2基因表达量及维生素E含量均显著高于其他组织。
