浙南坛紫菜实验品系与传统品系遗传多样性的AFLP分析
2020-06-28刘颖张鹏王铁杆任鹏
刘颖,张鹏,王铁杆*,任鹏
(1.浙江省海洋水产养殖研究所,浙江 温州 325005; 2.浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
坛紫菜(Pyropiahaitanensis)属于红藻门(Rhodophyta),红藻纲(Rhodophyceae),红毛菜目(Bangiales),红毛菜科(Bangiaceae),法紫菜属(Pyropia)[1]。主要栖息在潮间带,是我国特有暖温带性种类,分布于浙江、福建和广东三省沿海[2],其产量约占全国紫菜总产量的75%[3]。浙江坛紫菜产业位居全国第二,坛紫菜是浙江省第一大经济海藻,栽培面积6 667 hm2,养殖品种主要以原有的野生型为主。近年来气候变化明显加剧,本地养殖品系连续发生严重病烂,养殖减产,所以推广具有优良性状的新品系对坛紫菜产业的健康发展具有重要意义。然而对于筛选推广的新品系的遗传多样性水平及其与传统的本地养殖品系坛紫菜的遗传多样性差异尚不清楚。遗传多样性是生物对复杂环境适应能力的一种反应[4],是评价生物资源状况的重要依据。因此,对坛紫菜新品系遗传多样性水平的研究具有重要意义。
扩增片段长度多态性(amplified fragment length polymorphism,AFLP)是迄今最有效的分子标记之一,已被大量运用在大型海藻的种质鉴定[5-6]、遗传多样性分析[7-8]、连锁图谱构建等领域[9],因此,本研究选用AFLP标记技术对不同品系的坛紫菜进行遗传多样性分析,以了解其遗传多样性和遗传特征等信息,为坛紫菜种质资源的遗传背景信息积累提供参考[10]。
1 材料与方法
1.1 材料
本实验所用坛紫菜样品浙南3号和玉环当地养殖种于2017年11月8日随机采自浙江省台州市玉环市箬笠礁海域中的养殖网帘,各取30株用于AFLP分析。
1.2 基因组DNA的提取
使用“DN14-植物基因组DNA快速提取试剂盒”(北京艾德莱生物科技有限公司,DN1401)按照操作说明提取坛紫菜基因组DNA,经1%琼脂糖凝胶电泳检测其完整性后,利用微量分光光度计(Nano-400)测定DNA的质量与浓度,将DNA浓度调至20 ng·μL-1,-20 ℃保存备用。
1.3 AFLP分析
用于AFLP分析的内切酶(EcoRⅠ和MseⅠ)和T4 DNA连接酶为Fermentas公司生产;实验所用的接头和引物由英潍捷基(上海)公司合成,序列见表1。毛细管电泳检测由生工生物工程(上海)股份有限公司完成。反应步骤和反应体系如下:

表1 AFLP引物与接头序列
酶切体系:模板DNA(20 ng·μL-1)5 μL,EcoRⅠ(10 U·μL-1)0.1 μL,MseⅠ(10 U·μL-1)0.1 μL,10×Tango Buffer 4 μL,灭菌纯净水补齐至20 μL。反应条件:37 ℃酶切4 h,接着65 ℃酶切4 h,80 ℃灭活20 min。
连接体系:酶切产物5 μL,T4连接酶0.5 μL,10×T4 Buffer 1 μL,50% PEG4000 1 μL,EcoRⅠ接头(5 μmol·L-1)0.5 μL,MseⅠ接头(50 μmol·L-1)0.5 μL,灭菌纯净水补齐至10 μL,22 ℃连接1 h,70 ℃灭活5 min。
预扩增:连接产物1 μL,Taq酶(5 U·μL-1)0.2 μL,10×PCR Buffer(Mg2+)2 μL,EcoRⅠ preamp primer(10 μmol·L-1)0.5 μL,MseⅠ preamp primer(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)0.4 μL,灭菌双蒸水补齐至20 μL。反应程序:94 ℃预变性2 min;进行20个循环(94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸10 min。
选择扩增:将预扩增产物稀释10倍进行选择性扩增。预扩增产物稀释液2 μL,Taq酶(5 U·μL-1)0.2 μL,10×PCR Buffer(Mg2+)2 μL,EcoRⅠ引物(10 μmol·L-1)0.5 μL,MseⅠ引物(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)0.4 μL,灭菌双蒸水补齐至20 μL。反应程序:94 ℃预变性2 min;以每个循环降1 ℃的梯度从65 ℃退火到56 ℃退火(94 ℃变性30 s,65 ℃~56 ℃退火30 s,72 ℃延伸30 s);然后进行27个循环(94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸10 min。
选择性扩增产物送至生工生物工程(上海)股份有限公司进行毛细管电泳。用ABI 3730XL自动测序仪(Applied Biosystems, USA)对PCR产物进行基因分型,用GeneMapper Software 5进行等位基因大小分析。
1.4 数据分析
根据毛细管电泳结果选取片段大小在0~500 bp的片段进行统计,构建“0、1”矩阵,运用PopGen 3.2软件计算种群内部的观测等位基因数(Na)、有效等位基因数(Ne)、 Nei’s基因多样性指数(H)以及Shannon’s多样性信息指数(I)、种群总遗传变异(Ht)、种群内遗传变异(Hs)、种群间遗传分化系数(Gst)、种群间基因流动系数(Nm)。用AFLP data analyzer[11]计算各群体间的相似系数和遗传距离,根据遗传距离,采用MEGA 7.0分析2个品系之间的聚类关系,构建UPGMA和NJ系统发育树。
2 结果与分析
2.1 AFLP扩增多态性
用16对引物组合对坛紫菜样品进行扩增,共筛选出以下8对多态性好的引物组合:E-AAC/M-CAG、E-AAC/M-CTC、E-AAC/M-CTG、E-AAG/M-CAG、E-AAG/M-CTC、E-AAG/M-CTG、E-AGG/M-CAA、E-ACC/M-CTG。用筛选出的8对引物对2个群体ZN3(n=30)和YH(n=30)进行AFLP分析(图1),共得到964个有效位点。每对引物扩增位点在53~181个,平均每对引物扩增出120.5个AFLP位点。扩增位点最多的引物对是E-AAG/M-CTC。每对引物扩增的多态位点比例均大于97%(表2)。

图1 坛紫菜部分AFLP选择性扩增结果

表2 AFLP选择性引物的扩增结果
2.2 遗传多样性
遗传多样性是生物对复杂环境适应能力的一种反应,是评价生物资源状况的重要依据。本实验中8对引物在ZN3和YH群体中检出多态位点数及比例(PPL)分别是665个(69.0%)和786个(81.5%),其中ZN3的多态位点数低于YH群体,Nei’s遗传多样性指数(H)和Shannon’s信息指数(I)也低于YH群体(表3),因此,认为YH本地坛紫菜具有较高的遗传多样性。

表3 2个坛紫菜品系的遗传多样性参数
2.3 遗传结构
2个坛紫菜群体的种群总遗传变异(Ht)和群体内遗传变异(Hs)分别为0.240 2和0.177 8,群体间遗传分化系数(Gst)为0.252 6,即群体间遗传变异占总变异的25.3%,群体内遗传变异占总变异的74.7%,表明不同品系的群体间遗传分化程度较低。2个坛紫菜群体间基因流动系数(Nm)为1.593 0,表明坛紫菜不同品系间存在一定的基因交流。坛紫菜群体间遗传相似度和遗传距离见表4。
2.4 2个品系坛紫菜聚类分析
基于个体间的遗传距离构建UPGMA和NJ聚类图(图2)。聚类分析表明,60个坛紫菜个体分成 2支,ZN3号的30个个体聚成一支,YH的30个个体聚成另外一支。

表4 群体间遗传相似度和遗传距离
注:对角线上为遗传相似度;对角线下为遗传距离。
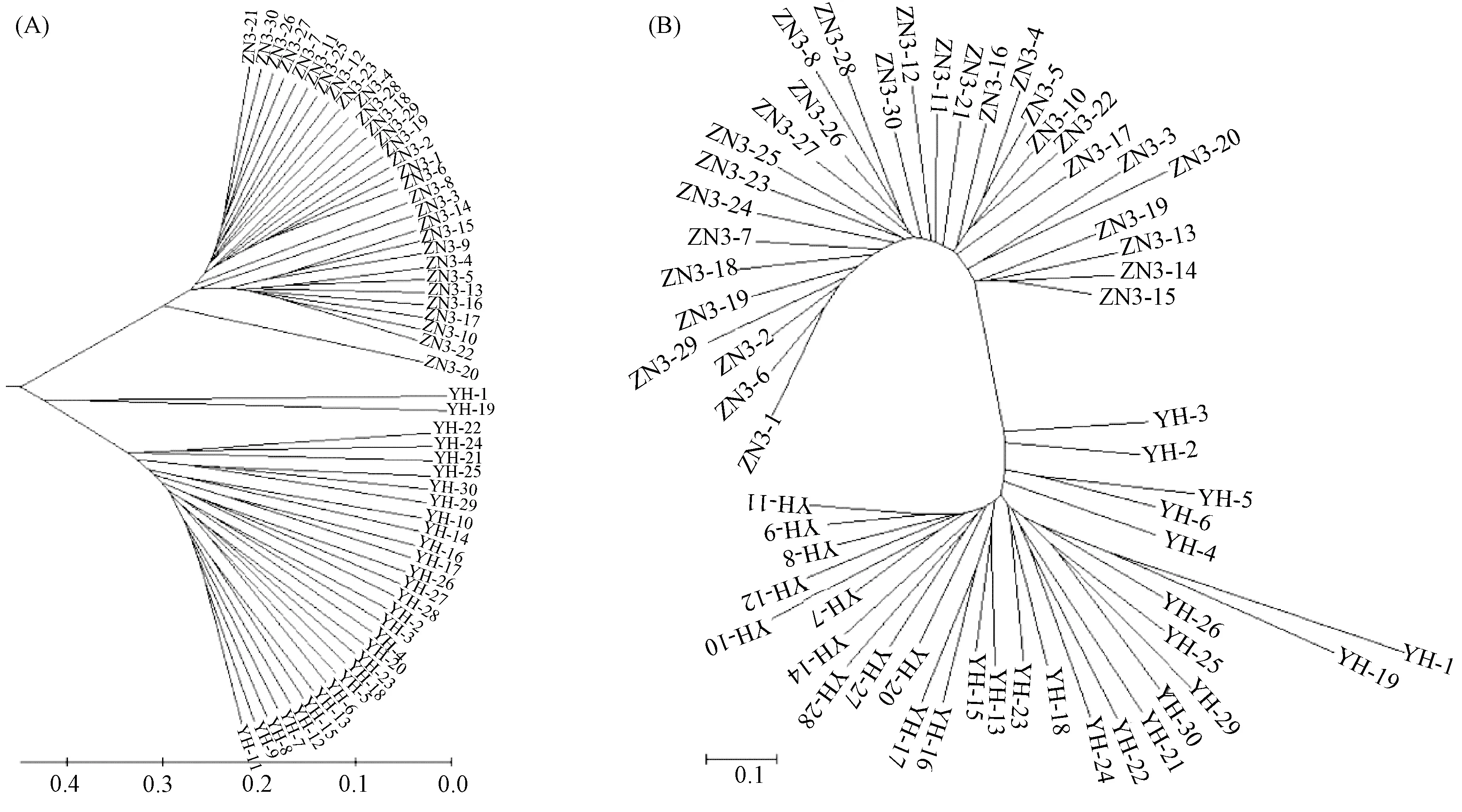
图2 基于遗传距离的坛紫菜UPGMA(A)和NJ(B)聚类树
3 讨论
3.1 坛紫菜的遗传多样性
物种或群体通过长期的进化积累丰富的遗传变异,这些遗传变异的总和构成了物种或群体的遗传多样性[12]。国内已有多位学者利用分子标记技术探讨坛紫菜种质资源多样性和遗传差异[13-16],这些研究结果表明,坛紫菜的种质资源多样性是极为丰富的。而相对于其他DNA标记技术,AFLP标记多态带比例高、实验结果稳定,不受基因组来源和复杂程度影响,重复性好并呈孟德尔遗传的标记,且在生物基因组信息未知的条件下,就能够检测亲缘关系非常近的材料之间的差异[17-18]。
本实验利用AFLP技术分析了ZN3和YH 2个群体共60个样本,结果显示,2个群体的多态位点百分率分别是69.0%和81.5%;其中YH群体的多态位点比例高于ZN3群体,这可能是因为YH本地传统养殖品系的种菜来源多样且范围大,而ZN3选育品系的种菜来源范围较小,所以YH群体的遗传多样性较高。
3.2 坛紫菜群体的遗传结构
坛紫菜的遗传结构是由基因流和遗传漂变2因素综合决定的,基因流动程度会对群体的遗传结构产生重要影响,理论上,若Nm>1,则说明群体间有一定程度的基因流动;若Nm<1,则说明群体间分化明显[12]。本研究中,2个坛紫菜群体间基因流动系数Nm为1.593 0,表明其群体间存在一定的基因交流。目前紫菜养殖品种(系)间相互混杂,海区风浪较大,这都增加了品种(系)间基因交流的机会[7]。从UPGMA和NJ聚类图中可以看出,ZN3和YH 2个群体明显分为2大支,群体之前并没有个体混杂情况出现,说明本次样品采集有效合理,实验结果可靠。
综上所述,本研究结果揭示了浙南传统养殖坛紫菜和选育坛紫菜品系间的遗传多样性差异,为了解浙南周围坛紫菜资源提供了一定的理论支持。后续的实验将会对更多浙南地区不同品系的坛紫菜样品进行遗传多样性分析。
