DNA分子标记技术在坛紫菜(Pyropia haitanensis)中的应用
2020-06-28吴晓雯王铁杆
吴晓雯,王铁杆,刘 颖,张 鹏
(浙江省海洋水产养殖研究所,浙江 温州 325035)
坛紫菜(PyropiahaitanensisChang et Zheng)隶属于红藻门(Rhodophyta),红藻纲(Rhodophyceae),红毛菜科(Bangiaceae),法紫菜属(Pyropia)[1],是一种暖温带大型藻类,在浙江、福建和广东都有分布,是我国特有经济种类[2]。目前我国坛紫菜的总产量占全国紫菜总产量的75%[3]。坛紫菜味美价廉,富含蛋白质、多糖、大量人体必需氨基酸、矿物质和维生素,是品质较高的营养保健品,可供食用和药用,有着“营养宝库”的美称,其经济价值和生态价值越来越来越受到大家的关注。
DNA分子标记指的是与特定基因或标记连锁的一段经过扩增并可以检测出的DNA序列。分子标记具有以下优点:1)在生物不同生长阶段,不同组织都可以进行基因检测;2)基因型不受环境的影响;3)表现为显性或共显性遗传,有利于对隐性基因的选择;4)标记数量较多[4]。自从1974年Gmdzicker等创立限制性片段长度多态性技术以来,已有几十种名称各异的分子标记技术相继问世。近年来已有多种分子标记技术在藻类的相关研究中得到了很好的应用,已经被广泛用于藻类种质鉴定[5]、杂种优势性状跟踪[6]、遗传多样性分析[7]等研究中。
随着育种技术的快速发展,DNA分子标记技术和传统的育种技术的结合程度也越发紧密,提高育种选择的准确性,提高育种效率,缩短育种时间,对紫菜新品种培育也有积极的促进作用。因此,本文对DNA分子标记技术在坛紫菜的应用研究进行综述,主要介绍了DNA分子标记技术在坛紫菜遗传学多样性、物种鉴定、指纹图谱构建、种群和亲缘关系方面的研究,同时阐述现在坛紫菜研究存在的问题,并对发展前景进行展望。
1 常见的DNA分子标记技术
DNA分子标记是以生物DNA的多态性为研究基础的遗传标记,具有无表型效应、不受环境因素影响的特征,随着生物分子技术的发展,目前较为常见的DNA分子标记主要有:限制性内切酶片段长度多态性标记(Restriction fragment length polymorphism,RFLP)、随机扩增片段长度多态性标记(Randomly amplified polymorphic DNA,RAPD)[8-9]、扩增片段长度多态性标记技术(Amplified fragment length polymorphism,AFLP)[10]、特定序列扩增标记技术(Sequence characterized amplified regions,SCAR)[11]、相关序列扩增多态性(Sequence related amplified polymorphism,SRAP)、简单重复序列(Simple sequence repeats,SSR)、简单序列重复区间扩增多态性(Inter-simple sequence repeat,ISSR)[12],详见表1。由于每一种DNA分子标记都有其优缺点,不能达到全面和完美的实验效果,因此,结合需要解决主要问题选择合适的分子标记尤为重要,否则直接影响实验结果和分析。
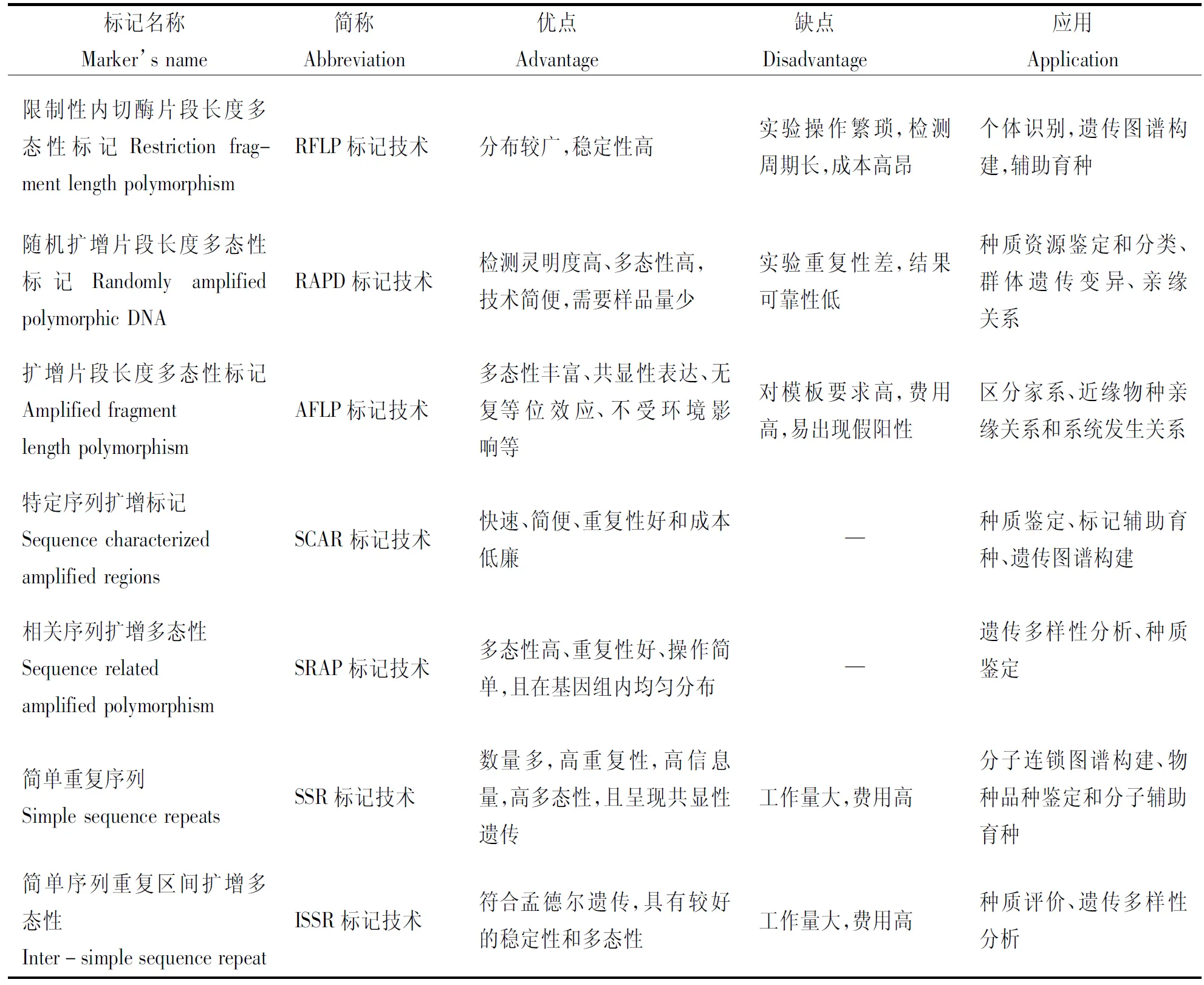
表1 常见DNA分子标记
2 DNA分子标记技术在坛紫菜中的应用现状
2.1 遗传多样性分析
DNA分子标记在坛紫菜的多样性研究方面应用较广。胡则辉等[13]从坛紫菜丝状体获得基因组DNA,经过克隆筛选测序,获得172个微卫星序列,其中完美型序列107个(占62.2%),并发现坛紫菜的(GC)n与(CG)n含量非常丰富,该研究为今后微卫星标记在坛紫菜遗传多样性的研究应用奠定分子理论基础;谢潮添等[14]使用SRAP分子标记从15个坛紫菜种质筛选出15对特异性引物,多态位点占75.4%,表明坛紫菜遗传多样性较高;杨惠等[15]利用EST-SSR序列设计合成了10对引物,检测到 4个位点在8个不同来源坛紫菜叶状体间存在多态性,认为可以从坛紫菜EST数据库中筛选SSR标记进行遗传多样性分析;陈昌生等[16]利用ISSR 分子标记对福建省3个野生坛紫菜种群共60 个个体进行了遗传多样性分析,结果表明坛紫菜种群内个体间的遗传变异较大,遗传多样性水平较高;纪德华等[17]以野生型坛紫菜(♀)和经过人工诱变选育获得的红色型(♂)坛紫菜进行杂交并获得丝状体和叶状体杂交后代,挑选出其中5个性状稳定子代品系为实验材料,筛选出21条ISSR引物,多态位点高达94.8%,发现杂交可以显著提高坛紫菜的遗传多样性水平,并提出ISSR标记是预测杂种优势的有效工具;江灵芝等[18]对浙江4株不同坛紫菜进行ISSR分析,结果显示多态性条带达88.71%,说明浙江附近岛屿的野生坛紫菜遗传多样性较为丰富。通过以上研究发现,坛紫菜遗传多样性较高,使用ISSR分子标记检测的遗传多态性更高。
2.2 物种鉴定
RAPD只适合大规模种群遗传学研究,不适合系统发育研究,徐涤等[19]使用RAPD技术对5个紫菜品系的遗传差异进行分析,成功扩增出坛紫菜特异性片段,有效区分于其他紫菜,可为紫菜种质库的品系管理提供可信的分子证据;陈奕欣等[20]以福建省主要栽培品种和诱变筛选的突变品系为实验材料,使用AFLP标记技术有效区分了样品间存在的差异;纪德华等[17]使用ISSR标记对以野生型坛紫菜(♀)和经过人工诱变选育获得的红色型(♂)坛紫菜杂交获得的丝状体和叶状体进行分析,发现杂交使坛紫菜的遗传多样性水平得到提高,出现明显的杂种优势,虽从遗传距离角度分析母本细胞质基因在杂种性状遗传方面发挥了重要的作用,但后期仍需要从基因序列多角度进一步佐证;吴亚亚等[21]对高蛋白、生长快的两个优良品系和野种种群叶状体进行研究,发现这两个优良品系虽来自野生种群,但从基因型分析养殖种群和野生群已经出现遗传分化,虽然是DNA特异性标记,但依旧会受到非特异性扩增条带的影响,从而影响主观判断;张鹏等[22]从52 对微卫星引物中筛选出7 对引物对坛紫菜9个品系(2个野生品系、2个优良品系、2个杂交品系、3个色素突变品系)丝状体进行了亲缘关系分析,该研究发现在引物PC-40 界定的遗传座位上,“申福1号”和优质6号的丝状体和叶状体均出现了区别于其他品系的等位基因,该结果证明可以使用SSR特异性标记对不同紫菜品系进行有效区分,但是由于坛紫菜微卫星侧翼序列保守性未知,因此需要考虑假阳性条带对实验的影响;魏玲[23]通过对坛紫菜研究发现,坛紫菜品系之间遗传相似性在51.85%~81.48%之间,具有丰富的遗传多样性,SSR标记可以用于鉴定出坛紫菜纯系和杂合品系;王婷等[24]筛选出9个RAPD标记,并进一步将两个特异性标记成功转化为特异SCAR 标记(Z26-600和Z26-360),实验证明其可以作为“闽丰1号”(Z-26)品系的特异和稳定性标记,但并非所有RAPD的特异分子标记都能成功地转换成SCAR 标记;张庆杰等[25]使用SSR标记,成功地在“申福2号”丝状体和叶状体扩增出特异性条带,认为SSR标记9#引物可以用于该品系的种质鉴定;Kim等[26]使用PCR-RFLP分子标记对6种紫菜进行鉴定并取得了较好的成果,有效将坛紫菜与其他紫菜分离。目前的分子标记技术,虽然存在缺陷,但是都可以有效地将坛紫菜与其他的物种区分开,这是紫菜研究工作的基础。
2.3 指纹图谱的构建
杨锐等[27]利用AFLP技术对浙江和福建两省的野生坛紫菜以及栽培坛紫菜进行分析,得到了可靠的AFLP可靠指纹图谱,并找到可作为筛选与生长性状相关的标记;刘必谦等[28]采用3对EST-SSR引物扩增出的5个条带构建了8个坛紫菜丝状体品系的DNA 指纹,使得每个丝状体品系都有独一的指纹模式;Zuo等[29]通过基因库获得坛紫菜11个微卫星多态位点,认为可用于紫菜的遗传图谱构建、分子辅助标记等;Qian等[30]首次利用SRAP分子标记技术对三种紫菜的16个样品进行遗传学分析,建立了各自特有的遗传图谱;谢潮添等[31]利用ISSR技术将4个坛紫菜色素突变体扩增出现的特异性条带,转化为计算机可以识别和处理的数码指纹的指纹图谱,虽然该图谱使用引物条带作为图谱,扩增的条带可能存在假阳性,但给坛紫菜的鉴定工作带来了较大的便利和新的工作思路;随后,谢潮添等[32]根据3对SSR引物对44个坛紫菜种质材料扩增出的16个多态位点构建出44个坛紫菜的特异性DNA指纹图谱,并在之前工作基础上,开发出相应的数码指纹识别软件,为坛紫菜种质的自动化鉴定和信息化管理奠定了基础,但是由于标记本身固有缺陷,在后期受人为因素影响较大,缺乏相应的指纹图谱识别软件,因此在实际应用中难度较大;同年,徐燕等[33]以野生型坛紫菜纯系(♀)和红色型坛紫菜纯系(♂)作为杂交亲本,创建了由157 个株系组成的坛紫菜DH 作图群体,并用经过筛选的24 对SRAP 引物和16 对SSR 引物对父母本及作图群体各株系进行双标记分析,首次构建坛紫菜分子遗传连锁图谱,其基因组覆盖率为92.0%。目前,坛紫菜DNA 指纹图谱构建存在统计方式、条带判断主观性和不同实验室的研究数据难以共享等问题,需要做进一步研究。
2.4 种群亲缘关系分析
陈骁等[34]通过对2个代表性坛紫菜栽培品种和27个野生品种和2个条斑紫菜进行比较,条斑紫菜纯度较高,野生坛紫菜和养殖坛紫菜遗传差异较大,遗传育种仍有较大的发展空间。谢潮添等[31]用ISSR分子标记技术对4个不同颜色坛紫菜(P.haitanensis)丝状体品系及1个野生型对照品系进行比较,发现这4个不同养殖坛紫菜丝状体间的平均遗传距离为0.572 7,它们同野生型对照的平均遗传距离为0.656 4,养殖型已经与野生型发生明显的差异。赵玲敏等[35]对10个野生坛紫菜的5.8S rDNA-ITS区片段序列进行扩增,结果显示ITS区序列有差异,5.8S rDNA虽保守,但与其他紫菜同区域存在较大差异,认为可以用该段区域对坛紫菜进行种质鉴定和系统进化分析。该结论也得到了Li等[36]和Chen等[37]的证实;Li等[38]使用基因间隔区(Intergenic spacer region,IGS)对福建、广东、浙江的坛紫菜进行比较,发现这三个区域的坛紫菜有显著差异;王鑫等[39]使用AFLP技术坛紫菜和条斑紫菜的杂交后代品系进行分析发现,在分子水平上后代与亲代均存在不同之处,但是与坛紫菜亲缘关系较远。总之,现代分子标记在紫菜亲缘关系分析中起着重要的作用。
3 存在的问题
3.1 坛紫菜特殊生活史问题
一方面,坛紫菜生活史存在异型交替的叶状体和丝状体两个世代[2]。坛紫菜的雌雄叶状体都能进行单性生殖,经过染色体加倍后,产生纯合二倍体丝状体,且后代叶状体是单性可育的。另一方面,有性生殖的坛紫菜属于雌雄同体,坛紫菜减数分裂发生在壳孢子萌发时的最初两次分裂,减数分裂完成后壳孢子产生的4 个子细胞继续分裂,最终发育成为直线排列的2~4块遗传组成不同的镶嵌叶状体,在缺乏明显标记的情况下,是无法区分同一叶状体上的各块嵌合体的,因此也就无法对其进行准确的遗传分析,叶状体只有经过单性生殖纯化后才可以作为理想实验材料,以减少嵌合体的干扰;而坛紫菜全生活史的实验培养技术难度较大,造成实验材料较难获得。
3.2 单一分子标记缺陷问题
由于很多标记处于不同的发展阶段,技术不够成熟,存在一定的局限性,加上可能存在的错误统计方式,导致某些实验结果出现重复性较差、可靠性较低且无法验证等问题。另外,目前坛紫菜领域的相关研究一般使用单一的分子标记分析,这是产生假阳性结果和造成误判的一个重要原因。因此,需要采用多个标记同时进行鉴定的方法来避免造成误判,只有多个特异性标记都为阳性的情况下,才能确定后续结果的准确性和可靠性。
3.3 技术发展缓慢
关于DNA分子标记技术在坛紫菜中的应用,早年研究较多,但是从时间角度来分析,早期研究比例较大,近几年发展较为缓慢,主要还是集中在遗传多样性分析、品种鉴定,指纹图谱绘制等方面,但是与经济性状相关的标记较少。
4 展望
遗传育种是提高坛紫菜品质和产量的重要环节之一,传统的育种方法主要参考个体大小、色素含量、藻体长宽、厚度等形态学特征进行筛选,随着新品系的不断研发,需要结合现代分子技术,从基因角度去分析坛紫菜的遗传多样性、遗传结构,构建遗传图谱,并筛选出生长速度快、高蛋白、抗病害、抗高温等高产量紫菜品种,从而推动坛紫菜产业高质量发展。
随着对坛紫菜的深入研究,严兴洪等[40]通过坛紫菜的人工色素突变体与野生型进行的杂交实验推导及细胞学实验观察,认为坛紫菜的减数分裂发生的位置在壳孢子萌发时第一和第二次细胞分裂时期,而且坛紫菜大部分为雌雄异体,很容易发生品系间杂交,不具无性生殖,在人工调控下,也能发育为雌雄同体进行自交而培育出纯系,这些特点为坛紫菜今后深入研究奠定良好的基础。
目前,分子生物学和分子技术的不断进步和革新,已经有越来越多的分子标记被开发:EST标记、SNP标记、STS标记、SSCP标记、线粒体DNA标记、叶绿体DNA标记、核糖体DNA标记,基于逆转录转座子的分子标记等,特别是测序技术的快速发展,更多方便有效的分子标记技术将会被开发和应用,针对不同的研究目的可以选择更为合适的研究方法。例如,Xu等[41]利用SLAF-seq技术,构建了坛紫菜第一个高密度遗传图谱,有效确定了与6个经济性状相关的高精度15个QTL定位。但是总的来说,在水产特别是坛紫菜的研究,起步较晚,基础较为薄弱,但是分子标记技术是藻类可持续较好发展的重要保证技术之一,建立在分子标记基础上与经济性状相关的辅助育种技术已经逐渐取得成效,有充分的理由可以相信,在众多研究者的不懈坚持和努力下,分子标记将会在坛紫菜甚至在其他紫菜研究中有更多的应用,在紫菜遗传育种和种质改良中发挥越来越重要的作用。
