金丝李果实化学成分的研究
2020-06-24谭雪甘飞陈玉刘新桥杨光忠
谭雪 甘飞 陈玉 刘新桥 杨光忠


摘要:采用溶剂提取法、正反相硅胶柱、半制备高效液相等多种色谱技术对金丝李果实的化学成分进行了分离纯化,得到了一个新化合物和一个已知化合物,并根据理化性质和现代波谱技术进行了结构鉴定,分别鉴定为金丝李内酯甲(2)和7- epi- isogarcinol(1)。
關键词:金丝李果实;化学成分;多环异戊烯基间苯三酚类化合物
中图分类号:R29 文献标识码:A 文章编号:1674-9944( 2020) 2-0185-03
1 引言
藤黄属植物多为乔木或灌木,全世界约有450种,主要分布于亚洲热带地区、非洲南部和波利尼西亚西部[1]。金丝李(Garcinia paucineru13)属于藤黄科藤黄属植物,为我国传统壮药,自然生长仅见于石灰岩山地森林中,主要分布在广西和云南部分地区,具有治疗胃病、烧伤、消肿、清热解毒等作用[2,3]。目前对金丝李的化学成分研究主要集中在其叶和茎皮等部位,分离得到的多环异戊烯基间苯三酚类化合物( PPAPs)和口山酮对肿瘤细胞的生长有明显的抑制活性[4],而对金丝李果实的相关化学成分和药理活性研究较少,且藤黄属植物的果实是PPAPs的重要来源[5]。为了进一步寻找该植物抗癌作用的活性成分,扩大该药用植物的药用部位,本文对金丝李果实的化学成分进行了研究,从石油醚提取物分离得到一个新化合物金丝李内酯甲(2),一个已知化合物7- epi-isogarcinol(1)。
2 材料与方法
2.1 仪器与试剂
金丝李果实采自广西壮族自治区靖西县邦亮保护区,经中国科学院昆明植物研究所韩春艳博士鉴定为藤黄科藤黄属金丝李植物果实(Garcinia paucinervis Chun&F.C.How).
核磁共振波谱仪(Bruker AVANCEIII- 500 MHz和Bruker AVANCEIIITM-600Hz全数字化超导核磁共振仪,布鲁克公司),高效液相色谱仪( Ultimate 3000半制备型,美国戴安公司,VWD,DAD检测器),半制备型色谱柱为YMC - Pack ODS -A column( 250×10mm,5μm),硅胶(200~300,300~400目,青岛海洋化工厂),薄层色谱硅胶(青岛海洋化工厂产品),ODS硅胶(50 μm,日本YMC公司),石油醚、乙酸乙酯、甲醇(分析纯,国药集团化学试剂有限公司),甲醇、乙腈(色谱纯,昌泰兴业有限公司)。
2.2 提取与分离
金丝李干燥果实11.2kg粉碎后用95%乙醇室温浸泡三次,每次24 h,减压浓缩提取液,得乙醇提取物2.9 kg。乙醇提取物依次用石油醚、乙酸乙酯萃取,得到石油醚提取物(750 g),乙酸乙酯提取物(1450 g)。将石油醚提取物(750 g)经正相硅胶柱色谱(300~400目)分离,石油醚一乙酸乙酯(体积比49:1一0:1)梯度洗脱,TLC检测后合并相同组分,共收集到10个组分(Fr. 1—Fr. 10). Fr. 7(26.8 9)经过反复的正、反相硅胶柱色谱分离和半制备HPLC得到化合物1(17.Omg),Fr. 4(9. 58 9)经过反复的正相硅胶柱色谱分离和半制备HPLC得到化合物2(1. 86 mg).
3 结构鉴定结果
化合物1:黄色粉末,由HR- ESI- MS得到准分子离子峰m/z:625. 3502 [M+Na]+(计算值625. 3505),推断化合物l的分子式为C38 Hs。06,不饱和度为14。由IH NMR图谱可知,化合物1具有一个1,3,4-三取代的苯环[δH8.14 (IH,s),7.29(1H,d,J=8.O Hz),7.76(IH,d,J=8.O Hz)],三个烯氢质子[8H5. 11(2H,br s),5.39 (1H,br s)],十个单峰甲基(8H1. 72~0. 82)。由13C NMR图谱和DEPT图谱可知化合物1存在一个非共轭的羰基碳信号[δc 207. 3(s)],一个共轭的羰基碳信号[δc 195.0(s)],一个3,4-二羟基苯甲酰基信号[δc 193. 2(s),130. 8(s),116. 8(d),147.9(s),153. 7(s),116. 4(d),123. 4(d)],五个亚甲基信号[δc 42.9(t),25. 9(t), 28.3 (t), 28.5(t),30. 2( t)]。由以上NMR数据推测化合物1是具有双环[3.3.1]壬烷骨架的B型PPAPs[6]。将化合物1的NMR数据同化合物isogarcinol[7]对比发现数据大致相同,唯一的区别是两者Me-22的化学位移差异较大,化合物1的C-22化学位移为16.5 ppm,而7- epi- isogarcinol为26.1 ppm.相差9.6 ppm,推测化合物1是isogarcinol的C-7位差向异构体,当化合物1的7位异戊烯基处于e键,与同处于a键的Me- 22产生γ- gauche效应,使Me- 22的化学位移值向高场发生显著移动,由'H-NMR和'3C_NMR图谱给出化合物1的C-7的化学位移为43.7 ppm,H2 -8两个H的化学位移相差0.68ppm,可以确定C-7位上的异戊烯基为β构型[6]。综合以上数据,化合物1的结构鉴定如图l所示,鉴定为7 - epi- isogarcinol,具体NMR数据见表1。
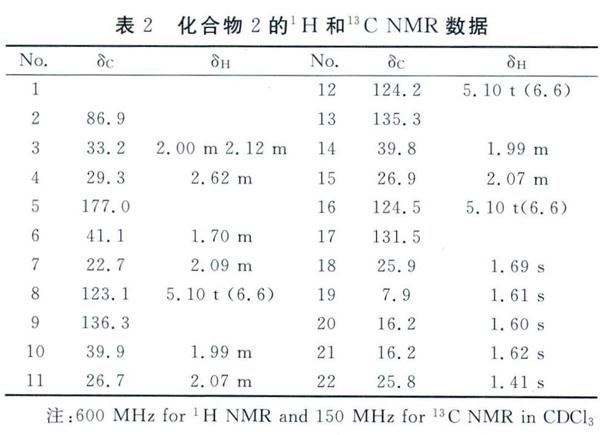
化合物2:无色油状,由HR- ESI- MS得到准分子离子峰m/z 319. 26315[M+Na]+(计算值319. 26316),推断化合物2的分子式为C21H34O2,不饱和度为5。NMR数据显示化合物2含有一个法呢基[δH5. 10(3H, t,J=6.6 Hz),1.69( 3H,s),1.61 (3H,s) ,1. 60(3H,s),1. 62(3H,s),2.43( 2H, m) ,1. 99(4H,m) ,2. 07 (4H, m);δc136.3(s),135.3(s),131.5(s),22.7(t),39.9(t),26.7(t),39.8(t),26.9(t),25.9(q),17. 9(q).16. 2(q),16.2(q)]和一个单峰甲基[8H1. 41(3H,s);δc 25.8(C-22)]。除去上述信号以外,还有一个羰基信号[δc 177. 0],一个连氧季碳信号[ac 86.9],三个亚甲基[δc 33.2,29.3,41.1]。由'H-1H COSY和HSQC图谱(图2)可推出- CH2CH2_和一CH2CH2CH=结构片段,可分别归属δc33.2,29.3,41.1为C-3、C-4和C-6的信号。除去3个双键和1个羰基,化合物2还需要一个不饱和度,由HMBC图谱(图2)可以观察到H-4与δc177.O(C-o),86.9(C-2)相关以及CH。-22与δc41.1(C-6),86.9(C-2)相关,说明C-2,C-3,C-4和C-5构建一个五元内酯环,同时22位的甲基和C-6到C-21的长链多烯片段连接在C-2位上,因此可以鉴定化合物2的结构如图1所示,命名为金丝李内酯甲,具体NMR数据见表2。
4 结语
迄今为止,关于藤黄属果实的化学成分研究多集中于大苞藤黄,多花山竹子,人面果等植物[9-13],其中对于金丝李果实的探讨,化学成分分离纯化研究的文献较少。本实验对金丝李果實石油醚提取物进行了化学成分的研究,得二个化合物,运用NMR、MS等波谱技术鉴定结构为7 - epi - isogarcinol(1)和金丝李内酯甲(2)。本文首次报道了金丝李果实的化学成分,这为扩大该植物的药用部位提供了一定的理论依据。
参考文献:
[1]付文卫,谭红胜,徐宏喜,中国产藤黄属植物中抗肿瘤活性化学成 分的研究概况[J].药学学报.2014,49(2):166-174.
[2]GAO X M, Yu T,FANNY S F I.,et al.Identification and cvalua-tion of apoptotIc compounds from Garclnia paucinervls[J]. Bioor_ganic&.Medicinal Chemistry, 2010, 18( 14): 4957-4964.
[3]1.1 D H.I.1 C X,JIA C C,et al.Xanthones from Garcinia paucin-crvis with in vitro anti proliferative activity agalnst HL- 60 cells[J]. Archives of Pharmacal Research, 2016, 39(2):1 72-177.
[4]HU Q F,MENG Y I.,YAO J H.et al.Flavonoids from Garciniapaucinervis and theIr Biologlcal Activttics [J]. Chemistry of Natu-ral Compounds.2014, 50(6): 994-997.
[5]KUMAR S.SHARMA S.CHATTOPADHYAY S K.The poten-tial health benefit of polyisoprenylated benzophenones from Gar-cinia and related genera: Ethnobotanical anti therapeutic impor-tance [Jl. Fitoterapia, 2013(89) : 86-125.
[6]YAN(; X W.GROSSMAN R B, XU G. ? Research Progress ofPolycyclic Polyprenylated Acylphloroglucinols [J]. Chemical Re-views,2018,118(7) : 3508-3558.
[7]GUSTAFSON K R,BLUNT J W, MURRARY H. The Guttifer-ones, HIV - inhtbitory benzophenones from Symphonia globulif-era, Garcinia livingstone, Garcinia ovalifolia and Clusia rosea [J].Telrahedron, 1992 , 48( 46) : 10093一 10102.
[8]MEsoUITA M L. ARAUJO R M. BEZERRA D P, et al. Cyto-toxicity of 8- tocotrienols from Kielmeyera coriacea against cancercell lines [Jl.
Bioorginic &. Medicinal Chemtstry, 2011. 19 ( l) : 623 -630.
[9]TENG H D.REN Y S.MA Z Y, et al. Homoadamantane polycy-clic polyprenylated acylphloroglucinols from the fruits of Garciniamultiflora [J]. Fitoterapia.2019( 137) : 104245-104241.
[10]CHEN Y.MA Z Y,TENG H D,et al. Adamantyl and homoada-mantyl derivatives from Garcinia multiflora fruits [J]. RSC Ad-vances,2019(9) : 12291-12299.
[11]LIU H,GAN F,JIN S, et aL Acylphloroglucinol and tocotrienolderivatives from the fruits of Garcinia rnultiflora [J]. RSC Ad-vences,2017(7) :29295一29301.
[12]UI J Y, TAWANUN S, GABRIELLA M, et al. Bioactive poly-prenylated benzophenone derivatives from the fruits extracts ofGarcinia xanthochymus [J]. Bioorganic &. Medicinal ChemistryLetters , 2017 .27( 16) : 3760-3765.
[13] SRIYATEP T, MANEERAT W. SRIPISUT T, et al. Cow-abenzophenones A and B, two new tetracyclo[ 7. 3. 3. 33 , 11. 03 , 7]tetradecane - 2, 12. 14 - trione derivatives, from ripe fruits of Garcinia cowa [J]. Fitoterapia , 2014( 92) : 285 - 289.
作者简介:谭雪(1995-),女,中南民族大学药学院硕士研究生。
通讯作者:杨光忠(1968-),男,博士,教授,主要从事天然产物化学的研究工作。
