臭氧氧化降解水中吉非罗齐的效能和影响因素研究
2020-06-24刘士诚刘晓静宋俊学
刘士诚 刘晓静 宋俊学

摘要:指出了药品和个人护理品(PPCPs)在水环境中广泛存在,对人们的身体健康构成潜在威胁。以使用吉非罗齐作为目标污染物,考察了臭氧浓度、吉非罗齐初始浓度、溶液pH值和不同水体对臭氧氧化降解水中吉非罗齐的影响。实验结果表明:臭氧氧化技术可以高效降解水中的吉非罗齐,在中性或弱碱性环境,臭氧浓度0.5 mg/L,吉非罗齐浓度为300 μg/L的条件下可达到最佳的降解效果。
关键词:吉非罗齐;降解率;臭氧氧化
中图分类号:R123 文献标识码:A 文章编号:1674-9944( 2020) 2-0070-03
l 引言
近年来,人类对各类保健品、药品和个人护理品( PPCPs)的使用量越来越大。但是,由于传统的污水处理方法对于PPCPs的降解效果不佳,导致大量的PPCPs进入水环境[1],给人类的身体健康造成很大的威胁,因此PPCPs成为重点关注的新兴污染物之一[2]。吉非罗齐是一种典型的PPCPs,它是临床上广泛使用的血脂调节剂。它的辛醇一水分配系数可达4. 77,被认为有较大的生物毒性和生物蓄積性,对人体健康威胁较大[3]。最近研究显示,吉非罗齐在地表水中被广泛检出[4],受到研究人员的广泛关注。
臭氧(03)在室温下是一种具有特殊臭味的无色气体,它的氧化还原电位(Eo)高达2.07 V,对于一般的无机和有机物都具有很强的氧化能力,被广泛应用于水处理领域。目前普遍认为,水中的臭氧主要通过两种方式氧化水中有机物[5]。一是臭氧分子直接氧化,二是通过产生氧化能力更强的羟基自由基(Eo一2.8 V)间接氧化降解水中有机污染物。
在本研究中,使用臭氧氧化工艺降解水中的吉非罗齐,考察了不同条件对臭氧氧化降解吉非罗齐的影响,为水处理领域提供降解这类有机污染物的理论和实验依据。
2 材料与方法
2.1 实验试剂与仪器
试剂:氢氧化钠、盐酸、磷酸五水合硫代硫酸钠、靛蓝二磺酸钠(分析纯,国药集团化学试剂北京有限公司);吉非罗齐(分析纯,上海麦克林试剂有限公司);甲醇(HPLC级,上海阿拉丁生化试剂有限公司);实验中所用的去离子水由Milli-Q纯水制备机制备得到。
仪器:高效液相色谱(LC - 1260,Agilent,美国)、臭氧发生器(COM-AD-Ol,安思罗斯,中国)、pH计(PHS-3C,雷磁,中国);磁力搅拌器(85-1,金鼎,中国)。
2.2 分析方法
本实验中使用靛蓝二磺酸钠分光光度法测定水中的臭氧浓度[6]。水溶液中的吉非罗齐浓度采用高效液相色谱仪测定,色谱条件为:安捷伦ZORBAX SB- aqC-18反向色谱柱(2.1 mm×50 mm×1.8μm),色谱柱温度30℃,流动相条件:甲醇10. 1%甲酸水(60/40),流速:0. 35 mL/min,进样量:100 μL,检测波长:275 nm。
2.3 实验方法
臭氧氧化降解实验在1.2 L的平底烧瓶反应器中进行,水温控制在20℃左右。每次曝气时,固定氧气的输人流量为500 mL/min,固定臭氧发生器的输入功率为95%,通过调整曝气时间以调节水中的臭氧浓度。实验中如无特殊指明,臭氧浓度一般控制在0.5±0. 05mg/L,吉非罗齐的初始浓度为300±2 μg/L,pH值控制在7±0.2。具体步骤如下:首先取lL水加入到反应器中,待气流稳定后,打开臭氧发生器开关,一定时间后停止曝气。然后立即向反应器中加入一定量的催化剂和吉非罗齐母液,并开始磁力搅拌。开始计时,在特定的反应时间点(O min,3 min,5 min,10 min,20 min)取样20 ml_,取出的水样立即使用50 μL O.1 mol/L的硫代硫酸钠终止反应,然后用0. 22 μm滤膜过滤,最后使用液相色谱仪分析。
3 结果与讨论
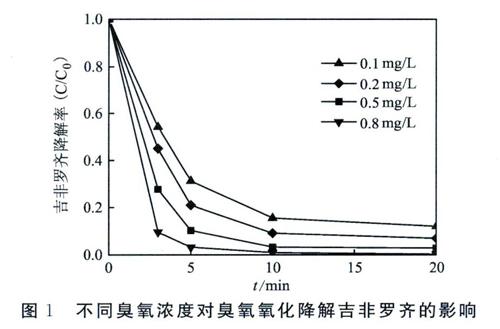
3.1 不同臭氧浓度对吉非罗齐降解率的影响
如图1所示,考察了不同臭氧浓度对吉非罗齐降解率的影响。结果显示,不同臭氧浓度对于吉非罗齐的降解有明显影响。随着初始臭氧浓度从0.1 mg/L提高到0.8 mg/L,在反应的前5 min吉非罗齐的降解率分别可达到68. 8%、79. 1%、89. 7%和96. 8%,而反应20min时降解率分别达到87. 9%、93. 1%、97. 2%和约100%。由此可知,臭氧对于吉非罗齐有较强的氧化能力,并且在反应的前5 min对吉非罗齐的降解速率较快,在5~20 min的降解速率相对较慢。这可能是因为在反应的前5 min,臭氧分子和羟基自由基等氧化剂的量比较充足,因此可以对吉非罗齐进行快速降解。在5~20 min时,溶液中的臭氧已被大量消耗,与此同时,反应产生的大量中间产物与吉非罗齐对臭氧发生竞争反应,导致对吉非罗齐的降解速率下降。综合考虑吉非罗齐的降解率和实际应用成本以及方便检测,选取降解吉非罗齐的最佳臭氧浓度为0.5 mg/L。
3.2 不同吉非罗齐浓度对吉非罗齐降解率的影响
如图2所示,考察了不同吉非罗齐浓度对吉非罗齐降解率的影响。结果显示,不同吉非罗齐浓度对于吉非罗齐的降解率呈现随着吉非罗齐浓度升高,先提高后降低的趋势。随着初始吉非罗齐浓度从100 μg/l-提高到500μg/L,在20 min时,吉非罗齐降解率由80. 3%提高到97. 2%,随后又降低到88%。这说明臭氧浓度与吉非罗齐浓度存在一个最佳配比值。因此,当臭氧浓度为0.5 mg/L时,对应的最佳吉非罗齐浓度为300 μg/L,并且将此浓度作为后续实验的初始浓度。
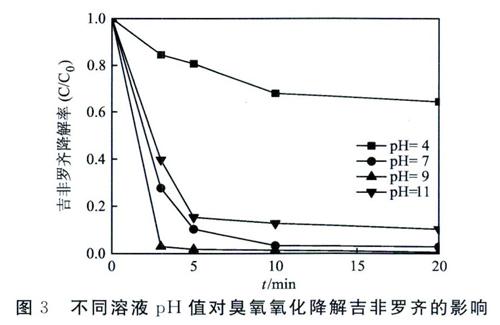
3.3 不同溶液pH值对吉非罗齐降解率的影响
随后考察了不同初始溶液pH值对吉非罗齐降解率的影响。研究表明,溶液初始pH值可以显著影响臭氧降解水中有机物的过程。一方面,溶液酸碱性可以影响水中有机物的解离状态。另一方面,还可以影响水中臭氧分子分解羟基自由基的过程。如图3所示,溶液pH值对吉非罗齐的降解又显著影响。在pH=4的酸性条件下,吉非罗齐的降解被显著抑制,20 min时的降解率仅达到36.6%。在此状态下,臭氧分子分解成羟基自由基的过程被显著抑制,反应体系中对吉非罗齐的降解主要通过臭氧分子的直接作用。当溶液pH值升高到7和9时,吉非罗齐的降解率分别达到了97. 2%和99. 5%。这主要是由于溶液中OH的促进作用,使得臭氧分子可以被快速分解为羟基自由基,提高了吉非罗齐的降解效能。当溶液pH值继续升高到11的强碱性状态下,吉非罗齐的降解率反而下降到89. 8%,这可能是由于.OH和H02-之间发生的猝灭作用[7],导致羟基自由基被消耗,降低了吉非罗齐的降解效能。由于在实际水处理中,水体多呈中性,因此臭氧对于处理实际水体中的吉非罗齐具有较强的降解效果。
3.4 不同水體对吉非罗齐降解率的影响
研究表明,水中溶解的有机物和无机物可以影响臭氧氧化降解水中有机物的效能[8]。如图4所示,考察了在湖水、自来水和去离子水中臭氧降解吉非罗齐的效能。当臭氧浓度为0.5 mg /L,吉非罗齐初始浓度为300 μg/L时,不同水体中臭氧氧化降解吉非罗齐的结果有明显的不同。在20 min时,湖水中吉非罗齐的降解率仅为71. 5%,而自来水中的降解率也降低到了85. 7%。这是由于湖水中成分最为复杂,通常含有大量的溶解性有机物和无机离子,这会干扰目标物的降解,导致降解率偏低。而自来水虽然成分相比于湖水比较单一,但也含有较多的无机离子。例如,由于水厂的氯消毒,通常会向自来水中引入大量的具有还原性的CI-离子,它会消耗臭氧降低吉非罗齐的降解效果。
4 结论
臭氧氧化降解水中吉非罗齐的反应过程受不同臭氧浓度、吉非罗齐初始浓度、溶液pH值和不同水体的影响。臭氧浓度越高对吉非罗齐的降解效果越好;臭氧浓度与吉非罗齐浓度存在一个最佳配比值,在一定范围内,吉非罗齐的浓度越高,降解效果越好;溶液pH值对水中吉非罗齐的降解影响较大,中性和弱碱性条件下有利于臭氧对吉非罗齐的降解,而酸性和强碱性环境条件下吉非罗齐降解率较低。臭氧在去离子水、自来水和湖水中降解吉非罗齐的效果也比较差,水体的成分越复杂,吉非罗齐的降解效果越差。
参考文献:
[1]Wang J,Wang S. Removal of pharmaceuticals and personal careproducts (PPCPs) from wastewater:A review [J]. Journal of Environmental Management, 2016( 182): 620- 640.
[2]Petrie B,Barden R,Kasprzyk- Hordern B.A review on emer-ging contaminants in wastewaters and the environment: Currentknowledge, understudied areas and recommendations for futuremonitoring [Jl. Water Research , 2015( 72) : 3- 27.
[3]Fang Y, Karnjanapiboonwong A, Chase D A, et al. Occurrence,fate, and persistence of gemfibrozil in water and soil [J]. Environ-mental Toxicology &- Chemistry, 2012, 31(3) :550-555.
[4] Lishman I_, Smyth S A, Sarafin K, et al. Occurrence and reduc-tions of pharmaceuticals and personal care products and estrogensby municipal wastewater treatment plants in Ontario , Canada [Jl.Science of the Total Environment, 2006 , 367(2) : 544- 558.
[5]Kasprzyk- Hordern B, Ziolek M, Nawrocki J. Catalytic ozona-tion and methods of enhancing molecular ozone reactions in watertreatment [J]. Applied Catalysis B: Environmental, 2003, 46 (4) : 639-669.
[6] Bader H , Hoigne J. Determination of ozone in water by the indigo method [J]. Water Research, 1981 , 15(4) :449-456.
[7]Xu Z, Xie M. Ben Y, et al. Efftciency and mechanism of atenololdecomposition in Co-FeO()H catalytic ozonation [J]. Journal ofHazardous Materials. 2019 ( 365) : 146- 154.
作者简介:刘士诚(1994-),男,硕士研究生,研究方向为给水处理技术。
