核型多角体病毒生活周期及宿主抗病毒反应的研究进展
2020-06-24况文东占智高王金昌关丽梅李江怀
况文东,占智高,王金昌,关丽梅,李江怀,靳 亮
(江西省科学院微生物研究所,330096,南昌)
0 引言
核型多角体病毒属于杆状病毒科 (Baculoviridae),绝大多数核型多角体病毒属于 alpha杆状病毒属 (Baculovirus),该病毒属可分为2组(group I、group II)(图 1)[1],是无脊椎动物的致病性病毒,广泛分布于环境中[2]。核型多角体病毒是一类有囊膜的病毒,基因组为双链环状 DNA 病毒,大小为80~180 kb,大多数NPV的包涵体(occlusion body, OB)大约0.6~3 μm[2]。核型多角体病毒的主要宿主为鳞翅目昆虫幼虫,随着日龄增大而抵抗力增强。此外,少数NPV也感染双翅目和膜翅目昆虫幼虫。

图1 杆状病毒进化树分析,基于37个杆状病毒核心基因的氨基酸序列
在核型多角体病毒感染周期中,产生2种不同表型的子代病毒,芽生型病毒(budded virion,BV)和包涵体来源的病毒(occlusion-derived virion,ODV)(图2)。BV和ODV基因组相同,但是核衣壳以及囊膜有所不同。BV可导致昆虫组织间(气管上皮、血细胞、中肠上皮、脂肪体等)病毒的传播,昆虫间的传播主要通过未感染昆虫食用被ODV污染的食物所致[3]。BV病毒在细胞培养中早在12~18 hpi就大量产生[4]。在感染后期,许多核衣壳被保留在核内,随后被核膜衍生膜包裹[5]。这些新包被的ODV病毒在细胞核被包裹在多角体蛋白中,并结晶形成包涵体(Occlusion Bodies,OB)。每个苜蓿银纹夜蛾核型多角体病毒(Autographacalifornicamulticapsid nucleopolyhedrovirus,AcMNPV)ODV病毒通常含有多个(约5~25)核衣壳[6]。因此,一个 AcMNPV OB 可能携带数百个核衣壳。在昆虫感染后期,细胞溶解后,昆虫尸体发生液化,被感染的细胞释放出OBs。昆虫尸体液化是一个至少由2种病毒编码的酶(几丁质酶和组织蛋白酶)介导的过程,该酶催化昆虫外骨骼的分解和OBs释放到环境中[7-8],被昆虫食用后,开始一个新的感染循环。在利用昆虫细胞培养时,BV和ODV都可以产生,但由于ODV病毒在细胞系中的感染能力有限,所以细胞间的感染是由BV病毒引起的[9]。目前还没有合适的模拟体内中肠细胞感染的培养系统,因此ODV的感染实验通常是在昆虫体内进行的[10]。
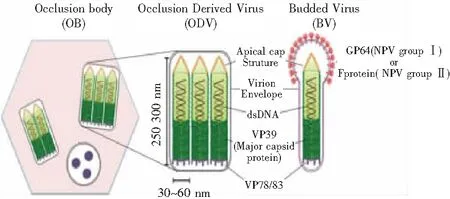
图2 NPV包涵体(OB)、包涵体病毒(ODV)和芽生型(BV)结构示意图
ODV嵌入蛋白质晶体基质中形成OB;ODV和BV包膜及其核衣壳含有许多蛋白质。主要核衣壳蛋白VP39构成核衣壳,存在于整个核衣壳中。VP78/83位于核衣壳的一端。融合蛋白GP64(NPV I组)或F蛋白(NPV II组)在整个BV包膜中都有发现,但在一端(可能是锥形端)可发生聚集[11]。
NPV在农业和林业生产中,主要用作生物杀虫剂,在国内作为生物农药登记的数量有64种,分别是:甜菜夜蛾核型多角体病毒(10种)、斜纹夜蛾核型多角体病毒(12种)、棉铃虫核型多角体病毒(29种)、甘蓝夜蛾核型多角体病毒(6种)、苜蓿银纹夜蛾核型多角体病毒(7种);在基因工程研究中,NPV还可以作为蛋白表达载体(Bacmid 系统),可以有效地表达干扰素、抗原等外源蛋白[12]。此外,NPV还有一个非常重要的特性:它可以将外源基因转导到哺乳动物细胞中,但本身并不复制[13-16]。这使得NPV在基因治疗及哺乳动物细胞表达系统的构建中具有重要的应用前景。但在实际应用过程中,还存在许多的问题,比如:绝大多数NPV病毒的宿主谱比较窄,拓宽NPV的宿主谱可以使NPV成为更加有效的生物杀虫剂;此外,NPV感染哺乳动物细胞的转导效率有待进一步的提高。这些问题的解决都有赖于对NPV生物学特性的详细了解,比如:细胞(吸附和)入侵等生活周期的详细机制。本文对NPV生活周期(入胞、入核、复制、表达、组装和出芽)的不同阶段逐一进行讨论,并介绍宿主抗病毒反应的最新研究进展;最后,提出一些在未来的研究过程中需要解决的一些问题。
1 核型多角体病毒的生活周期
1.1 侵入细胞过程
1.1.1 ODV入侵 ODV病毒特异性结合昆虫中肠上皮细胞,多角体蛋白是ODV在环境中(紫外,干燥)保持稳定的主要原因。OB的表面覆盖一层由碳水化合物和蛋白质组成的外层,OB在昆虫中肠碱性环境中发生降解释放ODV,OB中含有一种金属蛋白酶VEF,它可以破坏昆虫肠道周围营养基质形成的生理屏障并提高感染效率[17-18]。ODV病毒通过直接与微绒毛膜融合进入中肠上皮细胞[19-20]。ODV包膜含有至少13种完整的膜蛋白。其中9个膜蛋白与病毒入胞有关,这些蛋白统称为经口感染因子(perosinfectivity factor, PIF)。目前认为,病毒的PIF参与ODV与中肠微绒毛膜结合和融合。第一个发现对口腔感染和可能的受体相互作用重要的ODV包膜蛋白是 p74 (ac138),PIF 的缺失会导致病毒无法经口感染,但是不影响ODV病毒的装配或将ODV病毒组装成OB,且不影响BV的产生或传染性,多种PIF蛋白可以形成稳定的复合物,并具有蛋白酶抗性,使其在富含蛋白酶的肠道环境中发挥作用[21-25]。但是关于PIF蛋白介导病毒侵入宿主细胞的具体机制还有待进一步的研究。
1.1.2 BV入侵 BV和ODV囊膜脂质体成分差异非常大,这提示这2种类型病毒获得囊膜和入胞途径有所不同。ODV侵入中肠上皮细胞以后,出芽产生BV病毒,进入昆虫的血淋巴循环,感染其它细胞。不同的NPV BV可以通过网格蛋白介导的内吞作用(clathrin-mediated endocytosis (CME))、膜融合(direct membrane fusion (DMF))、胞饮作用中的一种或者多种方法入胞[26]。AcMNPV主要通过网格蛋白介导的内吞作用感染昆虫,在这个过程中肌动蛋白介导病毒内化,微管负责包裹病毒早期内体的移动[12]。在感染过程中还有少部分(约10%)AcMNPV的囊膜可以直接和细胞质膜融合,而后侵入细胞[27]。家蚕核型多角体病毒(Bombyxmorinucleopolyhedrovirus, BmNPV)BV病毒进入细胞质后,在内体的病毒可能通过内体分选复合物(the endosomal sorting complex required for Transport,ESCRT)[28]和N-乙基马来酰亚胺敏感因子蛋白(N-ethylmaleimide sensitive factor protein,NSF)[29],进一步深入细胞质中,随后包含病毒的内体发生酸化,内吞的病毒囊膜和细胞膜发生融合,释放核衣壳至细胞质中[30]。细胞OB的包膜与ODV的包膜有所不同,BV特异性包膜糖蛋白是GP64或F蛋白。GP64是病毒进入细胞的必要条件[31],另外2种BV包膜蛋白(ODV-e25(Ac94)和ODV-e18(Ac143))对BV的感染性也非常重要[32]。GP64是一种III类病毒膜融合蛋白,在NPV中高度保守,只存在于alpha杆状病毒group I中(AcMNPV、CfMNPV和OpMNPV)。GP64通过二硫键形成三聚体,与宿主细的胞磷脂双分子层细胞膜相互作用,介导病毒入胞。其他的BV包膜蛋白(F样蛋白、v-ubi、gp37和BV/ODV-e26)可能影响BV的产生水平,但对于BV的感染性不是必须的。F蛋白主要发现于alpha杆状病毒group II NPV (SEMNPV、HzSNPV和 LdMNPV),它的功能与GP64类似,但在结构上有显著差异。在group I中也发现F蛋白编码基因,但通常认为它不再作为这些病毒的融合蛋白发挥作用。在AcMNPV中敲除AcMNPV F-like蛋白基因 (ac23)对BV的产生或BV的感染性存在争议[33-34],但会影响ODV的包涵体形成和致病性[35]。在group II NPV中,F基因敲除会导致病毒感染性的丧失。BV入胞需要GP64和F蛋白,但是它们结合的受体还是未知的。有一部分研究证明BV的入胞过程不需要蛋白质受体,因为研究发现 NPV 可以结合不含蛋白质的脂质体[2]。
1.2 入核过程
NPV 核衣壳在肌动蛋白的帮助下到达核孔,与核孔复合物发生相互作用,并通过核孔。BmNPV核衣壳从内体释放后,核衣壳结构蛋白P78/83 (Ac9)在BV/ODV-c42 (orf101; c42)的介导下入核,募集细胞Arp2/3,促进肌动蛋白聚合,随后肌动蛋白细胞骨架发生变化,推动核衣壳[36-37]。Fang的工作提示病毒蛋白Ac132的NEBU结构域可稳定F-肌动蛋白,这可能附着在核衣壳上,然后将核衣壳推入细胞核[3]。此外,研究表明宿主蛋白importin-β也参与了该过程。ODV中多个核衣壳释放到细胞质中以后,在肌动蛋白引导下,将核衣壳运输到细胞核附近[38]。ODV和BV核壳体与核孔复合物 (NPC) 的相互作用及穿过核孔的过程类似[11, 39]。ODV进入细胞的多个核衣壳,一部分还可以快速中肠上皮细胞的基底膜,与GP64组装形成BV,进入血腔,感染其它细胞。这一过程显著缩短了BV的产生时间,提高了病毒感染效率[40]。NPV是研究大分子入核的理想模型,对该过程的解析将有助于了解NPC的转运机制,同时对于NPV的防治及作为杀虫剂的利用都将奠定重要的理论基础[41]。
1.3 病毒基因组复制、转录和翻译过程
病毒DNA入细胞核后,病毒复制开始于细胞核中心附近形成病毒性基质。这是病毒DNA的转录、复制以及核衣壳装配的位点。NPV基因表达主要受转录水平的调控,转录过程可以分为:早期、晚期和极晚期转录。每个阶段基因复制和表达依赖于前一阶段基因的表达,早期基因拥有能被宿主RNA聚合酶II识别的启动子功能序列,其表达产物(RNA聚合酶)参与或调控病毒基因的复制和晚期基因的表达[42]。早期基因的表达对于病毒DNA复制和晚期基因的表达是必须的,而晚期基因主要表达病毒结构蛋白[43]。DNA复制后期(感染后6-18 h),核衣壳开始组装。NPV单链DNA结合蛋白LEF-3含有一个介导其核输入的NLS,在该过程中,LEF-3可以促进蛋白p143入核,使p143发挥解螺旋作用促进DNA复制。AcMNPV DNA聚合酶在病毒DNA复制过程中发挥非常关键的作用,其N端(氨基酸位点1-186)motif在杆状病毒科中非常保守,对于DNA聚合酶发挥功能是必须的[44]。包膜蛋白BV/ODV-e26的缺失可以导致DNA复制水平的降低[45]。
NPV的DNA结合蛋白DBP对于病毒基因转录也非常重要[46]。研究发现orf61缺失使病毒早期基因lef-3、晚期基因vp39及极晚期基因p10的转录水平显著下降[47]。Fang等发现,AcMNPVac124缺失会导致病毒几丁质酶转录水平的显著降低[48]。在体外翻译系统证明,极晚期基因p10 5′UTR对于翻译起始非常关键。利用帽类似物不抑制p10 5′UTR驱动的翻译,表明极晚期的NPV mRNA以不依赖帽的方式翻译[49]。此外,Ranjan等对AcMNPV mRNA起始翻译的序列进行分析,发现该病毒mRNA翻译起始位点附近的序列为 aag/ta/tat/aa/cAAaATGaa/ct/ag/aAan,同经典的Kozak (GCC)GCCA/GCCATGG差异非常大[50]。
1.4 病毒组装和出芽过程
1.4.1 ODV组装和出芽过程 NPV 基因组入核后,在核中进行DNA复制和表达,核衣壳在细胞核的病毒发生基质中进行组装,然后转运到核周边的电子发光区,转运过程需要核肌动蛋白和核衣壳蛋白 AC102、VP80 (Ac104)、P78/83 (Ac9)、VP1054 (Ac54)和BV/ODV-C42 (Ac101)的参与[51-53]。在该区核衣壳组装成BV或者ODV,具体的机制未知。据估计,97%的基因组DNA组装成ODV或者保留在细胞核,另一部分DNA则出芽后形成BV。AcMNPVac83基因上的顺式作用原件对核衣壳组装至关重要[25]。ODV在病毒蛋白Ac76、Ac75和Ac93等的介导下披上内核膜或者外核膜[5, 54],而后运送到核中指定位置,在多角体蛋白的包装下,形成包涵体。病毒蛋白质Ac76、Ac75和Ac93也是核衣壳从核中穿梭至细胞质中最终形成BV所必需的。ODV中核衣壳的数量受到病毒基因型及宿主细胞类型的影响。ODV与多角体蛋白结合后,随后在病毒周围结晶[2]。NPV的OB大小及ODV数量是受病毒种类影响的。成熟的OB外层由碳水化合物和Ac131组成,最外层的形成,有赖于功能性p10蛋白和细胞核纤维结构。如果Ac131或者p10缺失,将导致OB失去最外层结构,OB会变得不规则,且易碎[55-56]。从AcMNPV基因组中敲除GP41 (ac80),病毒不再形成BV并且不再组装ODV,这表明该基因在杆状病毒病毒体形态发生中也发挥重要作用[57]。关于包涵体的形成过程,还有很多未解之谜:1)ODV的数量受什么调控;2)多角体蛋白结晶的触发机制;3)结晶过程的调控机制。这些问题的解决使我们对NPV的生活周期有更加深刻的了解,同时丰富的病毒学领域关于病毒生活周期的理解,也为NPV的防治及利用提供大量理论基础。
1.4.2 BV组装和出芽过程 在核中组装的核衣壳,大部分组装成ODV,少部分出核形成BV。尽管核衣壳选择性形成ODV或BV的具体机制不详,但是推测可能与ODV和BV核衣壳上特异性的蛋白质有关。研究表明NPV核心基因38K(Aac98)编码的卤酸脱卤素酶同源物通过介导P6.9 (Ac100) 的C末端的5个特定位点的去磷酸化参与核衣壳装配[58]。研究表明,BV核衣壳的泛素化水平高于ODV的核衣壳,推测,泛素化是一个出核信号。泛素化位点可能主要存在于Ac66蛋白中。缺失Ac66和病毒的E3泛素连接酶Ac141,病毒无法出核。orf61基因敲除后将会导致病毒核衣壳不能从细胞核转运到细胞质中,导致病毒粒子(BV)不能装配[47]。Li等报道Hsp90可以通过促进核肌动蛋白聚合来帮助BV从细胞核穿梭到细胞质中[59]。AcMNPV BV 核衣壳蛋白Ac51缺失不会中断核衣壳组装和包涵体来源的病毒 (ODV) 形成,但是会阻碍核衣壳的出核,导致转染细胞上清液中的BV产生显着降低[60]。透射电镜的观察结果显示,BV离开细胞核主要是通过出芽方式。BV出芽获得双层核膜后,进入细胞质以后,BV核衣壳脱去核膜,在肌动蛋白的推动下,向质膜方向移动。通过ESCRT途径[28],BV到达出芽位点,病毒囊膜蛋白GP64和ME53 (Ac140)等蛋白的作用下发生出芽,出芽后,游离的BV可以进行下一轮细胞感染。
2 宿主抗病毒反应
昆虫对NPV的免疫反应可分为2个阶段:一是消化道对ODV的防御;二是脂肪体、气管和血细胞等其他组织对BV的防御。在感染初期,家蚕中肠内合成抗病毒蛋白脂肪酶 Bmlipase-1,并分泌到肠道液中,抑制BMNPV复制,具体机制尚不清楚[61]。在昆虫,RNAi 通路通常被认为是一种抗病毒天然免疫。在转基因RNAi家蚕中表达病毒基因dsRNA可以抑制BmNPV的复制[62]。Ponnuvel等报道AcMNPV可以通过降低Sf9细胞内丰富的miRNAs 促进自身的复制,并推测该过程是通过下调宿主蛋白Ran介导的[63]。此外,过表达家蚕 miRNA bmo-miR-2819可以下调BmNPV IE-1水平从而抑制病毒感染,病毒感染后可以通过未知机制下调以bmo-miR-2819,从而拮抗宿主的抗病毒反应[64]。家蚕磷酸烯醇丙酮酸羧激酶通过增加ATGs表达来抑制BmNPV的增殖,BmNPV拮抗这条抗病毒的机制尚不明确[65]。BmNPV感染后可以导致cGAMP水平的上升,促进干扰素基因刺激因子(STING)介导的 NF-κB活性的增强,促进抗病毒基因的表达[66]。Liu等用脂多糖、肽聚糖、葡聚糖和NPV刺激家蚕,发现中肠和脂肪体中小休克蛋白sHSP21 mRNA水平明显上升,提示该蛋白可能参与家蚕抗病毒天然免疫[67]。最近日本科研人员发现,在中国家蚕中发现肿瘤抑制基因p53 的同源基因Bm-p53,并且发现该基因可以通过促进家蚕的凋亡而参与抗NPV过程中[68]。家蚕ser/thr蛋白磷酸酶2A (PP2A)被报道具有抗BmNPV的活性[69]。受体酪氨酸激酶 (RTK) 拮抗蛋白Spry可以负调控ERK信号通路,Guo等发现家蚕中Spry也具有抗病毒活性,BmNPV 感染家蚕后,会导致BmSpry表达水平下降p-ERK水平上升,从而拮抗该蛋白的抗病毒活性[70]。此外,JAK/STAT信号通路对于果蝇的抗病毒反应也是非常重要的,BmNPV感染家蚕后可以引起该信号通路的激活,具体的抗病毒机制还有待进一步的研究[71-72]。
上述抗病毒研究为家蚕抗病毒药物的研发提供潜在靶点。Li等用NPC1拮抗剂(丙咪嗪或U18666A)预处理家蚕胚胎细胞,可以显著下调家蚕细胞NPC1的表达,可以有效阻止病毒进入细胞[73]。以PI3K-Akt为靶点的商业化合物,并选择以下7种口服药物进行进一步分析:afuresertib、AZD8835、AMG319、HS173、AS605240、GDC0941和BEZ235。这些候选药物可以有效抑制BmNPV在BmE细胞中病毒基因的表达。其中,AMG319和AZD8835能有效抑制病毒在家蚕幼虫中的复制,提示这2种药物在家蚕的抗病毒反应中具有一定的应用潜力[74]。
3 结束语
近几年随着分子生物学技术的发展和高通量分析技术手段的不断涌现,人们对于NPV与宿主的相互作用有了更深、更广的认识,使得人们在NPV的病毒学研究、免疫学研究、细胞生物学研究等领域取得了丰硕的成果。为了更好地防治和利用NPV,围绕该病毒的生活周期,仍需对以下几个方面进行更加深入的研究:1)NPV 配体及细胞受体的鉴定;2)NPV DNA包装成ODV或BV的分选机制;3)NPV在胞质中的病毒蛋白是如何返回细胞核组装成病毒粒子的;4)建立模拟ODV感染中肠组织的体外培养系统;5)与普通病毒相比,NPV作为一个大的病毒粒子是如何逃避宿主的免疫系统的。在这些研究的基础上,可以开发新的NPV治疗药物,丰富人们关于病毒宿主和组织嗜性、病毒组装以及病毒与宿主免疫相互作用的认识。
