注射用还原型谷胱甘肽钠的过敏性试验研究
2020-06-24张文涛朱立欣
马 会,高 梅,李 雪,张文涛,朱立欣
(山东省药学科学院 山东省化学药物重点实验室,山东 济南 250101)
还原型谷胱甘肽是人类细胞能自然合成的一种三肽,由谷氨酸、甘氨酸、半胱氨酸组成,含丰富的巯基,可激活多种酶,促进糖、蛋白质和脂肪的代谢,影响细胞整个代谢过程[1]。注射用还原型谷胱甘肽钠主要通过巯基与体内的自由基结合,将其转化为容易代谢的酸类物质从而加速排泄,临床主要用于治疗肝脏疾病、放射治疗患者、化疗患者、急性胰腺炎、慢性阻塞性肺疾病及中毒等症状[2-5]。在临床使用过程中,还原型谷胱甘肽可能会作为抗原,诱发机体产生过敏反应,常见症状包括皮疹、恶心、呕吐、血压下降、脉搏异常等[6]。
根据《药物刺激性、过敏性和溶血性研究技术指导原则》[7]要求,局部给药发挥全身作用的注射剂需考察Ⅰ型过敏反应,考察方法包括主动全身过敏试验(ASA)和被动皮肤过敏试验(PCA)。本研究按照指导原则的要求对注射用还原型谷胱甘肽钠进行了豚鼠ASA试验和大鼠PCA试验,评价其Ⅰ型过敏反应情况。
1 仪器与材料
1.1 仪器
UW2200H电子天平(日本岛津);JW-1032离心机(安徽嘉文);CO2麻醉箱(北京美绿洲);HFsafe-1200生物安全柜(上海力申);AY220电子天平(日本岛津公司)。
1.2 试剂
注射用还原型谷胱甘肽钠(批号180401,由山东省药学科学院提供);牛血清白蛋白(批号829L054,Solarbio);0.9 %氯化钠注射液(批号3218052304,青州尧王制药有限公司);弗氏完全佐剂(批号SLBR3877V,Sigma);伊文思蓝(批号161222,上海蓝季);戊巴比妥钠(批号M20180705152530,Merck)。
1.3 实验动物
SPF级Hartley豚鼠,由青岛康大生物科技有限公司提供,体重300~400 g,实验动物生产许可证号SCXK(鲁)2016 0002;SPF级SD大鼠,由北京维通利华实验动物技术有限公司提供,体重150~250 g,实验动物生产许可证号SCXK(京)2016-0006。动物饲养于SPF级饲养室,实验动物使用许可证号:SYXK(鲁)2018 0031,饲养室温度20~26 ℃,湿度40 %~70 %,昼夜明暗交替时间12 h/12 h。
2 方法[7]
2.1 豚鼠ASA试验
2.1.1 实验动物分组 选取24只健康Hartley豚鼠,随机分为4组,分别为阴性对照组、注射用还原型谷胱甘肽钠低、高剂量组、阳性对照组,每组6只,雌雄各半。
2.1.2 致敏与激发 阴性对照组给予0.9 %氯化钠注射液,低剂量组和高剂量组分别给予注射用谷胱甘肽钠(180,360 mg/ml),阳性对照组给予牛血清白蛋白(20 mg/ml),致敏途径为腹腔注射,给药体积为0.5 ml/只,隔日1次,共致敏3次,于末次致敏后第14天分别取3只动物(2雌1雄)快速静脉注射激发,第21天取剩余3只动物激发。激发时足跖静脉注射2倍致敏剂量的抗原。
2.1.3 判断标准 激发给药后即刻至3 h详细观察并记录每只豚鼠的反应,按照表1判断过敏反应发生程度,计算过敏反应率(每组发生过敏反应的动物数/该组动物总数),根据过敏反应发生率和发生程度综合评价过敏反应情况。

表1 全身过敏反应评价标准
2.2 大鼠PCA试验
2.2.1 抗体血清制备 选取16只健康SD大鼠,随机分为阴性对照组、注射用还原型谷胱甘肽钠低、高剂量组、阳性对照组,每组4只,雌雄各半。阴性对照组给予0.9 %氯化钠注射液,低剂量组和高剂量组分别给予注射用还原型谷胱甘肽钠溶液(100,200 mg/ml),阳性对照组给予牛血清白蛋白(20 mg/ml)。致敏时,各组均皮下注射相应抗原与弗氏完全佐剂等体积混合液1 ml,隔日1次,共致敏3次。末次致敏后第10天,采用戊巴比妥钠麻醉动物后腹主动脉取血,2000 r/min离心10 min,分离抗体血清。
2.2.2 大鼠同种PCA试验 另取24只健康SD大鼠,按抗体血清制备阶段的组别随机分组,每组6只,雌雄各半。将动物背部脱毛,距离中线两侧1.5 cm处选择4个注射点,分别皮内注射不同稀释度(原液,1:2,1:4,1:8)的抗体血清0.1 ml,24 h后尾静脉注射与致敏剂量相同的激发抗原与等体积的0.5 %伊文思蓝混合液1 ml,激发给药后约30 min测量皮肤内侧的蓝斑直径,大于5 mm时为阳性。
2.3 数据统计
3 结果
3.1 豚鼠ASA试验结果
3.1.1 一般状态观察 致敏期间,阴性对照组、低剂量组和阳性对照组动物未见异常。高剂量组动物在首次、第二次致敏后未见异常,末次致敏后即刻出现不安宁、跳跃症状,约2 min恢复正常。
3.1.2 体重 激发时,注射用还原型谷胱甘肽钠高剂量组豚鼠体重明显低于同期阴性对照组(P<0.05),其余各组与阴性对照组比较差异无统计学意义(P>0.05)。结果见表2。
3.1.3 过敏评价结果 激发给药后3 h内观察,阴性对照组、注射用还原型谷胱甘肽钠低、高剂量组均未见过敏反应症状,过敏反应阴性。阳性对照组均出现搔鼻、步态不稳、呼吸困难、排尿、死亡等全身过敏反应症状,过敏反应为强阳性,阳性发生率100 %。结果见表3。
3.2 大鼠PCA试验结果
3.2.1 一般状态观察 致敏期间观察,注射用还原型谷胱甘肽钠低、高剂量组、阳性对照组和阴性对照组所有动物一般状况良好,自主活动正常,体重增长正常,未见其他异常反应。
3.2.2 体重 注射用还原型谷胱甘肽钠低、高剂量组、阳性对照组动物体重与阴性对照组比较,差异无统计学意义。结果见表4。
3.2.3 过敏评价结果 阴性对照组、注射用还原型谷胱甘肽钠低、高剂量组动物注射部位各稀释度下均未出现蓝斑,过敏反应阴性。阳性对照组6只动物均出现蓝斑,抗体血清原液和1:2,1:4,1:8抗体血清的蓝斑平均直径大于5 mm,阳性反应率100 %。结果见表5。
表2 注射用还原型谷胱甘肽钠对豚鼠体重的影响( ±s,n=6)
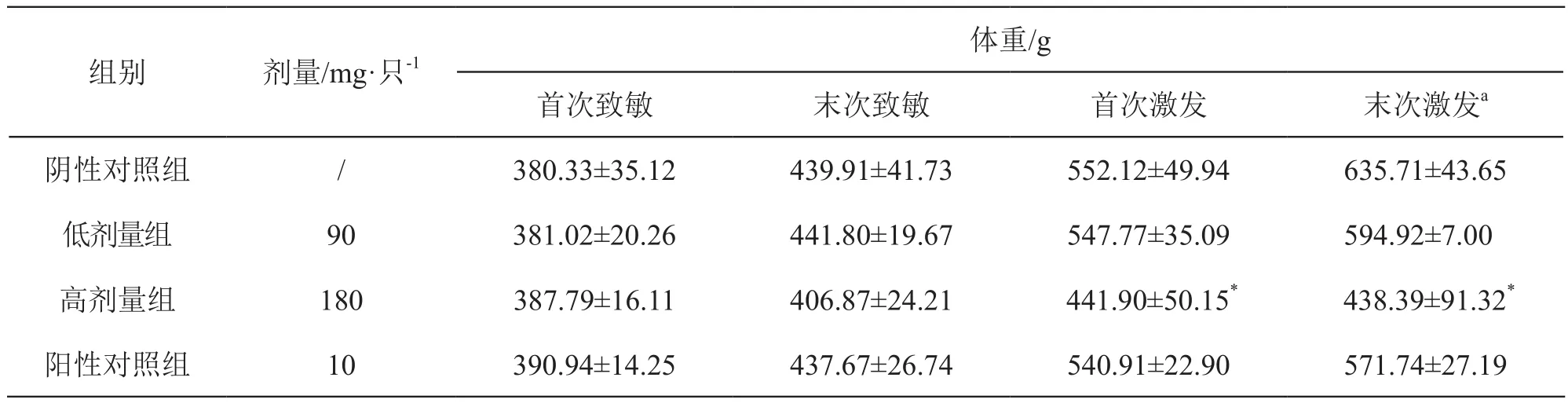
表2 注射用还原型谷胱甘肽钠对豚鼠体重的影响( ±s,n=6)
注:*P<0.05 vs 阴性对照组;a动物数为3只
体重/g首次致敏 末次致敏 首次激发 末次激发a阴性对照组 / 380.33±35.12 439.91±41.73 552.12±49.94 635.71±43.65低剂量组 90 381.02±20.26 441.80±19.67 547.77±35.09 594.92±7.00高剂量组 180 387.79±16.11 406.87±24.21 441.90±50.15* 438.39±91.32*阳性对照组 10 390.94±14.25 437.67±26.74 540.91±22.90 571.74±27.19组别 剂量/mg·只-1

表3 全身过敏试验观察结果(n=6)
表4 注射用还原型谷胱甘肽钠对大鼠体重的影响( ±s)

表4 注射用还原型谷胱甘肽钠对大鼠体重的影响( ±s)
注:a动物数为4只,b动物数为6只
测量时间首次致敏a 末次致敏a 抗血清制备a 被动激发b阴性对照组 / 163.42±9.48 191.07±13.25 251.95±37.91 254.05±66.50低剂量组 50 161.51±7.32 181.92±13.99 238.66±42.85 254.63±58.08高剂量组 100 161.43±8.83 185.04±18.88 253.77±51.03 255.10 ±54.70阳性对照组 10 160.99±9.56 185.09±18.26 254.94±42.61 247.64 ±61.36组别 剂量/mg·只-1

表5 过敏性评价结果
4 讨论
过敏反应根据作用机制分为Ⅰ、Ⅱ、Ⅲ、Ⅳ 4类,其中Ⅰ型过敏反应是最常见、研究最多的一类,临床表现为过敏性休克、胃肠道及皮肤过敏反应等[8]。Ⅰ型过敏反应又称为速发型过敏反应,当药物作为抗原初次进入体内会引起免疫应答,产生抗体,致敏肥大细胞,而致敏的肥大细胞再次接触相同抗原时会释放组胺等活性介质,引发多种病理性免疫反应[9-10]。
注射用还原型谷胱甘肽导致的过敏反应相对较少,但也有文献报道过敏反应的发生[6,11],主要表现为皮疹、荨麻疹、瘙痒等皮肤过敏症状,脸上苍白、血压下降、脉搏异常等类过敏症状,恶心、呕吐、食欲不振等消化系统症状,甚至是过敏性休克等严重过敏反应。
本研究结果显示,在豚鼠ASA试验末次致敏时,注射用还原型谷胱甘肽钠高剂量组动物出现不安宁、跳跃等异常反应。为进一步研究这些异常反应是否与药物过敏反应有关,另取4只健康豚鼠直接静脉注射高剂量药物制剂,动物均未见异常,推断致敏期间出现的异常症状非药物过敏反应引起。但对于这些异常症状产生原因是否与药物毒性(高剂量约为人临床剂量的11.25倍,低剂量约为人临床剂量的5.6倍)或给药方式(动物致敏期间采用腹腔注射,药物临床给药途径为静脉注射、肌肉注射)有关需进一步讨论研究。激发时,注射用还原型谷胱甘肽钠低、高剂量动物静脉快速注射两倍抗原后未引起全身主动过敏反应症状,ASA试验结果为阴性。在大鼠PCA试验中,试验佐剂选择弗氏完全佐剂,致敏过程中做到与药物充分混匀至油包水状态,阳性对照组得到了理想的试验结果,阳性率达到100 %,试验结果与文献[12]报道一致。注射用还原型谷胱甘肽钠低、高剂量组未见蓝斑,结果为阴性。
综上,由豚鼠主ASA试验和大鼠PSA试验结果可知,注射用还原型谷胱甘肽钠未引起过敏反应,安全性良好,符合注射剂安全性要求。
