中华蜜蜂AcerOr2基因昆虫表达载体pIB/V5-His的构建
2020-06-24郭丽娜赵慧婷任有蛇姜玉锁
郭丽娜,赵慧婷,任有蛇,徐 兵,姜玉锁,*
(1.山西农业大学 动物科技学院,山西 太谷 030801; 2.山西农业大学 生命科学院,山西 太谷 030801; 3.山西农业大学 工学院,山西 太谷 030801)
昆虫气味受体(olfactor receptors,Ors)可识别气味分子并将胞外化学信号转换为电信号,导致嗅觉神经元(olfactory receptor neurons,ORNs)产生动作电位。在昆虫体内,气味受体主要位于嗅觉神经元树突上[1],参与了嗅觉信号识别的初始过程。每个嗅觉神经元表达2类气味受体:高度保守的共受体Orco和传统的气味受体[2-3]。传统气味受体在不同昆虫间差异较大,可分为性信息素受体和普通受体[4-5]。而Orco在不同昆虫间则高度保守[6-7],其不可以识别气味分子,但能帮助传统气味受体在树突膜上的折叠和正确定位。蜜蜂气味受体的研究,最早见于意大利蜜蜂(Apismellifera)AmelR2[8],它与果蝇Or83b和冈比亚按蚊AgOr7同源,在触角毛型感器和板形感器中表达。随后,在意大利蜜蜂(Apismellifera)中鉴定出177个Ors[9],东方蜜蜂(Apiscerana)全基因组测序鉴定出119个Ors[10-11]。与其他昆虫相比,蜜蜂的气味受体基因数量较多,这与蜜蜂群体内化学通讯及蜜蜂和花之间的化学通讯存在着密切的关系[12]。蜜蜂的气味受体在其亲属辨认、采集食物、工蜂监督和防御等行为上起着重要的作用[13],但是与果蝇和蚊子等其他昆虫相比,有关蜜蜂Ors功能的研究很少。
本课题组在中华蜜蜂中克隆并鉴定出一个共受体基因AcerOr2和一个传统的气味受体AcerOr1,发现AcerOr2在工蜂触角发育的各个阶段都有表达[14],这与意大利蜜蜂共受体AmelOr2有类似的表达谱[15]。这些结果表明,AcerOr2可能参与了性别和分工嗅觉感知过程。因此,寻找AcerOr2受体的配体及相关信号通路成为非常有意义的研究方向。本研究将中华蜜蜂气味受体基因AcerOr2与昆虫细胞表达载体pIB/V5-His重组,导入草地夜蛾Sf9细胞,并通过Western blot和免疫荧光检测AcerOr2在Sf9细胞中的表达及定位,以期为下一步利用体外异源表达的细胞对其功能进行分析验证。
1 材料与方法
1.1 实验材料
1.1.1 供试细胞、载体和质粒
草地夜蛾卵巢细胞(Spodopterafrugiperdacell)Sf9购自中国典型培养物保藏中心(CCTCC);感受态细胞Top 10购自北京鼎国生物技术发展中心;昆虫表达载体pIB/V5-His购自北京华越洋生物。
1.1.2 主要试剂
无内毒素(EndoFree)质粒中提、小提试剂盒,凝胶回收试剂盒(Gel Extraction Kit)购自康为世纪;Anti-His抗体购自BioWorld;稻瘟菌素(Blasticidine)Solarbio、Cellfectin®Ⅱ Reagent购自美国英杰生命技术有限公司(Invitrogen);Sf900 Ⅲ SFM培养基和FBS胎牛血清购自Gibco;青链霉素双抗、DMSO购自Boster;山羊抗兔Alexa Fluor®594、Fluo4-AM、DAPI购自上海碧云天生物技术有限公司;一步法昆虫细胞活性蛋白提取试剂盒购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 亚细胞定位预测
利用在线网站http://linux1.softberry.com/all.htm对AcerOr2蛋白结构亚细胞定位进行预测。
1.2.2AcerOr2基因的克隆
根据NCBI中AcerOr2(JN 792581)序列设计并扩增CDS区,插入到pIB/V5-His质粒载体的BamHⅠ和EcoRⅠ位点,用Primer Primer 6.0设计含有酶切位点BamHⅠ和EcoRⅠ保护碱基的中华蜜蜂嗅觉受体基因AcerOr2的下游引物,引物序列如下:AcerOr2_F,5′-CGCGGATCCATGATGAAGTTCAAGCAACAGGG-3′;AcerOr2_R,5′- CCGGAATTCCTTCAGTTGCACCAACACCA-3′。PCR反应条件:94℃ 4min;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃ 7 min。
1.2.3AcerOr2重组质粒的构建
通过限制性内切酶BamHⅠ和EcoRⅠ进行双酶切,试剂盒回收pIB/V5-His载体及PCR目的片段,经T4 DNA连接酶4℃过夜连接,连接产物转化感受态细胞JM109,铺Amp+平板后经过夜培养,挑取10个单菌落,振荡过夜培养12~16 h后提取质粒DNA,酶切鉴定及测序鉴定,鉴定成功的质粒命名为pIB/V5-His-AcerOr2。
1.2.4 重组质粒细胞转染
按照脂质体Cellfectin®Ⅱ Reagent说明书转染Sf9细胞,共设置3组:pIB/V5-His-AcerOr2(实验组)、pIB/V5-His(空质粒作为对照组),以及正常Sf9细胞作为空白对照组。
1.2.5 转染后重组质粒的表达鉴定
Western blot检测。采用一步法昆虫细胞活性蛋白质提取试剂盒提取细胞总蛋白,以每孔上样10 μL进行12%SDS-PAGE凝胶电泳,半干转至NC膜,用5%脱脂奶粉室温封闭1.5 h。一抗AcerOr2(1∶1 000)4 ℃过夜,二抗驴抗兔IgG室温温育2 h,显微镜下观察拍片。
免疫荧光检测。细胞转染48 h后,弃去培养液,加入4%多聚甲醛溶液室温固定15 min。1% BSA室温封闭1 h,1∶500稀释的一抗37 ℃孵育1.5 h或4 ℃过夜。加入1∶200稀释的Alexa Fluor 594荧光二抗,室温避光孵育1 h。DAPI复染细胞核10 min,90%甘油封片,在显微镜下观察拍片。
2 结果与分析
2.1 亚细胞定位预测
利用在线网站http://linux1.softberry.com/all.htm对AcerOr2蛋白结构亚细胞定位进行预测,结果如图1所示,AcerOr2的亚细胞定位于细胞膜上。
2.2 表达载体的构建和鉴定
本实验成功构建了真核表达载体pIB/V5-AcerOr2,通过RT- PCR鉴定及BamHⅠ和EcoRⅠ酶切分析,也扩增出了预期大小的目的片段AcerOr2(1 763 bp),并且在3 000 bp以上可见pIB/V5-His(3 521 bp)昆虫表达载体的目的条带(图2)。
目的质粒经北京华大基因测序验证,结果与预期完全一致(图3),说明昆虫载体构建成功,插入序列正确可用于后续试验验证。
2.3 Western blot检测蛋白表达
将构建好的真核表达载体转染Sf9细胞,转染48 h后提取总蛋白,通过Western blot验证AcerOr2在Sf9细胞中的表达。检测结果如图4所示:空白对照组和转染空载体细胞组结果显示无条带,转染pIB/V5-AcerOr2的细胞能检测到AcerOr2目的条带的相对分子质量为56 ku,与预期融合蛋白相对分子质量一致,显示重组质粒在Sf9细胞中成功表达目的蛋白。
2.4 免疫荧光检测
根据亚细胞定位分析和跨膜结构域预测AcerOr2是表达在细胞膜上的7次跨膜蛋白,本实验通过免疫荧光实验对AcerOr2在Sf9细胞中的亚细胞定位进行了鉴定。结果如图5所示:在转染AcerOr2的细胞膜上有红色荧光,重组蛋

图1 AcerOr2蛋白结构亚细胞定位预测Fig.1 Subcellular localization of AcerOr2 protein structure prediction
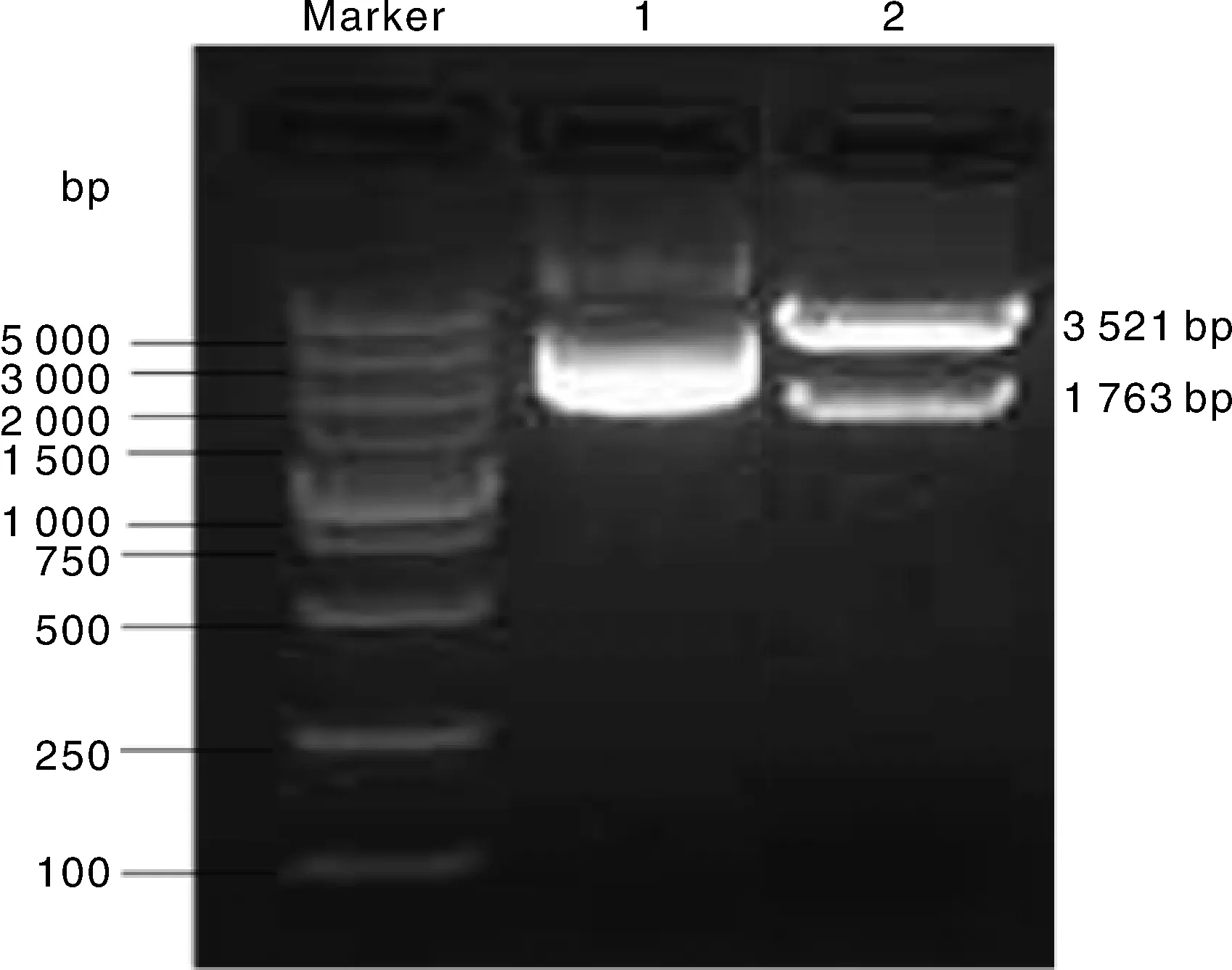
1,空载体pIB/V5-His;2,重组表达载体pIB/V5-AcerOr2。1, Empty vector pIB/V5-His; 2, Recombinant expression vector pIB/V5-AcerOr2.图2 重组表达质粒pIB/V5-His-AcerOr2酶切验证Fig.2 Restriction enzyme digestion of the plasmids pIB-AcerOr2
白主要分布在细胞膜上。
3 讨论
近年,对昆虫气味受体功能的研究除了采用
生物信息学、体内表达定位和基因编码产物相互作用蛋白研究等方法,还将气味受体基因导入到特定的细胞或个体进行研究。常用的异源表达细胞有人胚肾细胞HEK293[16-17]、HeLa细胞[18]、爪蟾卵母细胞Xenopusoocytes、猴胚肾细胞(COS-7)[19],还有果蝇DrosophilamelanogasterS2细胞[20]、草地夜蛾SpodopterafrugiperdaSf9细胞[21-22]。利用哺乳动物细胞系进行气味受体功能研究,常常需要在气味受体基因N-末端加一段信号肽,还需要与编码Gα蛋白基因共转染,才能增强气味受体蛋白在异源细胞中的表达[23]。Sf9细胞来自于鳞翅目昆虫草地夜蛾(Spodopterafugiperda),可以为昆虫气味受体提供最优的表达和膜定位条件[24],能表达昆虫气味受体正确行使功能所必需的内源性的共受体Or83b[22],且可于28 ℃下贴壁生长而不需要CO2,能在质粒和杆状病毒系统中表达。因此,本实验选用Sf9对中华蜜蜂气味受体进行异源细胞功能研究。
蛋白质在细胞内的定位通常与其功能密切相关,其在细胞内的位置决定了其能否发挥活性,同时也决定了其分子功能的特异性。因此,分析其在细胞中的定位,可以为蛋白的功能研究提供重要的线索。本研究成功构建了昆虫细胞真核表达载体pIB/V5-AcerOr2,免疫荧光结果显示,AcerOr2在Sf9细胞质膜中存在。细胞膜在信息交流、控制物质进出、细胞代谢和免疫方面都发挥着极其重要的作用,蛋白质在细胞膜行使其功能时起重要作用。其中受体蛋白具有识别功能。对于多细胞生物而言,细胞间以分泌化学信号分子进行信息交流的通讯方式最为普遍。根据信号分子(配体)溶解性可以分为2类:亲脂类(甲状腺激素和甾类激素,可穿越细胞膜)和亲水类(生长因子、神经递质、多数激素,不可穿越细胞膜)。相应的识别这些信号分子的膜受体蛋白也可分为2类:细胞内受体(存在于细胞质或细胞核中)和细胞表面受体。受体通过与其配体特异性结合,可以将胞外信号转变为胞内的化学或物理信号,以启动细胞内的一系列过程,最终表现为某种生物学效应。AcerOr2在Sf9细胞质膜中的存在,一方面表明AcerOr2成功地转染到Sf9细胞中,另一方面暗示该蛋白可能与胞外信号转变为胞内的化学或物理信号这些过程有关,为深入研究AcerOr2蛋白功能提供了可行性。

图3 重组质粒序列比对结果Fig.3 Recombinant plasmid sequence alignment results
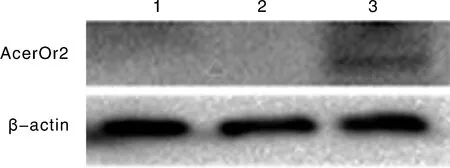
1,未转染的细胞空白对照;2,转染pIB/V5-His空载体对照;3,转染重组质粒pIB/V5-AcerOr2。1, The blank control of untransfected cell; 2, The control of transfected with the pIB/V5-His empty vector; 3, The group of transfected with the recombinant plasmid pIB/V5-AcerOr2.图4 Western blot检测AcerOr2在Sf9细胞上的表达Fig.4 Western blot detection of AcerOr2 expression in Sf9
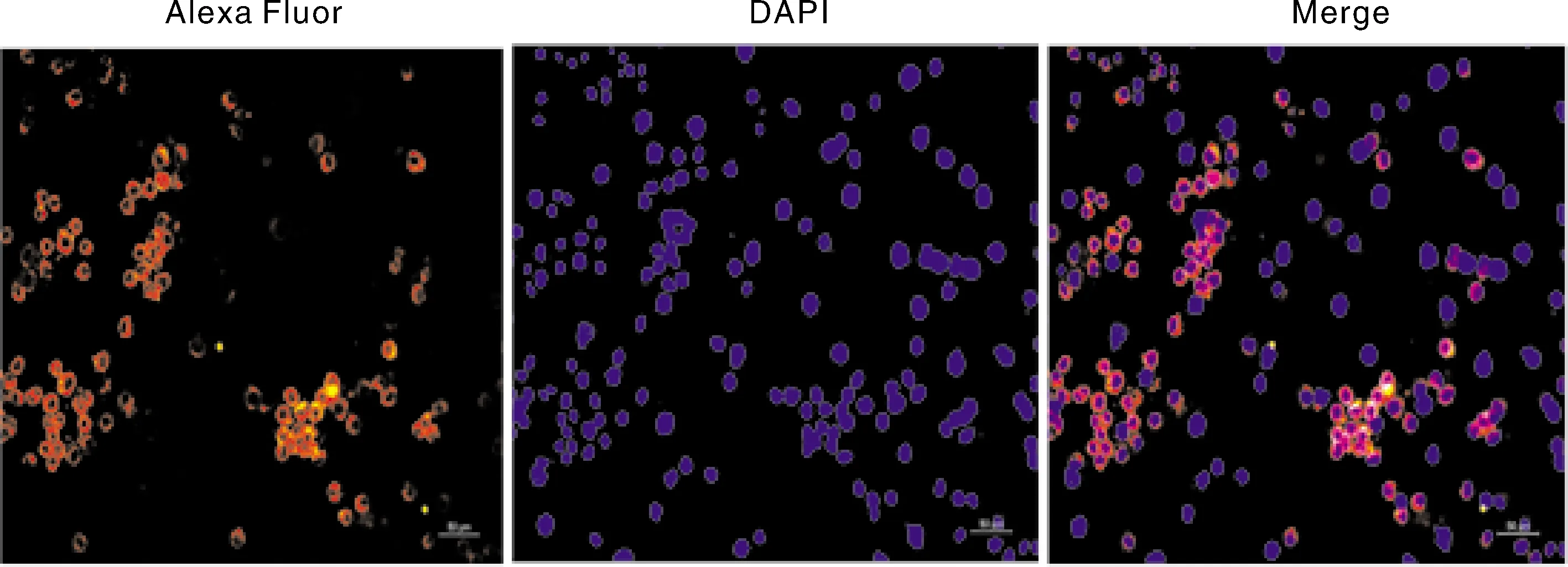
蓝色为DAPI染色(细胞核),红色为AcerOr2融合蛋白产生的荧光。Nuclei were stained with DAPI(blue), cells expressing AcerOr2 were stained with Alexa 594 (red).图5 AcerOr2在Sf9细胞上的表达定位(×50)Fig.5 Subcelluar localization of AcerOr2 in Sf9 cells (×50)
