Tenascin-C在椎间盘退行性病变中的作用及机制研究
2020-06-23丁萌萌贾儒林赵平
丁萌萌,贾儒林,赵平
(1.中国医科大学附属盛京医院麻醉科,沈阳 110004;2.中国刑事警察学院法医系,沈阳 110854)
椎间盘退行性病变 (disc degeneration disease,DDD) 是一个或多个椎间盘退化引起的疾病,是现代社会最重要的公共健康问题之一[1]。椎间盘变性是细胞外基质蛋白 (extracellular matrix protein,ECM) 降解和破坏的慢性过程。一方面,DDD出现细胞外基质降解,导致椎间盘结构破坏[2]。另一方面,ECM的降解产物可能引发或进一步促使椎间盘退变和腰痛相关的炎症反应[3]。Tenascin-C (TNC) 是一种ECM,在分化、疾病发展或损伤时表达[4],它在癌症与炎症中的作用已被广泛研究[5-7],但在DDD中的研究仍是空白。DDD被普遍认为是某种炎性细胞因子,如白细胞介素 (interleukin,IL) -1增加了基质金属蛋白酶 (matrix metalloproteinases,MMP) 的表达,导致椎间盘ECM的丢失,从而使椎间盘发生退行性病变[8]。许多文献[9-12]已经报道炎性细胞因子可以促进TNC在多种细胞中的表达。鉴于ECM与DDD的相互作用,TNC或许与两者存在某种联系,本研究对TNC在DDD中的作用及其机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 动物:Balb-c小白鼠36只,雌性,8~12 周龄,由Jackson Laboratory提供。所用的实验动物、所有动物操作和体内实验均获得弗吉尼亚大学动物保护与使用研究委员会批准。
1.1.2 细胞:人髓核细胞第2~6代,小鼠椎间盘细胞第2~6代。
1.1.3 主要仪器与试剂:IL-1β (美国Abcam公司) ;TRIzol reagent (美国Sigma公司) ;MMP activety assay kit(美国Anaspec公司) 兔抗人Tenascin-C抗体;biotinlyza goat anti rabbit IgG抗体;山羊抗兔抗体680;bio-rad RT-PCR;bio-rad iscript;odyssey membrane scan;细胞培养箱、恒温高速离心机 (美国Thermo公司)。
1.2 方法
1.2.1 人髓核细胞与小鼠椎间盘细胞分离与培养:所有涉及人体材料的实验均获得美国弗吉尼亚大学卫生科学研究机构审查委员会批准。按照美国国家卫生研究机构对手术废物用于人体项目研究的规定,获取的人椎间盘样本来自于弗吉尼亚大学医院接受脊柱侧弯椎间盘切除术手术治疗的患者。将人髓核组织分离,并切成碎末;小鼠实施安乐死,取出脊柱,分离椎间盘,剪碎。用含有0.5%胶原蛋白酶/胰蛋白酶的培养液在37 ℃消化30 min,放入15%FBS和1%青霉素-链霉素的细胞培养液 (DMEM/F12) 中继续培养,孵育在具有5%CO2,37 ℃的潮湿培养箱中。细胞第2~6代使用于此研究。
1.2.2 样品收集:人髓核细胞和小鼠椎间盘细胞培养4~5 d (根据以往最佳培养时间)。在炎性环境TNC水平表达的实验中,IL-1β组加入IL-1β 10 ng/mL培养24 h;对照组不加IL-1β,为空白对照。在炎性环境TNC的表达水平随时间变化实验中,IL-1β组加入IL-1β 10 ng/mL培养4、8、12、24和48 h;对照组不加IL-1β组,为空白对照。根据TNC的时间变化选取24 h作为后续实验中IL-1β的作用时间。完成刺激时间后收集细胞培养液,用TRIzol reagent提取RNA,用细胞裂解液裂解细胞提取蛋白进行后续实验。
1.2.3 实时PCR:根据产品说明使用iScript cDNA synthesis kit (Bio-Rad Laboratories,美国) 将相同质量的RNA 逆转合成互补DNA (cDNA)。实时逆转录聚合酶链反应术采用RT^2 SYBR Green Fluo FAST Mastermix (Qiagen Sciences,美 国) 在iQ5 multicolor real-time PCR Detection System (Bio-Rad Laboratories,美国) 上进行。检测靶向基因包括TNC、胶原蛋白Ⅱ、蛋白聚糖、MMP-9和MMP-13,使用18s来标准化。
1.2.4 Western blotting:收集的细胞裂解液、细胞培养基在bio-rad mini protein tetra system仪器上完成Western blotting检测。一抗 (兔抗人Tenascin-C 抗体)1 ∶500 稀释4 ℃过夜,二抗 (山羊抗兔抗体680)1 ∶1 000稀释,室温孵育1 h,缓慢摇动。扫描蛋白膜。
1.2.5 酶谱法:收集的细胞培养基电泳结束后,加入staining buffer摇晃1 h,destained buffer脱色3 h,使用Precision Plus Protein Standard (Bio-Rad,美国) 获取影像,并使用Image J分析。
1.2.6 MMP活性检测:根据试剂盒说明对样本中MMP的活性进行检测。根据反应物浓度与相对的荧光强度制定标准曲线,根据标准曲线判断合适的反应时间,测定细胞培养液中MMP活性的表达水平。
1.2.7 TNC预处理后培养人髓核细胞:使用TNC 提前预处理的培养盘培养人髓核细胞,分为controlcollagen coated,IL-1β-collagen coated,control-TNC coated和IL-1β-TNC coated 4组。后续给予刺激方式与时间同1.2.2。
1.2.8 体内实验:手术组开腹暴露小鼠的椎间盘,用27 g针头针刺小鼠的椎间盘 (L3~4) 后关腹;对照组只暴露椎间盘不针刺椎间盘。术后1、3、7 d对小鼠实施安乐死,收取小鼠的椎向盘 (L2~5),进行石蜡包埋,石蜡切片,进行TNC的免疫组化染色。
1.3 统计学分析
2 结果
2.1 炎性环境中椎间盘细胞中TNC表达水平
2.1.1 Western blotting检测人髓核细胞TNC蛋白的表达:与对照组 (1.000±0.094 9) 相比,IL-1β刺激的人髓核细胞TNC蛋白表达显著增高 (3.879±0.583 2,P<0.05)。见图1。
2.1.2 实时PCR检测小鼠椎间盘细胞TNCmRNA表达:与对照组 (1.170±0.122 3) 相比,IL-1β刺激的小鼠椎间盘细胞TNCmRNA水平表达显著增高(14.300±0.443 2,P< 0.05)。

图1 炎性环境下TNC蛋白水平在人髓核细胞中的表达变化Fig.1 Changes in TNC protein expression in human nucleus pulposus cells under inflammatory conditions
2.1.3 实时PCR检测小鼠椎间盘细胞胶原蛋白Ⅱ和蛋白聚糖 mRNA的表达水平:与对照组 (1.000±0.038)相比,IL-1β刺激的小鼠椎间盘细胞 胶原蛋白ⅡmRNA水平表达显著降低 (0.155±0.044,P< 0.05)。与对照组 (1.000±0.090) 相比,IL-1β刺激的小鼠椎间盘细胞蛋白聚糖 mRNA水平表达显著降低 (0.074±0.022,P< 0.05)。
2.2 炎性环境椎间盘细胞中不同时间TNC的表达变化
2.2.1 实时PCR检测人髓核细胞TNC、胶原蛋白Ⅱ和蛋白聚糖 mRNA水平在不同时间的表达:在IL-1β介导的炎性刺激下,与对照组相比,TNCmRNA水平在12 h达到峰值 (P< 0.05),在24 h开始下降;胶原蛋白Ⅱ mRNA水平在24 h开始显著降低 (P< 0.001) ;蛋白聚糖 mRNA水平在12 h开始显著降低 (P< 0.001)。见表1。
2.2.2 实时 PCR 检测小鼠的椎间盘细胞TNC、胶原蛋白Ⅱ和蛋白聚糖 mRNA水平在不同时间的表达:与人髓核细胞PCR 结果相似,小鼠椎间盘细胞在IL-1β介导的炎性刺激下,与对照组相比,TNCmRNA水平在8 h开始增高 (P< 0.05),12 h达到峰值 (P<0.05),在24 h开始下降;胶原蛋白Ⅱ mRNA水平在24 h开始显著降低 (P< 0.001) ;蛋白聚糖 mRNA水平在24 h开始显著降低 (P< 0.001)。见表2。
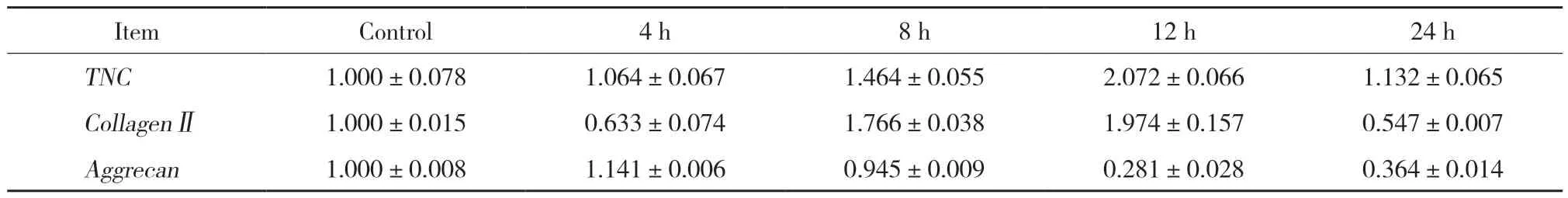
表1 人髓核细胞中不同时间TNC,胶原蛋白Ⅱ,蛋白聚糖 mRNA表达的变化Tab.1 TNC,collagenⅡ,and aggrecan mRNA expression in human NP cells over time

表2 小鼠椎间盘细胞中不同时间TNC、胶原蛋白Ⅱ、蛋白聚糖 mRNA表达的变化Tab.2 TNC,collagenⅡ,and aggrecan mRNA expression in mouse disc cells over time
2.3 炎性环境中椎间盘细胞MMP活性的检测
2.3.1 实时PCR检测小鼠椎间盘细胞MMP-9/MMP-13mRNA的表达:与对照组 (1.022±0.028) 相比,IL-1β刺激的小鼠椎间盘细胞MMP-9mRNA水平表达显著增高 (5.430±0.526,P< 0.05)。与对照组 (1.018±0.035) 相比,IL-1β刺激的小鼠椎间盘细胞MMP-13mRNA水平表达显著增高 (16.393±0.922,P< 0.05)。
2.3.2 酶谱法测定人髓核细胞培养液MMP的活性变化:与对照组相比,IL-1β刺激的人髓核细胞MMP-2的活性在8h开始增高(1.910±0.520,P<0.05) ;在24 h达到峰值 (13.078±0.888,P< 0.001)。见图2。

图2 炎性环境下MMP-2在人髓核细胞培养液中的活性变化Fig.2 Changes in MMP activity in human nucleus pulposus cells medium under inflammatory conditions
2.3.3 酶谱法测定小鼠椎间盘细胞培养液中MMP的活性变化:与对照组相比,IL-1β刺激小鼠椎间盘细胞后MMP-2 (26.943±21.183),MMP-9 (95.312±3.889)的表达显著增高 (P< 0.001)。见图3。
图3 炎性环境下MMP-2在小鼠椎间盘细胞培养液中的活性变化Fig.3 The expression of MMP-2 activity changes in mouse disc degeneration cells medium under inflammatory environment
2.3.4 MMP活性检测测定小鼠椎间盘细胞培养液中MMP的活性变化:与对照组相比,IL-1β刺激小鼠椎间盘细胞后MMP-2和MMP-9的活性显著增高 (P<0.001)。见表3。

表3 MMP 活性检测结果Tab.3 MMP activity assay results
2.4 给予外源性TNC后人髓核细胞胶原蛋白Ⅱ和蛋白聚糖mRNA的表达
实时PCR结果显示,加入外源性TNC 后,胶原蛋白Ⅱ的表达由降低变为显著高于对照组 (P<0.001) ;蛋白聚糖的表达由降低变为与对照组无统计学差异 (P> 0.05)。见表4。
2.5 给予外源性TNC后人髓核细胞中MMP的活性
酶谱法检测结果显示,与IL-1β-collagen coated组相比,IL-1β-TNC coated组MMP-9和MMP-2的水平明显增高 (P< 0.001)。见图4、表5。
2.6 体内实验结果
对照组小鼠椎间盘结构完整,纤维环结构排列整齐,髓核组织红染,细胞核蓝染,为正常椎间盘;与对照组相比,手术组椎间盘结构破坏,纤维环结构不规则,髓核组织丢失,为病变的椎间盘,见图5。免疫组化染色可见,与对照组相比,TNC在手术组的小鼠椎间盘中表达明显增高 (P< 0.05)。

表4 给予外源性TNC后胶原蛋白 II和蛋白聚糖 mRNA表达水平的变化Tab.4 Changes in collagen II and aggrecan mRNA expressions after exogenous TNC administration
图4 给予外源性TNC后人髓核细胞中MMP的活性变化Fig.4 Changes in MMP activity after exogenous TNC administration
3 讨论
正常的椎间盘中,分子的合成与降解处于平衡状态。当降解的速度大于合成的速度时,椎间盘的组织与生物功能就会降低[13]。IL-1β是一种炎性细胞因子,常用于模拟DDD体外实验[14-15]。为了验证TNC在DDD中的表达,本研究给予人和小鼠椎间盘细胞IL-1β刺激,并采用Western blotting、实时PCR和免疫组化染色检测TNCmRNA和蛋白水平的表达情况。结果显示,在人与小鼠的椎间盘细胞中,TNC的蛋白与mRNA水平在IL-1β介导的炎性刺激下表达增高。胶原蛋白Ⅱ和蛋白聚糖的mRNA水平降低。本研究结果显示,IL-1β介导的炎性刺激下,胶原蛋白Ⅱ和蛋白聚糖表达降低的时间在TNC表达水平降低开始后,TNC的降低也许与椎间盘细胞病变的发生有着某种联系。
DDD发生时,MMP降解ECM,使其含量变少,导致椎间盘变性,被降解的外基质蛋白产物又进一步激活MMP的活性[16]。MMP-2,MMP-9主要降解蛋白聚糖;MMP-3,MMP-13主要降解胶原蛋白。目前的研究[17-19]已经证明,在IL-1β介导的炎性刺激下,椎间盘细胞的MMP活性增高。本研究结果显示,IL-1β介导的炎性刺激下,MMPmRNA水平及活性增高。为了验证TNC对DDD的作用且与MMP表达的关系,给予外源性的TNC蛋白,观察胶原蛋白Ⅱ,蛋白聚糖,MMP活性的水平。结果显示,外源性TNC对胶原蛋白Ⅱ和蛋白聚糖mRNA水平有保护作用。在给予外源性TNC后,MMP的活性降低,这也许是胶原蛋白Ⅱ和蛋白聚糖mRNA水平表达增高的原因。免疫组化染色可见TNC在手术组的小鼠椎间盘及周围组织均有明显的阳性结果。

表5 给予外源性TNC后MMP的活性变化Tab.5 Changes in MMP activity after exogenous TNC administration
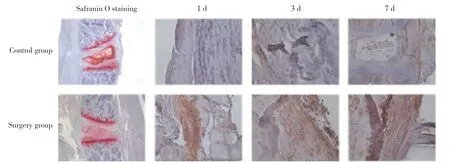
图5 免疫组化检测针刺小鼠椎间盘术后1、3、7 d TNC在小鼠椎间盘及周围的表达水平 ×20Fig.5 TNC expression levels in and around the intervertebral discs in mice detected by immunohistochemical staining 1,3,and 7 days after acupuncture ×20
本研究验证了在IL-1β介导的炎性刺激下,人和小鼠的椎间盘细胞及小鼠的椎间盘及周围组织 (体外实验与体内实验) TNC表达均增高,在给予外源性TNC后,MMP的活性降低,胶原蛋白Ⅱ和蛋白聚糖的表达升高,这可能是TNC调节MMP活性,从而对退变的椎间盘细胞起到保护作用,但以何种机制及何种通路发挥作用还需进一步研究。
