马拉松运动对心脏的影响:生理适应和潜在风险
2020-06-23王世强吕万刚刘亚云饶志坚
王世强 ,吕万刚 ,常 芸 ,刘亚云 ,饶志坚
马拉松运动起源于公元前490年发生在波斯和雅典的一场战争,真正被设立为一项体育比赛是在1896年举行的第一届奥林匹克运动会。此后,马拉松运动在世界各地广泛举行,越来越多的爱好者参与其中。据中国田径协会网站统计,2017年我国举办了328场马拉松比赛,参与者达百万,火爆程度由此可见一斑。众所周知,长期适宜强度的运动能够促进骨骼肌机能,增加心肺耐力,增强机体免疫能力,降低心血管疾病发生风险。全程马拉松为42.195 km,是一场长时间、较高强度的耐力运动,对机体各器官尤其是心血管系统的影响较大(Predel,2014)。它作为一种特殊的耐力运动,对心血管系统的影响是利还是弊,学术界对此进行了大量的研究。近年,在政府的支持和商家的助推下,马拉松在我国日益火爆,注册和参赛人数逐年攀升,然而,由于心脏不适而终止比赛甚至发生心脏猝死等恶性心血管事件屡有发生,新闻媒体的过度报道影响了部分人群参加马拉松的热情。马拉松对心脏健康的益多还是弊多,如何规避马拉松运动中的心血管意外,已成为近年的研究热点。关于马拉松对身体各器官(尤其是心脏)结构和功能的影响,本研究团队进行过分析和探讨,但缺乏系统、全面和深入的分析(常芸,2013)。近年来,随着现代医学诊断和分子生物学检测方法的进步,人们对此问题产生了新的认识。本文系统综述了近年来马拉松运动对心脏影响的相关研究,以期厘清马拉松运动对心血管的生理适应和潜在风险。
1 马拉松运动对心脏结构和功能的影响
运动诱导的心脏肥大有2种类型:离心性心脏肥大和向心性心脏肥大。有研究认为,运动性心脏肥大类型与病理性心脏肥大不同,它表现为良好的心脏结构和功能适应,称为“运动员心脏”,是运动员竞技能力的保障(常芸,2010a)。也有研究认为,运动性心脏肥大介于生理性心脏肥大和病理性心脏肥大的“中间地带”。马拉松运动作为大负荷运动,对心脏结构和功能影响较大。长期以来,关于马拉松对左心室的研究较为充分,包括长期运动和急性运动对其的影响。近年来,多个研究开始关注马拉松运动对右心室、心房和冠状动脉的影响,尤其是对右心室结构和功能的影响受到越来越多的关注(Arbab-Zadeh et al.,2014;Eijsvogels et al.,2016;Jassal et al.,2009)。
1.1 马拉松对左心室结构和功能的影响
1976年,《美国医学会杂志》(The Journal of the American Medical Association,JAMA)的一篇研究最早报道了关于马拉松运动员左心室结构和功能的变化,发现马拉松运动员左心室后壁厚度增加,收缩末期内径增加,但这种左心室肥大为生理性肥大,而非病理性肥大,有助于运动员心脏功能的提升(Raskoff et al.,1976)。早年,我国运动医学工作者对我国马拉松运动员进行的调查显示,与普通人相比,他们在安静状态下,左室后壁舒张末期厚度(LVPWd)、左心室舒张末期内径(LVEDD)和左心室收缩末期内径(LVESD)等指标具有明显的增加,且高水平马拉松运动员比一般选手具有更大的增加幅度。该结果表明,马拉松运动员存在明显的心肌肥厚和心腔扩张。另外,从功能指标上看,马拉松运动员表现为更低的安静心率、更大的每分射血量(苏全生等,1989)。心脏的收缩和舒张性能决定了它的射血功能,尤其是左心室的舒张性能体现了心肌的顺应性,是判断心脏功能高低的敏感指标。与病理性心肌肥大不同,马拉松运动诱导的心肌肥大增加了左心室的顺应性,提高了心脏舒张功能(苏全生,1989)。近年来,斑点追踪技术显示,经过良好训练的业余马拉松运动员的左心室整体纵向收缩性能和舒张能力得到显著提升(Schattke et al.,2014)。采用磁共振超声成像技术等研究发现,马拉松运动员整体纵向应变(GLS)、整体径向应变(GRS)、LVEDD、LVESD和脉博输出量(SV)等指标均显著增加(Abdullah et al.,2016;Ujka et al.,2016)。这些研究均提示,经过长期训练,专业马拉松运动员的左心室功能表现出“运动员心脏”,呈现离心性心肌肥大,具有高于常人的心脏舒缩功能。
研究发现,马拉松运动对中老年人群的左心室也具有良好的促进作用。Findlay等(1987)发现,中年男性马拉松运动员(总里程达1 067 km)的左心室舒张末期容积(LVEDV)、左心室射血分数(LVEF)和每分输出量(CO)均显著增加。Zilinski等(2015)研究也显示,中年男性(48±7岁)完成18周的业余马拉松训练(每周40±14 km)后,左心室出现明显的扩张、舒张功能增加,心血管风险降低。Schattke等(2014)调查了84名马拉松运动员(50±11岁),结果发现,与正常人群相比,中老年马拉松运动员具有较高的左心室GLS和舒张能力。相关分析显示,左心室GLS并出现现年龄依赖性下降,提示马拉松运动对高年龄段人群同样具有心脏促进功能。45名中年(年龄48±7岁)业余马拉松运动员经过18周、每周40 km的训练后,发现左右心室和心房均出现明显的心腔扩张,心肌舒缩功能增加(Hanssen et al.,2011)。发表在Circulation上的报道显示,与同龄久坐人群相比,中老年男性马拉松运动员(年龄54.4±8.5岁;运动年限31.0±12.6年)虽然LVEF无明显增加,但心脏重量、LVEDV、舒张末期左室内径(LVIDd)、三尖瓣环收缩期位移(TAPSE)、SV等均明显增加(Merghani et al.,2017)。
近年国外研究发现,马拉松运动后即刻和马拉松运动恢复过程中,运动员左心室功能存在明显下降的现象。较为一致的研究是,马拉松运动后,左心室舒张功能出现明显的下降。Knebel等(2014)观察了89名女性马拉松运动员在柏林马拉松运动后即刻和2周后的左心室功能变化情况,发现运动后即刻E/A比值明显降低,提示左心室舒张功能受损,而2周后可恢复至正常水平。在Knebel另一项研究中发现,老年和年轻马拉松运动员在马拉松运动后即刻左心室舒张功能均显著下降,而左心室收缩功能无明显异常(Knebel et al.,2009)。与此一致,Oxborough等(2010)发现,完成一次全程马拉松后即刻和6 h后,左心室收缩功能无明显变化,而左室舒张早期峰值应变率(LVSRe)、三尖瓣口舒张早期峰值流速(E)、舒张晚期峰值流速(A)和E/A等心肌舒张功能指标均显著下调,6 h后基本恢复正常。Lord等(2018)做的Meta分析显示,马拉松等耐力运动后左心室GLS、应变率和扭转等指标均显著降低,提示马拉松运动后左心室的舒张功能显著降低。Montiel等(2015)研究也发现,马拉松运动后即刻E/A的比值显著性降低,24 h后恢复到赛前水平。
马拉松运动后收缩功能的变化,其研究结论仍存在争议。Krzemiński等(2016)研究显示,马拉松运动后90 min,左心室缩短分数显著低于运动前和运动后即刻。有研究报道,马拉松运动后24 h,运动员心肌的收缩功能显著低于运动前水平,最大摄氧量(V·O2max)也显著降低(Sierra et al.,2016)。Hewing等(2015)证实,马拉松运动后即刻左心室缩短分数(LVFS)不仅没有降低,反而增加了,但E/A显著降低,运动后14天E/A的比值才恢复到运动前水平。结果提示,虽然马拉松运动后左心室收缩功能得到提高,但舒张功能明显降低。一项Meta分析显示,294名运动员(主要为马拉松运动员)进行耐力运动后,LVEF、左室面积变化分数(LVFAC)具有短暂性下降趋势,但与赛前相比无明显差异(Elliott et al.,2015)。然而,最新的一项Meta分析显示,尽管马拉松运动后左心室长轴应变和LVEDV等指标无显著变化,LVEF却显著降低(Lord et al.,2018)。有研究发现,马拉松运动后,左心室心肌局部水肿、灌注减少和舒缩功能降低主要发生在训练水平较低和体适能差的选手身上,3个月后这种心肌异常基本得到恢复。尽管这种现象可逆,但也短暂增加了马拉松运动员心脏的风险(Gaudreault et al.,2013)。
综上所述,与其他类型的耐力运动员相似,马拉松运动员具有心肌增厚、心腔增大和心功能增加等有益的生理改变。马拉松运动后出现的左心室功能短暂下降是暂时的生理现象,而非结构病变所致,也可称为“运动性心脏疲劳”(exercise-induced cardiac fatigue)。这可能是一种心肌自我保护的机制,经过数天恢复,“心脏疲劳”现象会逐渐消除。
1.2 马拉松运动对右心室结构和功能的影响
由于左心室射血进入主动脉,随全身血液循环供应机体运动系统的能量需求,因此,左心室是以往研究关注的重点。近年来,耐力运动对右心室的影响正逐渐受到体育学和医学界的关注。Major等(2015)对比研究了52名优秀耐力运动员左、右心室的结构和功能与普通受试者的差别。结果表明,耐力运动对左心室心脏功能的影响大于右心室,而结构重塑的程度则小于右心室。D’Andrea等(2013)通过超声心动技术发现,马拉松等高水平耐力运动员的右心室舒张末期直径显著大于力量型运动员和普通人群,表明耐力运动造成右心室扩张。Elliott(2015)的一项Meta分析显示,马拉松运动员的右心室具有明显的扩大现象,且训练年限越长,马拉松对右心室形态和功能的重塑就越明显(Ujka et al.,2016)。
与左心室相同,马拉松运动后即刻及恢复期内右心室功能降低。Trivax等(2010)发现,马拉松运动后即刻RVESV虽然显著增加,而RVEF却明显降低。Oomah等(2011)发现,与安静状态相比,完成一次半程马拉松运动后即刻,运动员的RVEF从59%降到45%,1周后又恢复到正常水平。通过测量马拉松运动后6 h RVEF、TAPSE、右心室整体和局部Strain(应变)等指标,结果提示右心室收缩和舒张功能已受损,而左心室功能未受明显影响(Elliott et al.,2015)。Gaudreault等(2013)研究也表明,马拉松运动后即刻RVEF显著降低,同时伴随心肌局部缺血,这更容易发生于训练年限短、训练距离少和V·O2max低的马拉松运动员身上。运动后3个月,右心室的结构和功能已经恢复正常。与此结果一致,有研究发现,老年参赛选手在马拉松运动后即刻右心室收缩功能短暂地显著降低,运动后24 h可恢复正常(Karlstedt et al.,2012)。
马拉松等耐力运动对右心室的影响大于左心室,是学界研究的一个重要内容。Stewart等(2016)采用二维应变超声心动图评价10名耐力运动员(自行车)的心肌功能,结果显示,90 min大强度运动后,左心室纵向应变降低,运动结束1 h后降至最低,且24 h内尚未恢复到正常,而120 min的中等强度未造成左心室纵向应变下降。90 min大强度和120 min中强度运动均造成运动员右心室纵向应变显著降低,且24 h内尚未恢复到正常范围。可以看出,运动对右心室功能造成的影响大于对左心室造成的影响,右心室对运动强度的增加更敏感。La等(2012)深入对比分析马拉松对左右心室的影响,结果发现,类似肺动脉高血压造成右心室发生变化,在心肌舒张早期,室间隔向左心室偏移,表现为右心室收缩末期容积增加16%,心肌收缩能力降低,右心室射血分数(RVEF)有9%的降低幅度,而LVEF无明显变化。RVFAC、TAPSE和RV Strain等指标均有明显降低。多因素相关分析发现,耐力运动的持续时间越长,运动强度越大,RVEF的降低幅度越大,右心室受损的程度越大。受损的右心室功能在1周后可以恢复至正常水平。该团队另一项研究采用磁共振检测发现,和非运动员相比,马拉松等耐力运动员右心室重塑的程度大于对左心室。进一步研究发现,这可能与运动造成的右心室收缩末期室壁压力升高幅度大于左心室收缩末期室壁压力升高的幅度有关(La Gerche et al.,2011)(图1)。Lord等(2015)采用超声心动和心电图技术对马拉松运动员运动前后的右心室功能和心电变化进行研究,结果发现,马拉松运动后即刻右心室体积显著增加,右心室室壁压力显著增加。

图1 马拉松运动时左、右室壁压力变化示意图(La Gerche et al.,2014)Figure 1. Diagram of Changes of Wall Stress on Left and Right Ventricle during Marathon
研究显示,在安静和运动状态下,左、右心室承压幅度不同。安静状态下,右心室的重量和收缩能力是左心室的1/3~1/5,这是自身适应的结果。右心室受到较小的阻力和较大的肺循环顺应性,因此,其血液能顺利通过肺部,不需右心室过多地收缩,而左心室受到主动脉血流的阻力和较小的体循环顺应性(Buechel et al.,2009)。有报道指出,在健康人群中,左、右心室的生理和代谢并不相同,某些指标在右心室的变化对于研究运动健康促进的效果可能更具有意义(Heiskanen et al.,2015)。研究报道,慢性阻塞性肺病造成肺动脉高压,导致右心室舒张功能发生障碍,射血功能降低(Fenster et al.,2015)。与此机制一致,马拉松运动造成的肺动脉高压也会导致右心室功能发生异常。在一定运动负荷范围内,右心室有一定的收缩储备,能够抵抗运动引起的肺动脉压力的增加。然而,随着运动强度的增加和时间的持续,在显著增加的血流压力和持续作用下,右心室则会发生损伤。
马拉松运动后出现的左心室功能尤其是舒张功能下降,可能与右心室功能下降有关。一方面,马拉松运动后RVEDV和RVESV的显著增加造成室间隔发生左向移动,挤压了左心室的空间,对左心室舒张期充盈造成影响;另一方面,右心室收缩障碍引起E/E’比值下降,左心房前负荷降低,进而影响了左心室舒张期血液充盈,损害左心室舒张功能。因此,尽管马拉松运动后左心室的收缩能力没有受到影响,但由于其舒张功能受损,左心室SV减少(La Gerche et al.,2012;Oxborough et al.,2011)。
综上所述,马拉松运动对左、右心室壁的压力影响不同。安静状态下,左心室壁的压力高于右心室。随着运动强度的增加,右心室壁压力逐渐增加,左心室壁压力逐渐降低。马拉松运动后出现的左心室功能降低,尤其是舒张功能下降,可能与右心室功能降低有关。马拉松运动后出现的右心室收缩和舒张功能是一种短暂的下降,这可能是心脏的一种生理适应,随后数周内可恢复至正常水平。以往的筛查多数关注左心室,而忽略了对右心室功能的检测。因此,最大强度运动时,医学上通过非侵入手段,如心电、超声心动和心脏核磁共振等,利用可靠有效的指标检测右心室的变化,及早判断运动员和广大健身爱好者可能存在的心脏危险信号,对运动性心脏疾病的预防和赛场意外的防范具有重要意义(Kim et al.,2015)。
1.3 马拉松运动对心房结构和功能的影响
心房的收缩能力对心室的血液充盈具有重要影响。Gabrielli等(2018)发现,马拉松运动员左心房体积明显变大,收缩能力显著增强,且高水平马拉松运动员增加幅度更加明显。相关分析显示,马拉松运动员的左心房收缩能力与V·O2max显著相关。Wilhelm等(2012a)研究发现,马拉松运动诱导右心房和左心房体积增大,平均参加过12.8次马拉松的运动员左、右心房体积分别增加74%和60%。其另一篇研究表明,与非马拉松跑步选手相比,马拉松运动员左、右心房容积明显增加,参加5次以上的马拉松运动员比参加1~4次的运动员具有更大的左、右心房容积。相关分析发现,马拉松参加次数是左、右心房体积的独立预测因子,而与左、右心室无关(Wilhelm et al.,2012b)。最近,发表在Circulation上的报道显示,与同龄久坐人群相比,中老年男性马拉松运动员的左心房内径、左右心房面积均明显增加(Merghani et al.,2017)。
研究表明,马拉松运动后即刻和恢复期,左、右心房也出现明显扩张和功能降低(Trivax et al.,2010;Wilhelm et al.,2011)。马拉松运动后,有关左心房功能变化的研究较少。Oxborough等(2010)的研究发现,马拉松运动后即刻,左心房收缩末期容积(LAED)、早期舒张应变(ASRe)等反映心房舒张功能的指标存在短暂性降低,左心房前负荷降低,虽然左心房收缩功能有所提高,但整体降低了左心室的舒张期血液充盈,最终降低了左心室的射血能力。研究进一步指出,马拉松运动后左心房的前负荷降低可能与右心室输出量减少、肺动脉压力增高有关。研究中也指出了马拉松等耐力运动后心脏各个腔室功能变化之间的关系,即由于马拉松运动后右心室功能降低,左心房前负荷增加,进而影响了左心室舒张期血液充盈量。同时,左心室舒张功能减弱,可能引起左心室收缩功能的下降。
1.4 马拉松运动停训后心脏结构和功能的变化
研究表明,马拉松诱导的心脏肥大为离心性心肌肥大,其结构和功能适应性变化容易发生消退。Demirelli等(2015)指出,马拉松等优秀运动员退役10年后,其左心室重量、左心室指数、LVPW、LVEDD等结构指标和普通对照组相比,已无明显差异。另外,LVEF、LVESV、LVEDV等功能指标业已恢复到正常范围,而摔跤运动员仍存在明显的左心室肥大。与此一致,经过连续18周训练(每周7 h)的业余马拉松运动员停训4周后,训练得以增加的左心室重量、左右心室壁厚度和右心房面积均出现明显的消退,8周后右心房和右心室降至训练前水平,而左心室仍具有明显的增加。这说明停训对心房和右心室的影响大于左心室,马拉松对右心室的结构和功能影响会逐渐消退至正常水平,而对左心室的影响可能产生永久的改变(Pedlar et al.,2018)。与此相反,发表在Circulation上的一篇报道证实,停训6个月之后,经过1年马拉松运动产生的左心室结构和功能重塑已经消退至正常基线水平,而马拉松诱导的右心室的离心性重塑虽然也有消退现象,但依然存在(Arbab-Zadeh et al.,2014)。
综上所述,马拉松运动诱导心脏产生的结构和功能重塑在停训后会逐渐发生消退。消退的程度可能与从事马拉松运动的时间以及停训时间有关,训练时间短、停训时间长的消退会更明显。
1.5 马拉松运动对冠状动脉的影响
规律适度的运动有助于改善心血管风险,降低心血管疾病(cardiovascular disease,CVD)的发病率和死亡率。马拉松运动时,机体长时间运动,心脏持续大量供血,同时心肌细胞处于高强度工作状态,也需要持续的血液供应。冠状动脉作为营养心脏的唯一动脉,与马拉松之间的关系如何,近年被广泛研究。CAC(coronary artery calcification)积分是利用CT成像技术来判断冠状动脉是否发生钙化的一项指标,与总体的动脉粥样硬化程度密切相关。CAC积分越高,冠状动脉钙化的风险越大。多个研究对马拉松运动与冠状动脉钙化风险的关系进行了探讨。
2008年,Möhlenkamp调查了108名50岁以上的马拉松运动员,发现与同龄对照人群相比,尽管马拉松运动能够降低收缩压和血液中的LDL水平,增加HDL浓度,降低10年FRS评分,但CAC评分大于100的马拉松运动员比例高达36%,高于同龄对照人群。随后2年的随访发现,其中4名马拉松运动员出现急性冠状动脉事件,需要进行冠状动脉重建术。该研究提示,长期的马拉松运动可能增加冠状动脉事件的风险。然而,该研究中的马拉松运动员,多数是吸烟者,其可信度受到学者的质疑。但这项研究却引起学者对马拉松与冠状动脉健康关系的研究。随后,Circulation上的2篇报道揭示了马拉松等耐力运动与冠状动脉钙化之间的关系。其中一项结果显示,每周运动量大于2 000 MET分钟的马拉松等耐力运动员有较高的CAC积分和动脉粥样硬化性斑块发生率。有趣的是,运动量较大的运动员有良性的斑块组成,危害性大的混合斑块较少,更常见的是稳定的良性钙化斑块。因此,与拥有相同CAC负担的普通人相比,马拉松运动员可能具有较低的冠状动脉病症事件发生率。研究进一步指出,高强度运动状态下,高心率造成冠状动脉迂曲,血液层流被破坏,同时伴有血压增加,可能是诱导冠状动脉CAC评分增加的原因。另外,运动诱导的甲状腺旁素增高和低镁血症,也可能是其中的原因(Aengevaeren et al.,2017)。与此一致,另一项研究调查152名高水平马拉松运动员的CAC后发现,多数运动员的CAC评分处于正常水平。虽然男性运动员的CAC评分超过300阿格斯顿单位的概率更大,更容易出现冠状动脉斑块,但运动员冠状动脉斑块的覆盖更广,其较高的稳定性可以降低斑块破裂和心肌梗死的风险(Merghani et al.,2017)。
与以上2项Circulation上的报道不同,Med Sci Sports Exerc的2篇报道显示,马拉松运动降低了冠状动脉斑块形成的风险。Roberts等(2017a)调查了50名男性马拉松运动员(平均年龄:59±0.9岁;从事马拉松运动年限:26~34年;平均马拉松参加次数为58.5次,每年至少参加一次)与CAC积分之间的关系,结果发现,CAC评分与参与马拉松的次数、从事年限无相关性,而与参加者的年龄、开始参加年龄以及第一次完成马拉松运动的年龄有关系。参加马拉松的年龄、开始马拉松的年龄以及第一次完成马拉松的年龄越大,CAC的评分就越高,冠状动脉粥样硬化的风险就越高。这项研究提示,对于长期从事马拉松的运动员,耐力训练量增加不会增加冠状动脉斑块的形成风险。与此一致,该团队又调查了26名女性马拉松运动员。结果发现,与久坐女性人群相比,女性马拉松运动员的冠状动脉钙化计数减少,冠状动脉斑块患病率降低,钙化斑块体积变小。已经形成斑块的运动员则具有较大的年龄和较高的心血管风险因素。另外,研究发现,马拉松运动员拥有较低的吸烟、高血压、高血脂等风险因素,较低安静心率、体重、BMI、甘油三酯水平,以及较高的高密度脂蛋白水平。该研究提示,长期的马拉松运动降低了女性冠状动脉斑块形成及其发生风险(Roberts et al.,2017b)。
综上所述,尽管关于马拉松运动与CAC积分之间的关系仍存在争议,但较为一致的研究结果是,年龄、疾病和不良习惯仍然是CAC增高的主要因素,参加马拉松运动距离、次数和年限等均有CAC积分无关。与同龄和相同心血管风险因素的对照人群相比,马拉松运动员具有较低的冠状动脉斑块形成风险。
2 马拉松运动与心肌损伤标志物
马拉松运动是否会引起心肌损伤、损伤的程度及是否可逆,受到越来越多的关注,这可通过观察运动后心肌损伤标志物的释放及其特点进行判断。心肌损伤标志物包括心肌肌钙蛋白I(cardiac troponin I,cTnI)、肌钙蛋白T(cardiac troponin T,cTnT)、脑尿钠肽(brain natriuretic pep-tide,BNP)和B型氨基端利钠肽原(N-terminal pronatriuretic peptide,NT-proBNP)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)等,它们是临床上诊断急性冠脉综合征和心脏衰竭的常用指标。其中,cTnI和cTnT作为检测心肌是否受损及反映心功能的生物学标志物,是目前临床上评价受损最简便、易行和可靠的方法(Sedaghat-Hamedani et al.,2015)。
2.1 马拉松运动诱导的心肌损伤标志物释放
与自行车、铁人三项等耐力运动项目相同,马拉松运动后运动员血液中心肌损伤因子具有明显升高的现象。1987年最早进行了马拉松运动后运动员血液cTnI含量变化的研究,开启了马拉松运动员心肌损伤的长期争论(Cummins et al.,1987)。此后研究聚焦于2个问题:1)马拉松运动是否导致cTnI等心肌损伤因子的升高?2)这种升高是生理性的还是病理性的?随后,针对以上问题,学者进行了深入研究。由于样本量低、检测技术的敏感性和精确度不高等问题,2000年以前发表的研究指出,运动后心肌损伤因子阳性概率普遍较低,在0%~50%范围内波动(Gresslien et al.,2016)。例如,1999年的1篇报道发现,在22名马拉松运动员赛后即刻和恢复期,仅有1名运动员出现cTnI和cTnT的明显增加(Lucia et al.,1999)。Siegel等(1997)检测了45名马拉松运动员赛后即刻cTnI和cTnT的含量,结果显示,其平均值仍处于正常范围,仅有20%的运动员出现明显的升高。
2000年以后,随着检测技术的进步和样本量的增加,马拉松等耐力运动后cTnT和cTnI的阳性率显著增加。在2002年波斯顿马拉松比赛期间,Fortescue等(2007)调查了参加比赛的482名的运动员,其cTnI和cTnT的阳性率为68%,其中11%的运动员达到临床阈值(急性心肌梗死诊断水平,cTnT≥0.075 ng/mL或 cTnI≥0.5 ng/mL)。Nie(2011)对63名青少年马拉松运动员的研究表明,马拉松运动后即刻cTnT的阳性率为90%,其中70%的运动员达到临床阈值水平。对业余马拉松运动员进行的一项研究发现,马拉松运动后即刻NT-proBNP仅增加了1.3倍,阳性率仅为30.7%,而hs-TnT和新型心肌损伤纤维化标志物分别增加了16倍和1.6倍,其阳性率分别高达86.7%和88.3%(Dawson et al.,2013)。最近的研究采用高敏分析方法检测马拉松运动前后cTnI的变化,结果显示,96%的受试者cTnI含量显著增加,69%的受试者达到或高于急性心肌梗死诊断水平(Zhu et al.,2013)。Huang(2018)对比第四代和第五代cTnT的检测计算发现,马拉松运动后,采用第四代检测技术检测的cTnT阳性率为43%,而采用第五代技术检测的阳性率为94%。
以上研究提示,马拉松运动后即刻心肌损伤因子的释放大幅增加。不同研究中心肌损伤因子的阳性发生率不同,这与心肌损伤因子的种类有关。其中,cTnT是马拉松研究中使用最广泛的指标。另外,不同的检测方法也会造成损伤因子的阳性检出率不同(表1)。

表1 马拉松运动后即刻心肌损伤标志物变化的相关研究Table 1 Study on the Changes of Immediate Myocardial Injury Markers after Marathon
2.2 马拉松运动后心肌损伤标志物释放的影响因素
马拉松运动后,心肌损伤因子出现不同程度的升高,不同选手之间也存在较大的差异。近些年的研究表明,马拉松的完成时间、强度、选手的从业年限或训练水平都可能是影响运动后心肌损伤因子释放的重要因素。这也可能是不同研究中阳性率存在差异的原因。
2.2.1 时间和强度
运动后心肌损伤标志物升高,可能是心肌的应激反应,其运动后升高幅度可能与运动时间、运动强度有关。在Kim(2012)的研究中,NT-proBNP水平随马拉松完成时间的增加而增加。与此相同,Roncarati等(2014)对业余马拉松运动员进行的研究表明,马拉松的完成时间与运动后hs-TnT和ST2的释放呈正相关,即马拉松完成用时越久,心肌损伤因子的释放越多。与此相反,成年马拉松运动员完成216 km的超马拉松运动后并未呈现cTnT的阳性。在目前的研究报道中,运动时间与心肌损伤标志物释放之间的关系,各研究结果并不一致。Shave(2007)的一项meta分析显示,马拉松运动后cTnT的升高幅度随着运动时间的延长而降低。
Richardson等(2018)的最新研究显示,马拉松运动后cTnT的升高幅度与运动员的训练水平、训练经历等因素无关,而与马拉松中的运动强度(通气阈和V·O2max)显著相关。Legaz-Arrese等证实,在完成比赛用时相同的条件下,平均心率或个体乳酸阈较高的运动员cTnI升高幅度越大。该研究提示,运动强度是影响马拉松运动cTnI释放的重要因素(Legaz-Arrese et al.,2011)。因此,该研究认为,马拉松运动后心肌损伤因子的释放存在运动强度阈值,超过该强度阈值才能造成损伤因子水平的升高(Legaz-Arrese et al.,2011)。
2.2.2 运动训练水平
对业余马拉松运动员进行的研究表明,赛后心肌损伤因子的含量与赛前每周训练成显著负相关。结果提示,赛前的训练准备和水平能够减少心肌损伤因子的释放(Dawson et al.,2013)。Mehta等(2012)对比分析了52名不同训练水平马拉松运动员赛后cTnI的变化情况,结果表明,完成一场伦敦马拉松运动后,两种不同水平的运动员cTnI的含量明显不同。进一步分析发现,过去3年中平均每周跑步里程(马拉松运动员训练水平的一个重要标志)与马拉松后cTnI释放呈负相关。Sahlén等证实,与训练水平较高的运动员相比,训练水平较低的运动员马拉松运动后cTnT的阳性率显著增加,而且cTnT的升高幅度也显著增大(Sahlén et al.,2012)。Nie等(2011)对青少年马拉松运动员进行的研究表明,一场马拉松运动后cTnT的含量与运动年限呈负相关,马拉松运动年限越长,cTnT的含量越低。对比发现,与马拉松运动年限大于3年的选手相比,拥有较低运动经历的选手呈现出更高的cTnT水平。
以上研究均提示,运动后心肌损伤因子的释放与选手从事马拉松运动的年限或者距离有关,提示马拉松运动员的训练水平和经验可能有助于心肌损伤的预防。与高水平和参赛经验丰富的马拉松选手相比,训练水平低和参赛经验不足的选手,更容易遭受运动应激带来的心肌伤害。
2.2.3 年龄
近年研究发现,年龄可能是影响运动后心肌损伤因子释放的重要因素,不同年龄的马拉松运动员运动后心肌损伤因子的释放量不同。Fortescue(2007)的报道显示,年轻马拉松运动员运动后cTnT的释放量显著高于年长运动员。Niemelä(2016)研究发现,与大龄运动员相比(平均年龄38±13岁),马拉松运动后hs-TnT和hs-TnI的升高主要发生于小于30岁的年轻运动员身上,其中小于20岁的运动员升高幅度最大。研究提示,心肌损伤更容易发生于年龄较小的马拉松运动员身上。
2.3 马拉松运动后心肌损伤标志物的恢复
Montiel等(2015)研究发现,马拉松运动后即刻,cTnT和CK-MB的含量均显著高于赛前水平。Grabs等(2015)发现,马拉松运动后即刻cTnT的含量是运动前的4倍,运动后72 h恢复到正常范围。Hanssen(2011)指出,马拉松运动后即刻cTnT和NT-proBNP的含量均显著升高,而通过LGE MRI并未观察到心肌坏死。运动后第2天,两者含量均回落至赛前水平。Knebel(2009)的研究证实,61.8%的马拉松运动员在运动后即刻会经历cTnT和NTBNP的短暂升高,运动后2周恢复正常。Vassalle等(2018)指出,半程马拉松运动后,cTnT和NT-proBNP在运动后即刻均出现显著增加,24 h和48 h后两者分别恢复正常。以上研究表明,马拉松运动后释放的心肌损伤标志物在运动后24~72 h内均能恢复至正常范围。这与其他类型耐力运动诱导的心肌损伤标志物的释放特点类似。它是一种短暂性迅速升高而又快速消除的现象,与临床上心肌坏死诱导的心肌损伤因子升高持续可达十几天的特征明显不同。这也间接佐证了马拉松诱导的心肌损伤与临床疾病造成的心肌损伤是两种性质不同的损伤类型(图2)。
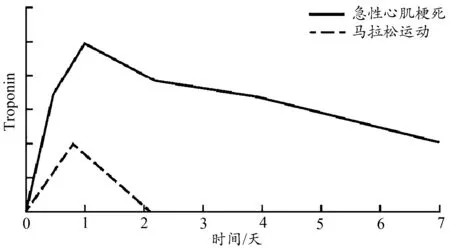
图2 不同状态下循环TnI的变化模式Figure 2. Pattern of Serum Troponin Concentration after Different State
综上所述,马拉松运动诱导的循环中,心肌损伤标志的升高是短暂的和可逆的,是对剧烈运动的一种暂时生理性应激反应。
2.4 马拉松运动后心肌损伤标志物释放的生物学机制
虽然关于马拉松运动后损伤因子的生物学机制仍未达成统一认识,但多数研究认为,马拉松运动后心肌损伤因子的释放与心肌细胞膜的通透性短暂升高有关。目前研究表明,马拉松运动诱导的氧化应激增加、炎症反应和心肌细胞牵张增加等因素,可能是导致心肌细胞通透性增加进而造成心肌损伤因子释放的主要原因。
2.4.1 炎症反应
研究证实,马拉松运动后往往伴随循环中炎症因子的增加。Krzemiński等(2016)发现,马拉松运动后即刻和90 min,血浆中的IL-6、IL-10、IL-18和TNF-α等炎症因子均显著升高,同时伴有左心室功能显著降低。相关分析显示,TNF-α升高与左心室舒张功能下降具有相关性。临床研究表明,心肌损伤标志物的释放往往伴随炎症因子的增加。与此类似,马拉松运动后炎症因子的升高与心肌损伤因子的释放具有时间上的同步性。Grabs(2015)的研究报道显示,马拉松运动后即刻CRP和IL-6的含量分别是运动前的11倍和17倍,cTnI升高4倍,运动后72 h三者均恢复正常。Saravia等(2010)进一步研究发现,马拉松运动后cTnT的释放与炎症标志物(CRP、IL-6)的含量成正相关。然而,Chen等(2013)对业余马拉松运动员进行赛后CMR检查,未发现心肌炎症病灶,但cTnI和NT-proBNP的含量却显著增加。关于马拉松运动后心肌损伤因子的释放与炎症的关系,仍需进一步探讨。
2.4.2 氧化应激
研究发现,一次急性马拉松运动后,ROS和MDA的含量增加,机体处于氧化应激状态(Withee et al.,2017)。持续高水平ROS可造成细胞膜脂质过氧化,从而影响细胞膜的完整性。研究认为,年龄较小的马拉松运动员运动后较高的cTnT增加幅度可能与他们未发育成熟的抗氧化系统有关。因此,一些学者支持马拉松诱导的ROS是cTnT等心肌损伤因子释放的原因的观点,也有学者认为二者并无联系。Howatson(2010)研究发现,抗氧化补剂虽然可以抑制运动性氧化应激,但对马拉松诱导释放的cTnI无明显改善。因此,目前运动诱导的氧化应激与心肌损伤因子释放二者之间的直接关系尚缺乏确凿的证据,仍需进一步研究。
2.4.3 细胞膜通透性改变
正常状态下,TnT和TnI心肌损伤因子在心肌细胞中有2种存在形式,即游离型和结合型。5%~8%的肌钙蛋白存在于细胞胞浆,其余的结合在心肌纤维的细肌丝中。TnI约3%分布在心肌胞浆中,97%与心肌肌丝结合。心肌细胞应激时,游离的肌钙蛋白首先从细胞浆中迅速释放入血,由于其含量较少,在循环中的存在时间较短。结合型的肌钙蛋白从肌原纤维上逐渐分解,释放过程缓慢,在循环中的持续时间较长,且能导致循环中出现较高的肌钙蛋白浓度(Lippi et al.,2010)。由于马拉松运动后即刻cTn能够达到的最大值明显低于急性心肌梗死病人cTn的浓度,且能在运动后24~48 h内恢复至正常水平,据此可推测,马拉松诱导的cTn释放是源自胞浆而非肌原纤维。因此,多数学者认为,马拉松诱导的cTn释放是细胞膜通透性发生改变而引起的胞浆内游离型肌钙蛋白的释放,与心肌细胞坏死引起cTn释放的动力学特征明显不同(Gresslien et al.,2016;Vassalle et al.,2018)。
3 马拉松运动与心律失常
心律失常是指由于心脏活动的起源和(或)传导障碍而造成心脏搏动的频率和(或)节律异常。流行病学调查发现,部分运动员尤其是长期从事大强度运动的耐力运动员的心律失常发生率显著高于普通人群。运动性心律失常已经成为影响运动员比赛成绩和生命健康的重要原因之一。近年来,马拉松运动员心律失常现象受到越来越多的关注。Molina等(2008)对参加巴塞罗那马拉松的运动员进行长达10年的追踪调查后发现,与久坐健康个体相比,马拉松运动员单纯性心房房颤的发生率增加了4倍。Herm等(2017)采用便携式心电记录仪观察了108名业余马拉松运动员运动中的心电情况,结果发现16.8%的运动员具有心电异常的情况,9.3%的运动员至少出现过一次非持续性室性心动过速,7.5%的运动员拥有明显的ST-T段异常。运动后即刻,17%的运动员出现hs-TnT的显著升高。分析国外研究资料发现,心房纤颤是马拉松等耐力运动员的主要类型。Wilhelm等(2012a)发现,安静状态下,马拉松运动员心房尿钠肽前体(pro-atrial natriuretic peptide,pro-ANP)的含量显著高于正常人。通常认为pro-ANP是心房壁张力增加的标志物,与心房纤颤的关系密切。多元回归分析发现,马拉松运动的参加次数是心房重塑的独立预测指标,提示马拉松运动过程中,大强度运动对心房的反复牵拉与心房发生进行性重塑的关系密切,可能是运动性心房纤颤发生的原因。
研究证明,马拉松运动员心律失常的发生和参与马拉松运动的年限和时间等因素有关。Kim等(2016)通过比较有心律失常的马拉松运动员和无心律失常的马拉松运动员发现,前者具有较高的V·O2max、较大的运动强度和较长的运动年限。Herm(2017)进行相关分析发现,马拉松运动员的心电异常与性别、BMI和心血管并发症均无关,而与运动员从事马拉松的年限有关。该研究提示,年龄较高的马拉松运动员更容易出现心律异常的情况。Wilhelm等(2011)根据训练时间将马拉松等运动员分为低训练组(<1 500 h)、中等训练组(1 500~4 500 h)和高训练组(>4 500 h),结果发现运动员P波平均持续时间(心房纤颤的观测指标)从低训练组到高训练组逐渐增加。这一结果提示,运动量是马拉松等耐力运动员心律失常的重要影响因素。
还有研究认为,马拉松运动员心律失常的风险小于健康对照人群。在一项对心血管疾病进行严格筛查和排除的研究中,Grabs等(2015)通过心电图监测发现,安静状态下,无心血管疾病的马拉松运动员(年龄45±8岁)心房早搏和心室早搏的发生风险小于同年龄对照人群。马拉松运动后监测发现,运动员心律失常的发病率不仅没有升高,反而是降低的。同时,研究显示,运动后即刻出现的心肌损伤因子和炎性因子水平的增加与心律失常的发生风险并无直接联系。
综上所述,尽管多数研究支持马拉松运动容易增加心律失常尤其是心房纤颤的发生风险,但近期有部分研究对此提出质疑,认为马拉松运动不会增加心律失常的发生风险。这可能与马拉松运动员筛选条件的严格程度有关,心血管疾病、吸烟和饮酒等健康饮食因素的排除与否对判断马拉松运动是否诱发心律失常至关重要。因此,未来仍需开展筛查条件严格的随机对照试验,予以证实马拉松运动与心律失常之间的关系。
4 马拉松运动与心脏猝死
运动性心脏猝死(exercise related sudden death)定义为:“运动员或进行运动的人在运动中或运动后24 h内发生的意外死亡。”如果运动员具有潜在的心脏疾病,进行大强度运动时,心肌的耗氧量急剧增加,血流对心脏的冲击显著加大,可能造成心肌冠状动脉和心肌供血不足,诱发心脏疾病,导致运动场上猝死事件的发生(常芸,2010b)。调查发现,1976-2006年间,伦敦马拉松、美国多个城市马拉松心脏猝死发生率为1/11.4万,低于一般的运动性心脏猝死发生率(Day et al.,2010)。最近对2007-2016年瑞典近10年一百多万马拉松参赛选手进行的调查发现,马拉松的猝死发生率为0.24/10万。Hart等(2013)分析了2001-2010年全美1 090万注册的运动参与者运动猝死的情况发现,全程马拉松心脏猝死的发生率是1.01/10万,显著高于半程马拉松的心脏猝死发生率(0.27/10万),平均发生率为0.54/10万。同时,研究还发现,男性运动员心脏猝死的发生率显著高于女性,年轻和无心血管风险知识的参赛选手更容易发生心脏猝死。Waite等(2016)对1966-2014年间发表的文献进行系统回顾发现,文献共涉及近四百万马拉松参与者,包括业余爱好者和专业运动员,心脏猝死的发生率在0.6~1.9/10万。我国学者分析了2012-2016年国内官方公布的马拉松心脏骤停案例,心脏骤停率为0.8/10万,猝死率为0.47/10万。可以看出,我国马拉松猝死的发生率低于国外,这可能是因为我国缺乏统一的猝死数据库,发病和猝死记录遗漏或公布缺失(许臻晔等,2017)。
以上流行病学研究显示,马拉松赛事上运动猝死的发生率极低。瑞士学者调查发现,1999-2010年,瑞士年轻人(10~39岁)竞赛性运动中心脏猝死的发生率为0.9/10万,显著高于娱乐性运动时心脏猝死的发生率(0.52/10万),冠状动脉是诱发心脏猝死最常见的疾病(Grani et al.,2016)。研究资料表明,包含所有项目在内的运动性猝死发生率在1~3/10万之间(Harmon et al.,2014)。对比研究发现,与参加一次马拉松相比,在一般生活中,每年过早死亡的风险估计要高出120倍(Maron et al.,1996)。4 h伦敦马拉松参赛造成的心脏猝死风险与2 h摩托车骑行的风险相同,或与10 h自行车骑行的风险相同,或与28 h乘车、乘坐飞机的风险相同。因此,从流行病学角度来看,马拉松期间的猝死比媒体所感受到的威胁更小(Day et al.,2010)。
多数马拉松运动猝死的发生和运动者遗传的显性或隐性心脏疾病有关。大强度运动作为一种诱发因素,引起心肌急剧的血流变化和短暂的心肌缺氧。这可能诱发了心脏疾病的发生,导致运动性心肌猝死(Cheung et al.,2016)。研究表明,肥厚性心肌病(36%)、冠状动脉异常(17%)、左心室肥厚(6%)、心肌炎(8%)、右心室心肌病(4%)等心脏遗传疾病,均和运动导致的心肌猝死关系密切,是竞技运动员猝死发生的前几位心血管遗传疾病,而运动性猝死的运动员心脏结构正常的仅占3%。在马拉松诱导的心脏猝死中,冠状动脉异常可能是主要原因。伦敦马拉松心脏骤停的14个案例中,11个是由于冠状动脉疾病;在一系列美国城市马拉松心脏猝死案例中,81%的心脏猝死是由于冠状动脉异常(Day et al.,2010)。因此,做好赛前心血管疾病的筛查,尤其是冠状动脉异常的筛查,对预防马拉松赛场心血管事件意外的发生尤为重要。
5 马拉松运动员赛场心血管意外的防控
尽管心源性猝死(sudden cardiac death,SCD)在马拉松运动员中的发生概率极低,但这并不能减轻每一次马拉松运动员死亡的悲剧,也不应成为忽视风险预防的借口。过去的十多年间,随着参与马拉松等长时间、高强度运动的人数逐年增加,运动性心脏猝死的人数正逐渐增加(Kim et al.,2012)。因此,如何预防马拉松赛场上的心脏意外,保障运动人群的生命健康安全,显得愈发重要。为预防运动性猝死,国外学者建议建立预防运动性猝死的二级预防体系。因此,为预防马拉松赛场的心血管意外,也应建立相应的二级预防体系。
5.1 一级预防:建立赛前心血管风险评估和筛查程序
运用现有医学技术和手段对运动员与健身人群进行心脏筛查,防范运动性心脏猝死,是目前行之有效的方法。美国心脏学会提倡采用包含14项病史和身体检查(history and physical examination,H&P)的建议,而欧洲心脏学会建议采用H&P检查结合12导联ECG的方案(Kerkhof et al.,2016)。有研究报道,采用心动超声技术结合H&P和ECG能有效评价运动员的心脏健康状态,增加疾病检出的正确率(Yim et al.,2014)。美国心脏学会不建议采用ECG对运动员的心肌疾病进行筛查,认为其具有较高的假阳性,10%的心肌肥厚、20%的ARVC和25%的长QT综合征常表现为正常的ECG。另外,静息ECG是马拉松心脏猝死中占比较高的冠状动脉异常,假阳性出现率更高(Eijsvogels et al.,2016)。
意大利对年轻运动员(12~35岁)推广的赛前心脏筛查项目对所有年轻人是强制性的,马拉松比赛前必须提供完整的检查报告。第1层评估涉及历史(包括家族史)、体检和12导联ECG。如果没有发现异常,运动员即有资格参加比赛。那些有阳性提示的运动员,将进行进一步的调查。第2层检查包括运动平板试验、24 h动态心电图、心脏核磁共振等检测。如果第2层的评估没有发现心血管疾病的证据,运动员就有资格参加比赛。如果出现异常,运动员将被禁止参赛(Corrado et al.,2005)。针对老年人参加像马拉松等高强度竞赛项目,欧洲心血管疾病预防和康复学会制订了更严格的筛查标准,初级检查包括4项必选项目:病史、身体检查、系统冠状动脉危险评分(根据10年内心血管事件的发生情况)和静态ECG。初次检查未通过的需要进一步做最大运动心电图压力测试,若获得通过则可参加中高强度的竞赛项目。如若仍是阳性,则需要进一步评估并制订合适的治疗措施和个性化的体力活动处方(Borjesson et al.,2011)。有学者指出,近年来欧洲各国举办的马拉松赛场心脏猝死事件罕有发生,这可能与欧洲各国严格的筛查程序以及赛事举办方严格执行上交体检报告具有一定的关系(Sweeting et al.,2018)。
据目前我国马拉松猝死发生的统计资料,心源性猝死是主要原因,凸显了我国马拉松赛前心血管风险检查的必要性和紧迫性(常芸,2013)。然而,我国对运动人群赛前心血管风险筛查的标准仍未达成共识。这是因为,专家共识应该建立在高质量的马拉松人群猝死流行病学调查研究基础之上,而目前仅有体育领域的学者做过这方面的少量研究。体育领域学者受制于医学知识的不足,研究分析缺乏深度。与国内形成鲜明对比的是,国外医学者对马拉松运动员心脏健康和猝死方面的研究关注度较高,如美国心脏协会和欧洲心脏协会在深入研究基础上提出了赛前心血管筛查标准。受传统思想的影响,我国医学界注重治“已病”,而忽视“未病”人群,对健身人群关注不足,亟须体育届和医学届心脏方面的专家学者共同努力,加强“体医融合”,协同攻关,制订我国马拉松赛前体检的心血管风险筛查标准,形成详细的检查流程和规范,为马拉松运动员和爱好者的身体健康与生命安全提供保障。
5.2 二级预防:增加并合理布置赛中救助力量
马拉松比赛期间,专业的急救设备、科学的抢救手段和快速的应急反应,对预防赛场心脏猝死的发生至关重要。心脏骤停的抢救高度依赖快速应急反应时间。因此,增加赛场急救点的密度,以便救援者能迅速到达救援现场。国内研究资料显示,15~20 km赛段和全程马拉松最后2 km是心脏骤停高发区域。分析全程马拉松、半程马拉松、10 km和5 km马拉松等多种比赛发现,心脏骤停往往集中于各赛程的最后1/5赛段。国外研究也表明,35~42 km处是马拉松猝死的高发路段,接近终点的3 km处是马拉松心脏猝死发生率最高的地方。因此,应根据心脏骤停和猝死发生的风险地段,合理优化急救固定岗的设计。现有资料显示,我国目前急救点的设置与实发案例尚不完全匹配,尤其应加大距离终点前2 km高发路段人员、设备等救援力量的密度(许臻晔等,2017)。
美国海军陆战队马拉松的成功救援经验表明,对心脏骤停进行成功除颤要在宝贵的“黄金4分钟”内实现,需要设置包括医生、医护人员和紧急医疗技术人员在内的快速反应小组,同时配备充足的自动体外除颤仪(automated external defibrillator,AED),每3~5 km间隔设置医疗救助站并配备AED。另外,美国海军陆战队赛场救援还部署了骑自行车和高尔夫球车的移动救援小组,并配备了AED。研究表明,心脏骤停后若要实现1~2 min内除颤,需要满足以下条件之一:每200~300 m就有配备AED的生命保障人员,或大量流动快速反应巡逻,可以进入整个赛段(Day et al.,2010)。目前,我国多数马拉松除了安排医生、医护人员、巡逻救护车等常规救援外,在成功救援的案例报道中,均设置了急救配速员岗,全马60~100名。他们是掌握了基本急救技能的志愿者,其机动性为固定救援站提供了良好的补充(许臻晔等,2017)。
6 总结
1)与其他耐力项目一样,马拉松运动会导致心脏出现离心性肥大,心房和心室腔体积均会增大,提升心脏的射血功能。一次马拉松运动后,心房和左、右心室的收缩与舒张功能均出现了短暂性下降,尤其是舒张功能下降更明显。这是心脏的一种生理适应,随后数周内可恢复至正常水平。
2)尽管关于马拉松运动与冠状动脉风险之间的关系仍存在争议,但与同龄和相同心血管风险因素的对照人群相比,马拉松运动员仍具有较低的冠状动脉斑块形成风险。
3)马拉松运动诱导的循环中心肌损伤标志的升高是短暂和可逆的,是一种对剧烈运动的暂时生理性应激反应。氧化应激增加,炎症反应和心肌细胞通透性增加,可能是马拉松运动后心肌损伤因子释放的主要原因。
4)马拉松运动猝死的风险较低,多数马拉松猝死的发生和参赛者遗传的显性或隐性心脏疾病有关。为预防赛场心血管意外,应该建立马拉松赛场心血管意外的预防体系,包括赛前心血管风险评估和筛查程序、增加并合理布置赛中救助力量。
