蚓粪中高效促腐除臭微生物的分离与筛选
2020-06-22朱庆辉王嘉琪徐伟钢胡冰洁崔京珍
成 钢,朱庆辉,王嘉琪,徐伟钢,胡冰洁,崔京珍,赵 铭
(1.湖南文理学院动物学湖南省高校重点实验室/环洞庭湖生物资源保育与利用研究中心/湖南文理学院动物健康养殖研究所,湖南 常德 415000;2.湖南省常德市安乡县雄韬牧业有限公司,湖南 常德 415000)
【研究意义】为了充分利用蚓粪特质及蚓粪中天然微生物群落减轻养殖废弃物对环境的污染,实现肉羊粪尿高效腐熟与发酵。【前人研究进展】蚯蚓粪是蚯蚓消化分解有机废弃物产生的具有较高孔隙度富含大量微生物菌群的颗粒状物质,为了拓宽畜禽粪便无害化和资源化利用的渠道,国内外学者从蚓粪理化性质、添加蚓粪到畜禽粪便中进行好氧堆肥发酵及效果测定等方面进行过相关研究[1-4]。虽然从不同类型蚓粪中筛选到一些有益微生物,但在微生物的数量、类型和特异性方面还存在较多问题[5-6]。【本研究切入点】试验以研发羊粪专用促腐与除臭微生物为切入点,从羊粪养殖蚯蚓后产生的蚓粪中分离和筛选高效促腐与除臭微生物。【拟解决的关键问题】拟解决当前羊粪发酵腐熟影响因素较多,堆肥腐熟时间长、有害气体释放多、二次污染严重效率低下,以及堆肥腐熟发酵缺乏专用高效发酵与除臭复合菌剂的问题。
1 材料与方法
1.1 材料
试验用白菜种子、羊粪、新鲜蚯蚓粪由湖南省常德市雄韬牧业有限公司提供。葡萄球菌、牛肉膏、蛋白胨、可溶性淀粉、硫酸镁、硫酸亚铁、磷酸氢二钾、磷酸二氢钾、葡萄糖、孟加拉红、链霉素、乙酸锌、乙酸钠等药品、pH计等由湖南文理学院生命与环境科学学院动物科学专业实验室提供。
1.2 方法
1.2.1 耐氨、耐硫微生物的培养与富集 以常规牛肉膏蛋白胨培养基、高氏一号培养基、马丁氏液体培养基为对照,在上述3种培养基中,分别加入10、15、20 μl,25 %氨水和0.5 mol/L浓度的 Na2S溶液,将羊粪养殖蚯蚓后产生的新鲜蚓粪用无菌水稀释成浓度为10-2~10-5的水溶液,取每个滴度稀释液100 μl分别加入上述含有氨水和Na2S溶液的3种液体培养基中,牛肉膏蛋白胨培养基于37 ℃,高氏一号培养基和马丁氏培养基于28℃条件下摇菌12~48 h,富集耐氨、耐硫微生物,用于进一步高效促腐与除臭微生物的分离和筛选。
1.2.2 高效促腐微生物的初筛与复筛 分别制备牛肉膏蛋白胨、高氏一号、马丁氏固体平板培养基,每种培养基表面分别涂布100 μl 浓度为15 %氨水溶液和0.5 mol/L浓度的 Na2S溶液,取上述富集保种微生物,摇菌过夜复苏稀释后,采用平板涂布法按1.2.1中培养条件培养细菌、放线菌和真菌,定期观察记录培养皿中菌落生长情况,根据培养皿中菌落的形态和数量,挑选菌落单一、数量较多、特征明显的微生物进行分类、纯化、编号和保种。运用瓶装腐熟发酵法,挑选20种初筛后微生物制备菌液与新鲜羊粪混合,搅拌混匀后分装于550 mL 矿泉水瓶中,装量600 g/瓶,每种微生物设置在羊粪中的浓度为1×106、2×106和3×106个/g,以新鲜羊粪为空白对照,每种浓度重复3瓶,在(32±3)℃条件下腐熟发酵42 d,定期观测腐熟温度、pH值、色泽、疏松度、种子发芽指数(GI)等指标,感官评级法对瓶内臭味进行评定,并对数据统计分析[7]。
1.2.3 综合促腐效果验证 采用瓶装腐熟发酵法在上述初筛、复筛的基础上,挑选在温度、GI值等腐熟指标较为突出的5~6 种促腐微生物,分别制备菌液,以3×106个/g浓度添加到新鲜羊粪中,以新鲜羊粪为空白对照,以添加相同浓度大肠杆菌的新鲜羊粪为阴性对照,每个处理重复3瓶,在在(32±3)℃条件下腐熟发酵42 d,定期观测和比较单一菌液和混合菌液瓶内的腐熟温度、pH值、色泽、疏松度、气味、GI值等指标,并对数据统计分析。羊粪腐熟判定:瓶内羊粪温度趋于环境温度,色泽变为黑色,无刺激性气味,粪粒疏松柔软,pH呈弱碱性,含水率≤20 %,GI值≥80 %[8]。
1.2.4 高效除NH3和H2S气体微生物的初筛 挑选20株耐氨耐硫微生物分别接种于液体培养基,培养后得到高浓度菌液。分别将100 μl浓度为1×108个/mL的菌液滴加到直径2 cm滤纸片上,放入预先注入30 μl浓度为25 %氨水的瓶中进行氨气的吸收试验,以添加不含微生物的培养基为空白对照,以相同浓度的葡萄球菌液为阴性对照,在放置24 h后抽取50 mL瓶内气体于硫酸吸收液中充分吸收,利用纳氏分光光度法分别测定各瓶中NH3气体含量,根据各微生物对瓶内NH3气吸收值,初步筛选对NH3有利于消除能力的微生物。分别取10 mL浓度为1×108个/mL的菌液与100 g羊粪混合,以新鲜羊粪为空白对照,以添加相同浓度的葡萄球菌液为阴性对照,分别在放置24、48和72 h后抽取50 mL瓶内气体于20 mL乙酸锌乙酸钠吸收液中进行充分吸收,利用碘量法测定各瓶中H2S气体含量,根据对瓶内H2S气吸收值初步筛选对H2S具有吸收能力的微生物。
1.2.5 综合除NH3和H2S气体效果验证 挑选初筛对NH3和H2S气体吸收能力较强的7~9 种微生物单独制备菌液,以1×108个/mL的浓度分别在200 g/瓶新鲜羊粪中添加5、10、15 mL混合均匀后进行综合除臭效果验证,运用瓶装腐熟发酵法,以新鲜羊粪为空白对照,每个处理重复3瓶,在室温下放置3 d,每日取各瓶中50 mL气体分别于硫酸吸收液和乙酸钠吸收液中各25 mL,令其充分吸收,用纳氏试剂风光光度法测定NH3含量,用碘量法测定H2S的含量, NH3或H2S气体每日去除率=(空白组浓度-处理组浓度)/空白组浓度×100 %, NH3或H2S气体平均去除率为3 d 内每日NH3或H2S气体去除率均值,记录结果并对数据进行分析。
1.2.6 高效促腐除臭微生物的初步鉴定 对1.2.5中进一步验证有除臭功能的微生物进行培养,根据固体培养基中菌落、菌丝形态、生长特征及染色镜检结果进行形态学初步鉴定。
1.2.7 数据统计分析 采用 Microsoft Excel 2010软件对促腐温度与GI值数据进行F检验中组间无重复双因素方差分析;对除臭数据进行组间单因素方差分析,用Duncan法对各组间平均值进行多重比较,试验结果采用字母标记法;以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 耐氨、耐硫微生物富集结果
羊粪为基料养殖蚯蚓后蚓粪中分离细菌、放线菌和真菌的最适稀释梯度均分别为10-4、10-4和10-3。从表1可知,蚓粪中细菌、放线菌和真菌种类和数量随着培养基中氨水添加浓度的增加而降低,试验以添加0.5 mol/L浓度Na2S处理和添加25 μl氨水处理培养的细菌、放线菌和真菌作为耐氨、耐硫微生物,用于后续高效促腐与除臭微生物分离与筛选。
2.2 促腐微生物的初筛与复筛结果
以腐熟温度、pH值及GI值为主要观测指标,从新鲜蚓粪中共分离、筛选获得4、7、8、11和12号共5株对羊粪具有显著促腐效果的微生物,且随着微生物菌剂浓度的升高各处理瓶中的白色菌丝逐渐增多,添加以上5株微生物的处理瓶内无刺激性气味,羊粪颜色变为黑褐色,质地疏松柔软(表2和图1)。
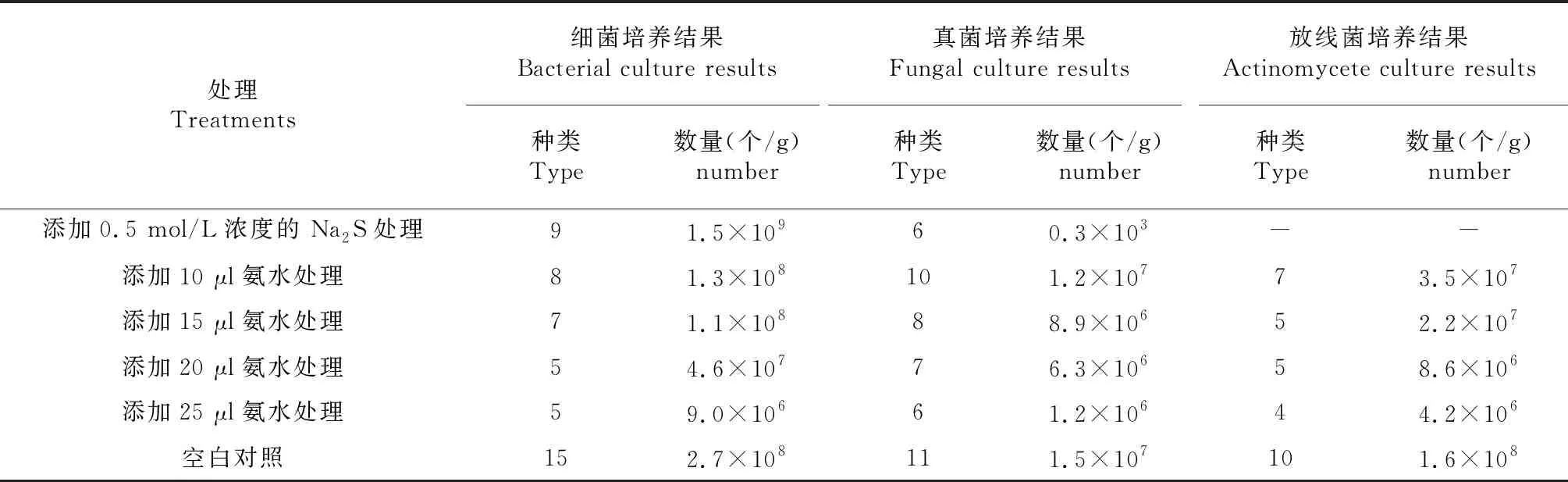
表1 不同处理对蚓粪中微生物种类和数量影响结果
注:“-”表示未培养出放线菌。
Note: ‘-’ means that no actinomycetes have been cultured.

表2 5种微生物对羊粪腐熟发酵效果
注:表中“-”代表未发现菌丝;“+”代表羊粪粒具有一定的疏松度,发酵腐熟效果一般;“++”代表羊粪粒较松散,发酵腐熟较好;“+++”代表羊粪粒开裂程度较大松软,发酵腐熟效果好。
Note: The ‘-’ in the table indicates that no mycelium is found; ‘+’ indicates that the goat manure has a certain degree of looseness, and the effect of fermentation is poor; ‘+ +’ indicates that the goat manure is relatively loose, and the fermentation is better; ‘+ + +’ indicates that the cracking degree of the goat manure is relatively soft, and the effect of fermentation is good.

图1 不同微生物与羊粪混合发酵第10天各瓶中的菌丝生长情况Fig.1 Growth of hyphae in different bottles on the 10th day of mixed fermentation of different microorganisms and goat manure
2.3 综合促腐效果验证结果
2.3.1 5种微生物对羊粪腐熟发酵温度的影响 温度是影响羊粪腐熟发酵的重要因素,从图2~3可知,添加微生物菌液各瓶中羊粪经历了3次温度较大的变化:各处理瓶内温度均在第6~8天内快速上升至35 ℃左右,与环境温度相差(3±2)℃;腐熟发酵第18~24天,各实验瓶内温度均在此期间达到40 ℃以上,较空白对照高2~5 ℃,与环境温差5~7 ℃,腐熟发酵第34~36天,各处理瓶内温度均高于空白对照1.5~6 ℃,加入混合菌液腐熟发酵第36天瓶内温度较空白对照组高6 ℃;腐熟发酵35 d后,各处理堆肥温度迅速下降,并趋于环境温度。取各组处于高温腐熟发酵阶段时期温度均值进行无重复双因素方差分析,结果处理组与空白组差异显著(P<0.05),处理为有效处理,即在羊粪中添加筛选出的微生物对羊粪腐熟发酵的温度有影响。
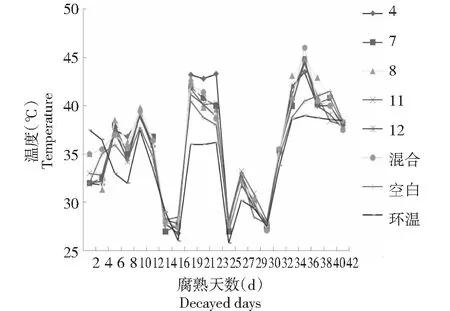
图2 5种微生物发酵42 d间温度观测结果Fig.2 Temperature observation results of 5 kinds of microorganisms during 42 days fermentation
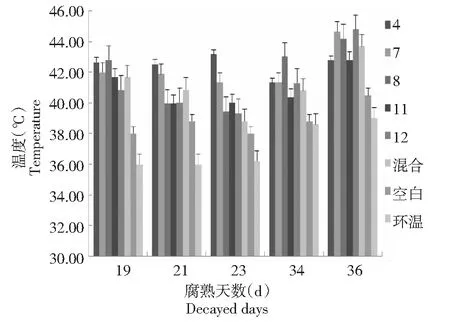
图3 5种微生物不同发酵腐熟阶段温度观测比较Fig.3 Temperature observation and comparison of five microorganisms in different fermentation and maturity stages
2.3.2 不同微生物对羊粪腐熟发酵pH值的影响 试验每隔2 d对各处理瓶内羊粪进行pH值运用pH计进行测定,各瓶pH值变化曲线与各瓶温度变化水平相一致。发酵初期,各瓶内pH值均上升,可能与此期羊粪中可利用氮较多,微生物生长繁殖较快,生成较多氨类复合物所致;随着微生物活动,有机酸含量增加,发酵至14 d左右,各处理瓶内pH值下降至8.5左右;腐熟发酵至21 d,随着瓶内微生物分解,以及含氮有机物所产生氨的堆积,致使瓶内pH值又开始上升;发酵腐熟结束时,各处理pH值在7.91~8.33,均符合羊粪腐熟的pH值标准。取各组pH值均值进行无重复双因素方差分析,结果各处理组与空白组差异显著(P<0.05),处理为有效处理,即在羊粪中添加筛选出的微生物对羊粪腐熟发酵时期的pH值有影响(图4~5)。
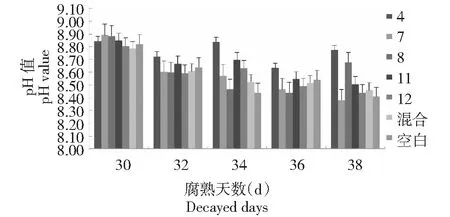
图5 5种微生物不同发酵腐熟阶段pH值Fig.5 pH value of five microorganisms in different fermentation and maturity stages
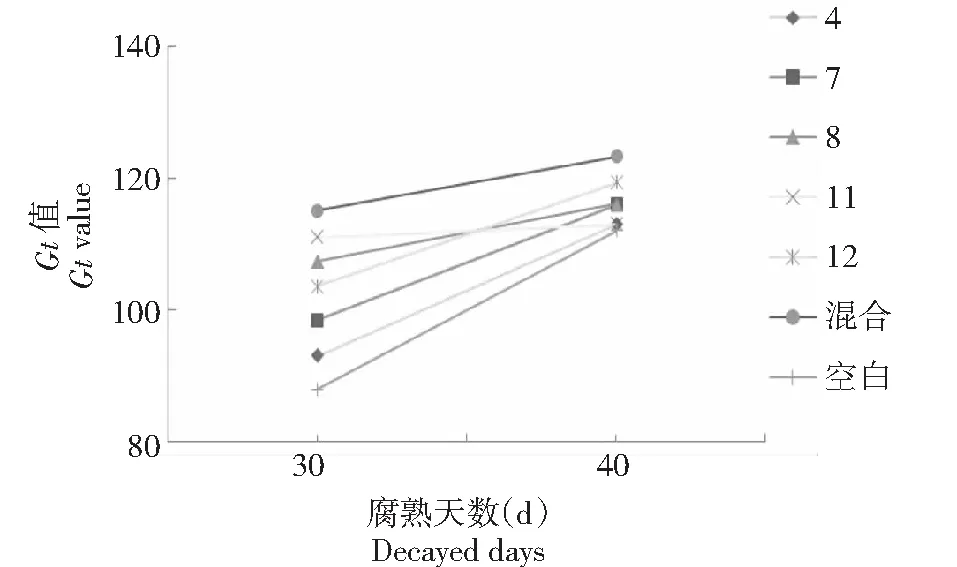
图6 5种微生物单一与混合菌液与羊粪发酵GI值 Fig.6 GI value of single and mixed bacterial liquid and goat manure fermentation of five microorganisms
2.3.3 不同微生物对羊粪腐熟发酵GI值的影响GI值是评价发酵堆料毒性最直观、有效的参数指标之一。各处理腐熟的GI值在发酵30 d后均呈上升趋势,发酵腐熟30 d时,各处理瓶的GI值均大于80 %,说明各处理瓶内的羊粪均趋于腐熟,其中各试验组GI值在发酵第30和40天期间,GI值均大于空白对照组;腐熟40 d,添加混合菌液的GI值为123.33 %,分别较空白处理瓶和对照处理瓶高16.66 %和12.33 %,腐熟效果最好(图6)。
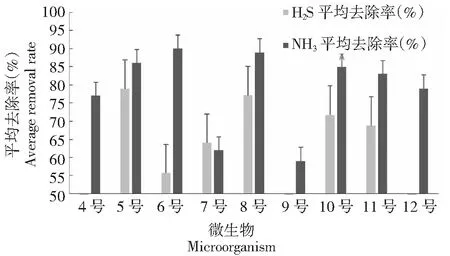
图7 筛选获得的微生物对NH3或H2S气体平均去除率Fig.7 Average removal rate of NH3 or H2S gas by microorganism selected
2.4 除臭微生物分离筛选结果
从20株耐氨耐硫微生物中初筛获得10种对NH3或H2S气体有一定吸除能力的微生物,运用瓶装腐熟发酵法,综合除NH3和H2S气体效果验证,获得7株对NH3具有显著吸除作用的微生物,其中细菌4株、真菌3株,与空白对照相比,在3 d内对NH3的平均去除率分别为77 %、86 %、90 %、89 %、85 %、83 %和79 %;获得5株对H2S具有显著吸除作用的微生物,其中细菌3株、真菌2株,对H2S的去除率分别为78 %、63 %、77 %、71 %和68 %;既除氨和除硫的微生物有6株,对两者去除率均达 60 %以上。由于时间与不同处理均可能对促腐过程中臭气释放量产生影响,因此,对数据进行无重复双因素方差分析,处理间差异极显著(P<0.01),处理为有效处理(图7)。
2.5 除臭与促腐微生物的形态学鉴定
将经过初筛、复筛和综合除臭腐熟实验验证的具有除臭促腐功能的细菌和真菌分别采用简单染色和无菌水制片方法进行镜检,其中包括7种细菌和3种真菌(表3和图8)。
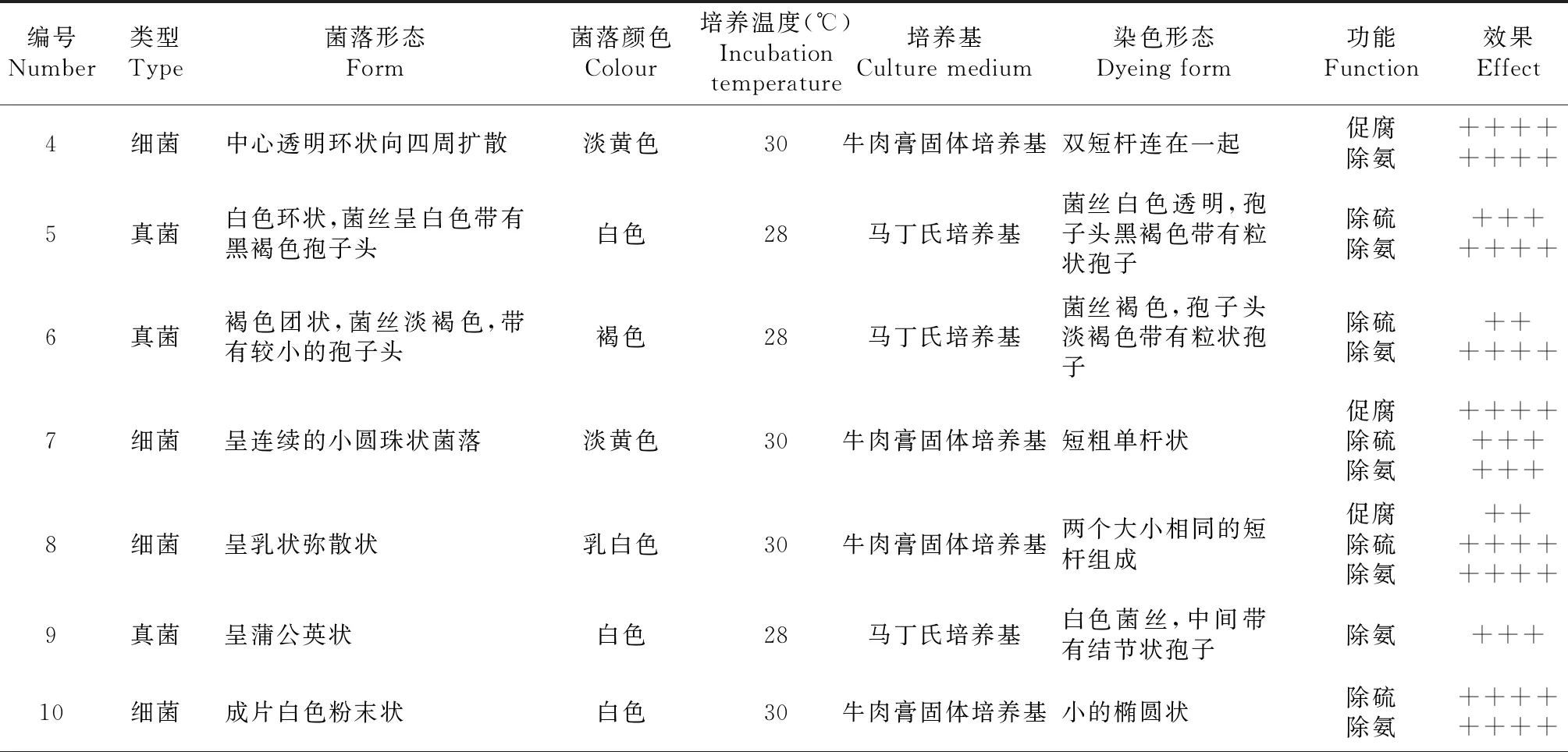
表3 筛选后的除臭或促腐微生物培养生长特性及功能
续表3 Continued table 3
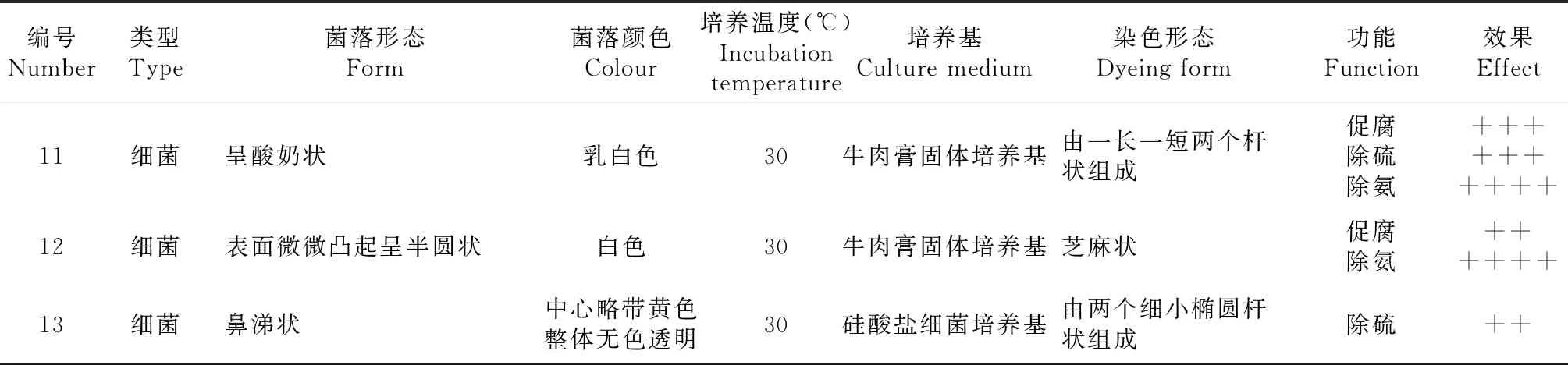
编号Number类型Type菌落形态Form菌落颜色Colour培养温度(℃)Incubation temperature培养基Culture medium染色形态Dyeing form功能Function效果Effect11细菌呈酸奶状乳白色30牛肉膏固体培养基由一长一短两个杆状组成促腐除硫除氨++++++++++12细菌表面微微凸起呈半圆状白色30牛肉膏固体培养基芝麻状促腐除氨++++++13细菌鼻涕状中心略带黄色整体无色透明30硅酸盐细菌培养基由两个细小椭圆杆状组成除硫++
注:“++”表示有一定的促腐或除NH3或除H2S能力;“+++” 表示促腐或除NH3或除H2S能力较强; “++++” 表示有促腐或除NH3或除H2S能力显著。
Note: ‘+ +’ indicates that there is a certain ability to promote or remove NH3or H2S; ‘+ +’ indicates that there is a strong ability to promote or remove NH3or H2S; ‘ + +’ indicates that there is a significant ability to promote or remove NH3or H2S.
4 讨 论
优化培养基及筛选条件是影响筛选效果的关键,试验采用先建立耐氨、耐硫微生物库的方法,通过初筛、复筛和综合促腐效果验证等步骤,从羊粪养殖蚯蚓后产生的蚓粪中分离和筛选高效促腐微生物,较常规筛选方法具有一定的科学性和可行性,缩小了筛选范围,并取得了较好的筛选结果,为今后从各类畜禽粪便中筛选高效促腐除臭微生物具有一定的借鉴价值。温度、pH值和GI值3项指标是影响畜禽粪便腐熟发酵效果的重要因素[9]。试验结果表明:添加微生物菌液各瓶中的温度在腐熟发酵第18~24天和第34~36天变化幅度较大,均显著高于空白和阴性对照组,与此期间添加微生物试验组瓶内pH值变化相吻合,说明添加的5种微生物参与瓶内羊粪氨类复合物和有机酸合成与分解过程,并对瓶内羊粪腐熟发酵过程中pH 值有一定调节功能;添加微生物的各处理瓶GI值均大于对照组,进一步证明了在新鲜羊粪中添加适当比例上述微生物能够加速分解羊粪中的有害物质,促进腐熟进程。进一步结果表明,随着添加微生物浓度的增加,羊粪发酵腐熟效果增强,且混合菌液较单一微生物菌液对羊粪促腐发酵效果显著,说明以上5种微生物之间有一定的协同促腐作用。纳氏试剂分光光度法与碘量法是检测空气或水体中氨、氮与H2S含量的一种灵敏且常用的方法[10-11],试验对除NH3和除H2S微生物的初步筛选采取不同的策略,由于H2S气体不易制备和定量,试验采用新鲜羊粪作为H2S气体源进行筛选,虽然存在一定的误差,但最终在综合效果验证中得到证明。综上所述,试验从新鲜蚯蚓粪中筛选获得10株对羊粪具有促腐和除臭功能的微生物,为了进一步利用以上天然微生物促进羊粪腐熟发酵及除臭,试验已开展对上述微生物拮抗和组合功能试验工作,并已取得相关进展。

图8 分离筛选的促腐与除臭微生物形态学染色观察Fig.8 Morphological staining observation of microorganisms for promoting and deodorizing
