黄樟叶的显微和薄层鉴别研究
2020-06-21王鹤李海胜安婷婷
王鹤 李海胜 安婷婷
摘要 [目的]制定黄樟叶质量标准中的显微鉴别和薄层鉴别。[方法]通过显微鉴别,对黄樟叶横切面及其粉末进行观察,鉴别其组织或结构特征等。对照药材法进行薄层鉴别,并进行方法验证。[结果]显微镜所见细胞壁、叶肉栅栏组织、主脉维管束、薄壁细胞和油细胞。薄层色谱的展开条件为乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5),点样量为5 μL,置于365 nm处检视。此薄层条件各斑点清晰,分离效果理想,重复性和稳定性良好。[结论]显微鉴别和薄层色谱鉴别均可列入黄樟叶的质量标准。
关键词 黄樟叶;显微鉴别;薄层色谱鉴别
中图分类号 R282.5文献标识码 A文章编号 0517-6611(2020)11-0182-04
Abstract [Objective] The research aimed to identify the microscopic identification and TLC of Cinnamomum porrectum leaves.[Method] Through microscopic identification, observed the cross section of Cinnamomum porrectum leaves and its powder to identify its tissue or structural characteristics.The thin layer identification was conducted against the medicinal material method, and the method was verified.[Result]Microscopic observed cell wall, mesophyll palisade tissue, main vein, vascular bundle, parenchyma cell and oil cell.The conditions for the development of TLC were ethyl acetatechloroformformic acid(5∶2∶0.5), and the sample size was 5 μL, which was examined at 365 nm.This conditions had the advantages of clear spots, ideal separation effect, good repeatability and stability.[Conclusion]Microscopic identification and TLC can be used for the quality standard of Cinnamomum porrectum leaves.
Key words Cinnamomum porrectum leaves;Microscopic identification;TLC
黄樟Cinnamomum porrectum (Roxb.)Kosterm,又名南安、香喉、山椒等,分布于我国海南、广东、广西、福建、江西、湖南、贵州、四川、云南等地,以及巴基斯坦、印度经马来西亚至印度尼西亚等国家。黄樟性温,味辛、微苦,归肺、脾、肝经;具祛风散寒、温中止痛、行气活血的功效,民間用于治疗风寒感冒、风湿痹痛、胃寒腹泻、泄泻、痢疾、跌打损伤、月经不调等症[1]。黄樟叶为黄樟干燥叶,精油率比较高,一般为2%~5%[2-3]。目前《中国药典》2015年版一部尚无黄樟叶质量标准,因此制定黄樟叶质量标准,有利于医药部门对其质量的监控,确保用药安全。笔者从黄樟叶的显微鉴别、薄层色谱鉴别方面进行研究,制定药材的质量标准,保证药材的质量,保证其应用安全有效。
1 材料与方法
1.1 材料
1.1.1 仪器。
中草药粉碎机(FW100);二号药典筛(浙江上虞市英超仪器经营部);四号药典筛(浙江上虞市英超仪器经营部);电子天平(岛津AUW220D);光电显微镜(50i尼康);尼康相机(P7100);水纯化系统(Milli-Q Integral);数显恒温水浴锅(HH-4);硅胶G板(规格:100 mm×200 mm,20150912);薄层层析硅胶板si60(HC30863956);薄层色谱展开缸(规格:100 mm×200 mm);三用紫外分析仪(WFH-203)。
1.1.2 试剂与药材。
水合氯醛(批号30037517,国药集团化学试剂有限公司);甘油(批号0904102,汕头市西陇化工厂有限公司);醋酸(批号20131002-2,广州化学试剂厂);盐酸(批号20140406-1,广州化学试剂厂);乙醇(95%)(批号20150601-2,广州化学试剂厂);无水乙醇(批号20151003-2,广州化学试剂厂);甲醇(批号150106 1,西陇化工股份有限公司);乙酸乙酯(批号20150901-2,广州化学试剂厂);三氯甲烷(批号20130702-2,广州化学试剂厂);甲酸(批号140919 2,西陇化工股份有限公司);所有试剂均为分析纯。黄樟叶对照药材(自制)。
1.2 方法
1.2.1 黄樟叶显微鉴别[2]。
1.2.1.1 横切面制片。
取黄樟叶干燥药材在水中浸软,切片,滴加水合氯醛透化,再滴加几滴甘油醋酸,盖上盖玻片,制成临时切片,对叶横切面进行显微观察、描述、拍照[4]。
1.2.1.2 粉末制片。
取少量黄樟叶粉末(过四号筛)于载玻片上,滴加2~3滴水合氯醛试液,在酒精灯上灼烧透化,重复滴加几次试液使粉末充分透化。再滴加几滴甘油醋酸,盖上盖玻片,滤纸擦去盖玻片以外的残液,再置于光电显微镜下观察。
1.2.2 黄樟叶薄层鉴别。
1.2.2.1 薄层鉴别[5]。
精密称取黄樟叶粉末(过二号筛)2 g,加20 mL 60%乙醇,加热回流1 h。过滤,滤液蒸干,残渣加甲醇使溶解并移至10 mL容量瓶中,定容,作为供试品溶液。另取黄樟叶对照药材粉末(过二号筛)2.0 g,同法制成对照药材溶液。取上述2种溶液各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视[6-7]。
1.2.2.2 方法学验证。
按表1制备黄樟叶供试品溶液。
专属性:分别取供试品溶液1、对照药材溶液、甲醇各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视[8-10]。
最低检出限:取供试品溶液1各1、2、4、6、8、10 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视。
稳定性:分别取对照药材溶液、供试品溶液1、供试品溶液2、供试品溶液3各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视。
重复性:分别取供试品溶液1、对照药材溶液各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视。同一实验人员重复上述操作3次,不同实验人员重复上述操作2次。
耐用性1(不同提取方法):取上述供试品溶液4~9、对照药材溶液各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视。
耐用性2(不同展开剂):取供试品溶液1、对照药材溶液各5 μL,分别点于同一硅胶G薄层板上,将展开剂的比例依次调节如下:乙酸乙酯-三氯甲烷-甲酸(4∶2∶0.5)、乙酸乙酯-三氯甲烷-甲酸(5∶1.6∶0.5)、乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.4)、乙酸乙酯-三氯甲烷-甲酸(6∶2∶0.5)、乙酸乙酯-三氯甲烷-甲酸(5∶2.4∶0.5)、乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.6)。
耐用性3(不同厂家薄层板):分别取供试品溶液1、对照品药材溶液各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视。
耐用性4(温湿度的影响):分别取供试品溶液1、对照品药材溶液各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-三氯甲烷-甲酸(5∶2∶0.5)为展开剂,不同温湿度(20 ℃,30%;25 ℃,50%;25 ℃,60%),取出,晾干,置紫外灯(365 nm)下检视。
2 结果与分析
2.1 显微鉴别结果
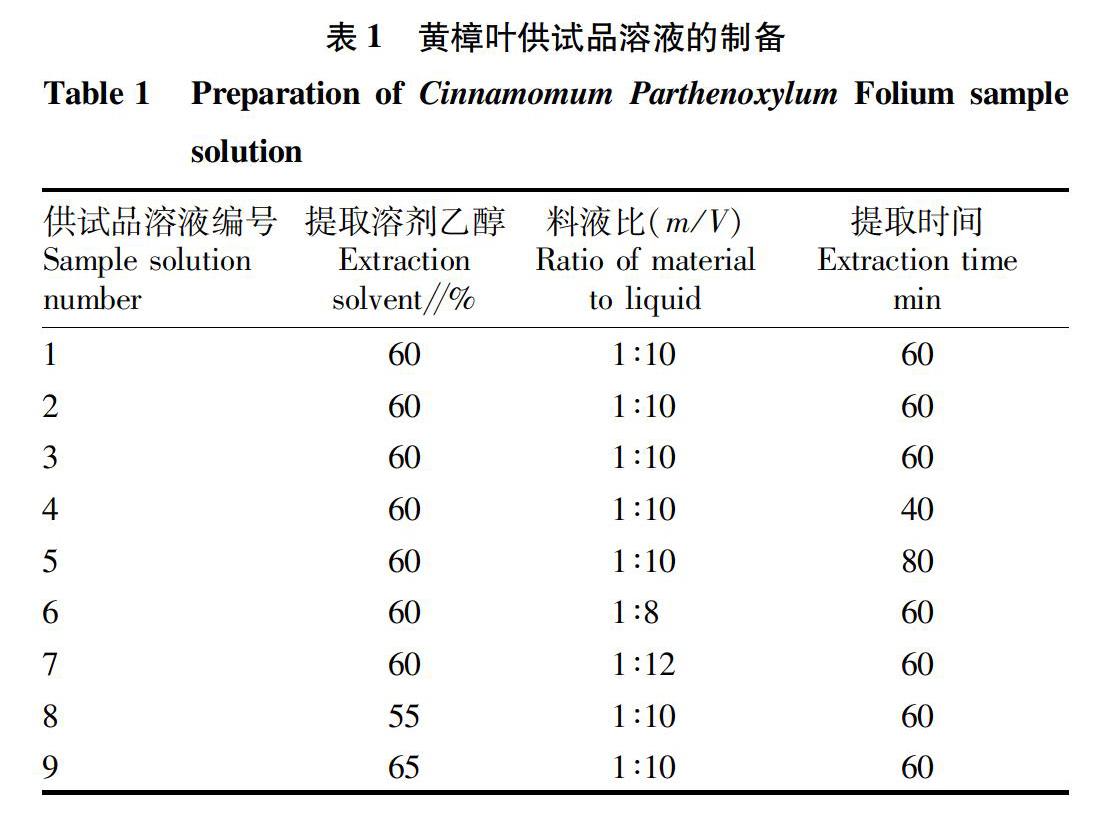
2.1.1 叶横切面。
上下表皮各一列细胞(图1),细胞壁明显增厚,细胞内含红色或红棕色油脂。葉肉栅栏组织为1列细胞,海绵组织排列疏松,细胞内含黄色油脂。主脉维管束外韧型,呈凹槽状,细胞内可见红色油脂。
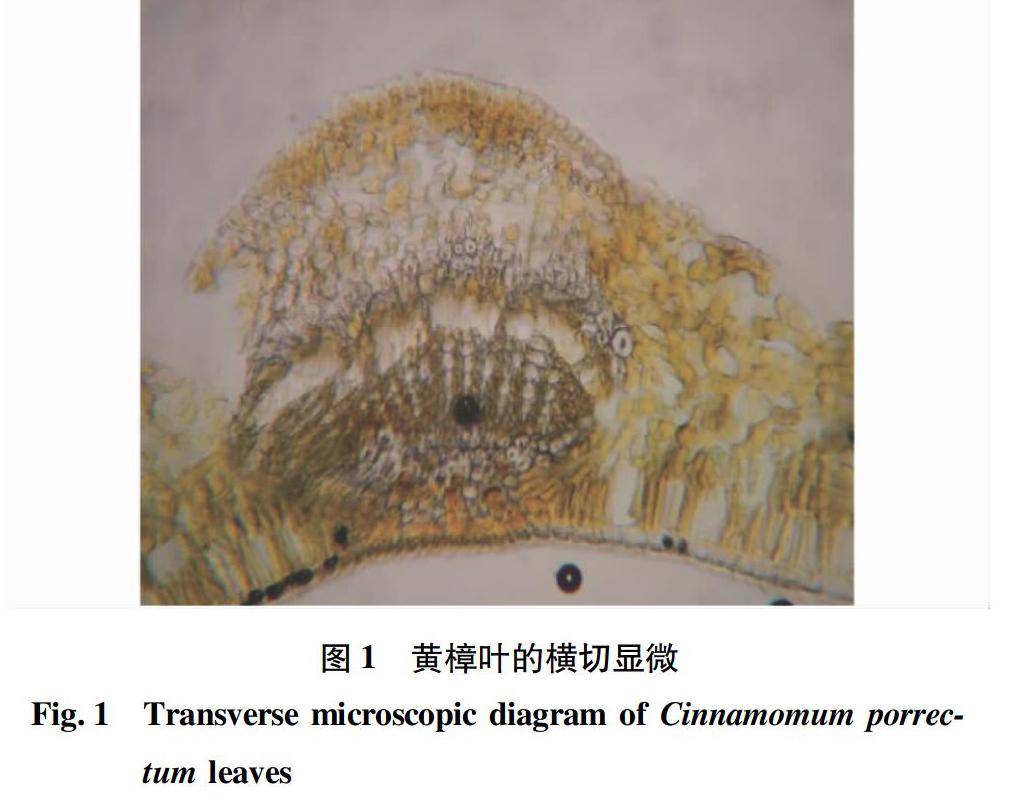
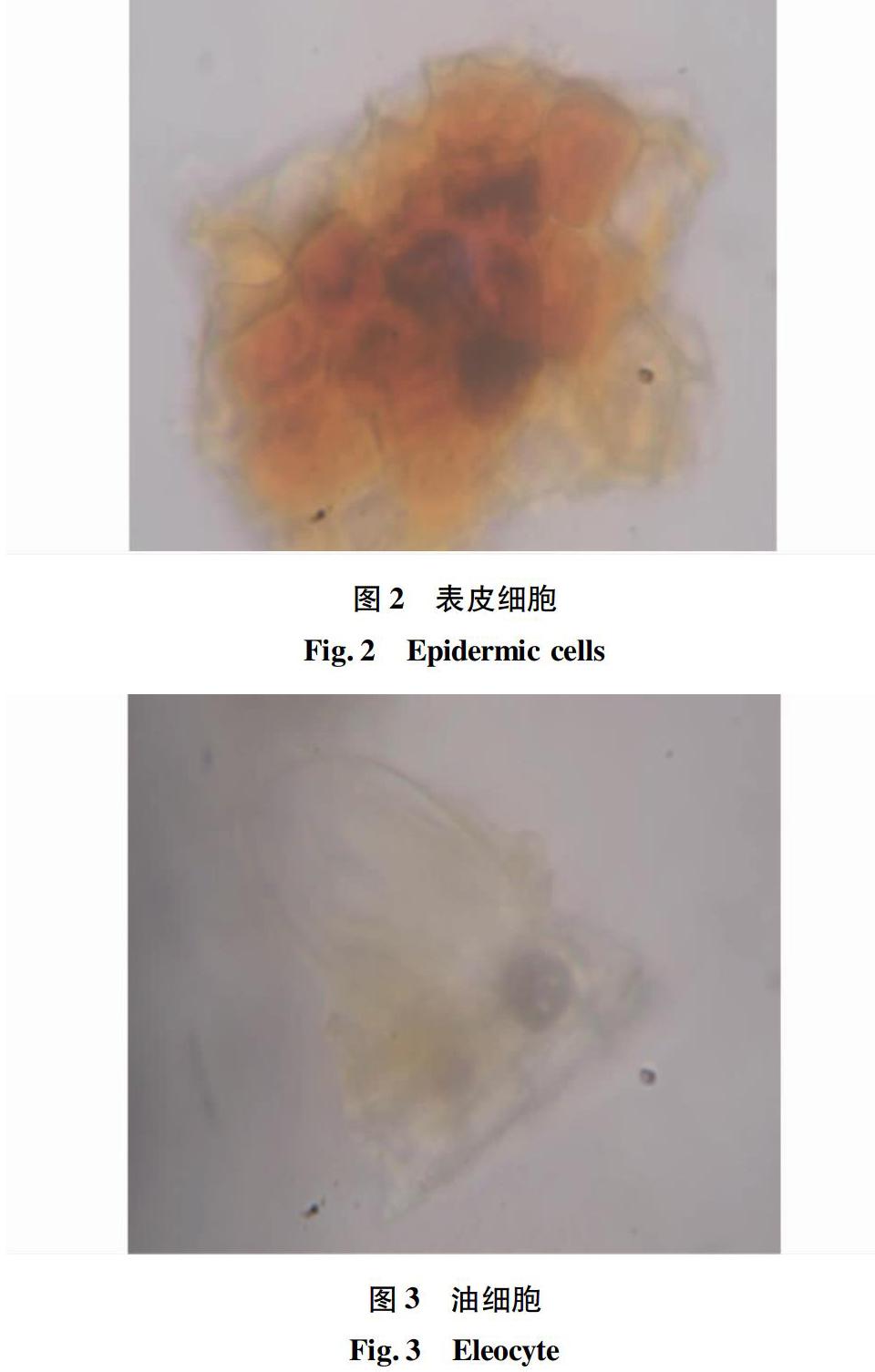
2.1.2 叶粉末。
粉末呈黄绿色,表皮细胞长方形或类长方形,薄壁细胞中含黄色或黄棕色油脂,可见油细胞(图2~3)。
2.2 薄层鉴别的试验结果
从图4~11可以看出,供试品色谱在与对照药材色谱相应的位置上显相同颜色的荧光斑点。在3种温湿度条件下的薄层图谱一致,即此薄层方法不受温湿度影响。
3 结论与讨论
该研究以黄樟叶为对象,显微方法描述了油细胞、细胞壁等具有特征性。薄层鉴别的方法各点分离度好、专属性强、重复性和稳定性好,不受温湿度的限制,且简单易行、准确可靠,为黄樟叶质量标准的建立打下基础。
参考文献
[1] 国家中医药管理局《中华本草》编委会.中华本草:第3册[M].上海:上海科学技术出版社,1999:51.
[2] 罗永明,李斌,黄璐琦,等.黄樟叶挥发油成分研究[J].中药材,2003,26(9):638-639.
[3] 张秋根,王岳峰,俞志雄,等.井冈山产黄樟叶精油的化学成分[J].江西农业大学学报,1994,16(3):303-307.
[4] 李小平,邱俊铭.荔枝草生药学研究[J].安徽农业科学,2018,46(15):158-159,162.
[5] 国家药典委员会.中华人民共和国药典(2015版四部)通则[S].北京:中国医药科技出版社,2015.
[6] 周洁贤.肿节风提取物薄层色谱鉴别条件的优化[J].海峡药学,2014,26(1):55-57.
[7] 李越峰,司昕蕾,冯金梁,等.当归浸膏片与当归极细粉片和当归超微片的质量比较[J].中国临床药理学杂志,2019,35(3):287-290.
[8] 李玲,杨骏,王冰,等.左归浓缩丸质量标准的研究[J].中华中医药学刊,2016,34(4):791-794.
[9] 巴桑德吉,旦增央金,色珍,等.糖康福散质量标准研究[J].中国民族医药杂志,2019,25(4):37-38.
[10] 张远达,陈志强,尚静雪,等.中兽药乌梅颗粒质量标准的研究[J].中国兽药杂志,2019,53(10):27-32.
