对虾养殖环境中红酵母的筛选及其发酵工艺研究
2020-06-21王金才于鸽刘唤明邓楚津洪鹏志汤宝贵
王金才 于鸽 刘唤明 邓楚津 洪鹏志 汤宝贵


摘要 [目的]对对虾养殖环境中红酵母进行筛选,并对其发酵工艺进行研究。[方法]首先利用PDA固体培养基从对虾养殖环境中筛选出红酵母菌株HL-6;然后,根据26S rDNA 基因序列的系统发育树分析,对菌株HL-6 进行鉴定;最后,在单因素试验的基础上,通过正交试验对发酵工艺进行优化。[结果]经初步鉴定确定菌株HL-6为胶红酵母,该菌株的最佳发酵工艺如下:糖蜜浓度为8%,酵母膏浓度为1.5%,硫酸铵浓度0.6%,磷酸二氢钾浓度为0.3%,发酵温度为30 ℃,发酵时间为48 h。在此工艺条件下,發酵液中红酵母的活菌数高达11.2×108 CFU/mL。[结论]该研究对对虾养殖所用红酵母的发酵生产具有一定的参考价值。
关键词 对虾养殖环境;红酵母;筛选;发酵工艺
中图分类号 S917.1文献标识码 A文章编号 0517-6611(2020)11-0104-03
Abstract [Objective]To screen out Rhodotorula sp. in culture environment of shrimp, and study its fermentation technology. [Method] Firstly, Rhodotorula sp. strain HL6 was screened out from culture environment of shrimp by using PDA solid medium. Secondly, the strain HL6 was identified based on phylogenetic tree analysis of 26S rDNA gene sequence. Finally, the fermentation technology was optimized by orthogonal experiment on the basis of single factor experiment. [Result] The strain HL6 was preliminarily identified as Rhodotorula mucilaginosa. The optimum fermentation conditions of the strain were as follow: molasses 8%, yeast extract 1.5%, ammonium sulfate 0.6%, potassium dihydrogen phosphate concentration 0.3%, fermentation temperature 30 ℃ and fermentation time 48 h. Under the above conditions, the number of Rhodotorula sp. in the fermentation broth was as high as 11.2×108 CFU/mL. [Conclusion] The study had certain reference values for the fermentation production of Rhodotorula sp. used in shrimp culture.
Key words Shrimp culture environment;Rhodotorula sp.;Screening;Fermentation technology
红酵母是一类抗逆性较强的腐生菌,广泛分布于海洋、淡水等环境中。红酵母具有优良的脂肪酸组成、丰富的必需氨基酸[1],且还富含以虾青素为主的类胡萝卜素[2],显示其在饲料和养殖领域具有很好的潜在营养价值。陈昌福等[3]研究表明在饵料中添加海洋1号红酵母可以提高日本对虾幼虾的成活率,促进生长,增加对环境因子的耐受力。薛德林等[4]研究表明往养殖水体中添加海洋胶红酵母能降低海参的发病率,提高海参的产量。另有研究表明,在水产饲料中添加红酵母可以提高水产动物消化酶的活性,改善肠道微生物的群落结构[5-6]。由此可见,红酵母在水产养殖中具有良好的应用前景。
虽然红酵母在水产养殖中具有良好的应用前景,但目前市场上还缺乏对虾养殖用的红酵母菌剂。目前国内已有人从斑马鱼肠道[7]、海参肠道[8]和红色淤泥[9]等环境筛选出红酵母,但从对虾养殖环境中筛选出红酵母却鲜有报道,且从对虾养殖环境中筛选的土著红酵母应用于对虾养殖有更好的适应性。笔者从对虾养殖环境筛选出红酵母,对其发酵工艺进行了优化,旨在为红酵母应用于对虾养殖提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 试验材料。菌株筛选样品为对虾养殖环境中的海水和底泥。
1.1.2 培养基。PDA固体培养基:马铃薯 200 g、 葡萄糖20 g、琼脂20 g、氯霉素0.2 g、 蒸馏水1 000 mL,115 ℃下灭菌20 min,备用。
1.1.3 试验仪器。LS-B50L 型立式压力蒸汽灭菌锅,由上海华线医用核子仪器有限公司生产;SW-CJ-2F 型洁净工作台,由上海博讯实业有限公司医疗设备厂生产;SPX-150B-Z 型生化培养箱,由上海博讯实业有限公司医疗设备厂生产;HZQ-F160型恒温摇床,为金坛市万华实验仪器厂产品;L1100A型生物显微镜,为广州粤显光学仪器有限公司产品;722s型可见分光光度计,为上海第三分析仪器厂产品。
1.2 试验方法
1.2.1 红酵母的筛选。取样品10 g 加入到90 mL 无菌水中,梯度稀释,选取其中3个梯度的稀释液涂布到PDA固体培养基上,30 ℃培养48 h;挑选颜色为红色的菌落在PDA固体平板上划线培养,然后选取红色的单菌落转接到试管斜面PDA培养基中培养,30 ℃下培养48 h。然后,利用显微镜观察斜面中培养的微生物,选取个体形态较大、形状为圆形或椭圆形的菌株作为疑似红酵母的菌株进行下一步鉴定。
1.2.2
红酵母的鉴定。采用孙建男等[10]的方法,对疑似菌株的26S rDNA D1/D2区域的序列进行扩增,将扩增成功后的PCR产物送至上海生工公司测序,测序后得到的结果提交GenBank 数据库中进行Blast 比对,再进行同源性分析,最后使用MEGA5.0 软件进行聚类分析和系统发育树构建。
1.2.3 酵母菌生长情况的测定方法。①比浊法。用灭菌后未接种前的培养基调零,使用分光光度计在600 nm波长处测定培养好的酵母菌发酵液的吸光值。②平板计数法。酵母菌的计数使用PDA固体培养基,将需要计数的样品进行梯度稀释后,涂布于PDA培养基,30 ℃下培养48 h,选取菌落数30~300的平板计数,1个稀释度选择2个平板。
1.2.4 单因素试验优化发酵工艺。 ①糖蜜浓度的优化。分别选取5%、6%、7%、8%和9%的糖蜜浓度作为碳源,置于30 ℃恒温摇床中,120 r/min培养48 h,测定发酵液的吸光值。②酵母膏浓度的优化。糖蜜浓度为7%,酵母膏的浓度分别为0.3%、0.6%、0.9%、1.2%和1.5%,置于30 ℃恒温摇床中,120 r/min培养48 h,测定发酵液的吸光值。③硫酸铵浓度的优化。糖蜜浓度为7%,酵母膏浓度为0.9%,硫酸铵的浓度分别为0、0.2%、0.4%、0.6%、0.8%和1.0%,于30 ℃恒温摇床中,120 r/min培养48 h,测定发酵液的吸光值。④磷酸二氢钾浓度的优化。糖蜜浓度为7%,酵母膏浓度为0.9%,硫酸铵浓度为0.6%,磷酸二氢钾的浓度分别为0、0.1%、0.2%、0.3%、0.4%和0.5%,置于30 ℃恒温摇床中,120 r/min培养48 h,测定发酵液的吸光值。⑤发酵时间的优化。糖蜜浓度为7%,酵母膏浓度为0.9%,硫酸铵0.6%,磷酸二氢钾的浓度为0.3%,置于30 ℃恒温摇床中,120 r/min下分别培养36、42、48、54和60 h,测定发酵液的吸光值。
1.2.5 正交试验优化发酵工艺。在单因素试验的基础上,选取糖蜜浓度、酵母膏浓度、硫酸铵浓度和磷酸二氢钾浓度进行正交试验。正交试验因素和水平设计如表1所示。
2 结果与分析
2.1 红酵母的筛选
从对虾养殖环境中的海水和底泥中筛选出1株红酵母菌株HL-6,对筛选出的酵母菌株进行平板
菌落形态和显微形态观察,结果如图1所示。菌株HL-6的
菌落形态特征如下:菌落呈橘红色,边缘整齐,圆形,隆起,表面湿润,易挑起。菌株菌株M5的菌体形态特征如下:菌体呈椭圆形,可进行出芽生殖。
2.2 红酵母的鉴定
将菌株HL-6的测序结果,通过GenBank 数据库中已收录的酵母26S rDNA D1/D2 区序列比对,HL-6与Rhodotorula mucilaginosa CBS 316的相似性最高,高达100%。选取序列相似度高 的部分菌种,采用软件MEGA5.0 软件绘制系统发育树,结果见图2。由图2可知,HL-6与Rhodotorula mucilaginosa CBS 316处于同一分支上,亲缘关系最近。综合以上分析,可初步鉴定HL-6为胶红酵母(Rhodotorula mucilaginosa)。
2.3 红酵母发酵工艺的优化
2.3.1 糖蜜濃度对红酵母生长的影响。
由图3可知,随着糖蜜浓度的增加,红酵母发酵液的吸光值先增加后减少。当糖蜜浓度为7%时,发酵液吸光值最高。
2.3.2 酵母膏浓度对红酵母生长的影响。
由图4可知,随着酵母膏浓度的增加,发酵液的吸光值先增加后减少。当酵母膏浓度为0.9%时,发酵液吸光值最高。
2.3.3 硫酸铵浓度对红酵母生长的影响。
由图5可知,添加无机氮源硫酸铵可使发酵液的吸光值增加,随着硫酸铵浓度的增加,发酵液的吸光值先增加后减少。当硫酸铵浓度为0.6%时,发酵液吸光值最高。
2.3.4 磷酸二氢钾浓度对红酵母生长的影响。
由图6可知,添加磷酸二氢钾可使发酵液的吸光值增加,随着磷酸二氢钾浓度的增加,发酵液的吸光值先增加后减少。当磷酸二氢钾浓度为0.3%时,发酵液吸光值最高。
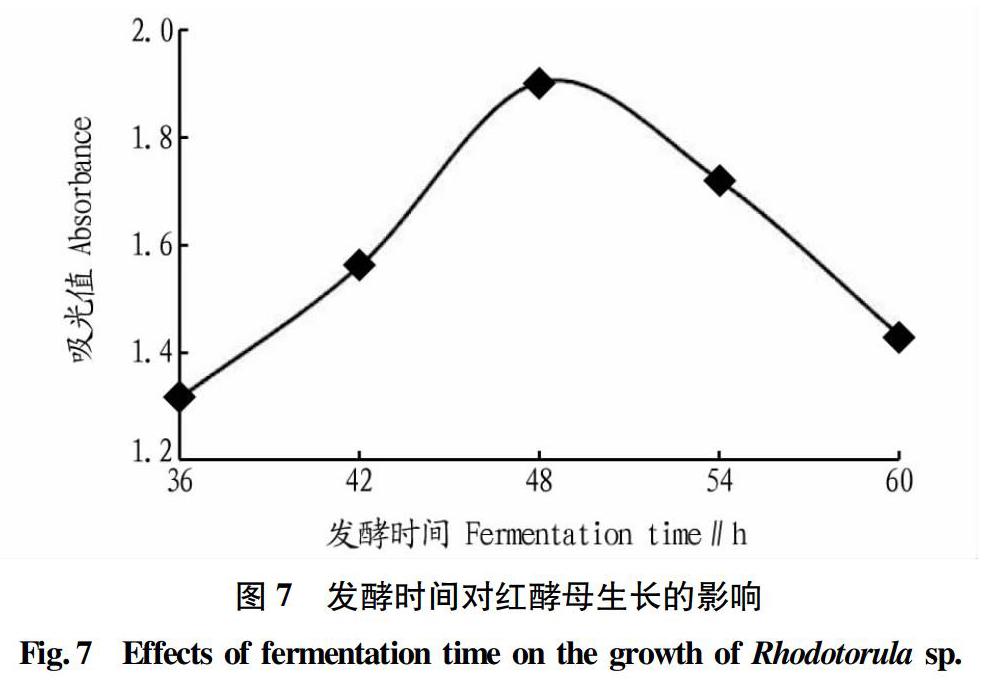
2.3.5 发酵时间对红酵母生长的影响。
由图7可知,当发酵时间大于48 h时,发酵液吸光值不断下降,因此最佳发酵时间为48 h。
2.3.6 正交试验优化。
在单因素试验的基础上,利用正交试验对发酵工艺进行了优化,结果见表2。由表2 可知,各因素的最优水平为A3B3C2D1,即糖蜜浓度为8%,酵母膏浓度为1.5%,硫酸铵浓度为0.6%,磷酸二氢钾浓度为0.3%。在以上条件下,发酵液的吸光值为1.889,经平板计数法测定该发酵液的活菌数为11.2×108 CFU/mL。 从R值的大小可以看出,酵母膏浓度的影响最大,其次为糖蜜浓度,而磷酸二氢钾浓度的影响最小。
3 结论
该试验采用PDA培养基从对虾养殖环境中的海水和底泥筛选出的红酵母HL-6作为菌种,利用26S rDNA D1/D2区域序列分析的方法初步鉴定红酵母HL-6为胶红酵母,通过单因素试验及正交试验确定了胶红酵母HL-6 的最佳发酵工艺:糖蜜浓度为8%,酵母膏浓度为1.5%,硫酸铵浓度为0.6%,磷酸二氢钾浓度为0.3%,发酵温度为30 ℃,发酵时间为48 h。在以上工艺条件下,发酵液的活菌数达11.2×108 CFU/mL。该研究对对虾养殖用的红酵母的发酵生产具有一定的参考价值。
参考文献
[1] 吴康,盛哲良,丁立建,等.3 株海洋红酵母的分离及营养成分分析[J].热带作物学报,2017,38(12):2238-2242.
[2] 罗秀针,林燕燕,陈雅静,等.粘红酵母RG-31产虾青素发酵条件优化[J].福建农林科技,2019(9):16-21.
[3] 陈昌福,姚鹃,肖雪生,等.海洋1号红酵母饲养日本对虾幼虾的效果[J].淡水渔业,2004,34(6):55-57.
[4] 薛德林,胡江春,王国安,等.海洋胶红酵母、光合细菌、生化黄腐酸在海参育苗和养成中的应用效果[J].腐植酸,2009,22(4):19-24.
[5] 杨世平,吴灶和,简纪常.饲料中添加沼泽生红冬孢酵母对凡纳滨对虾消化酶及肠道微生物的影响[J].水产科学,2011,30(7):391-394.
[6] 包鹏云,李璐瑶,徐哲,等.海洋红酵母H26对刺参幼参生长、免疫指标和肠道菌群的影响[J].大连海洋大学学报,2019,34(5):615-622.
[7] 胡秀彩,戚冰洁,顾丹,等.斑马鱼肠道中一株红酵母(Rhodotorula)的分离与鉴定[J].生物技术,2011,21(4):55-58.
[8] 孙蕾,李成,马树瑞,等.一株红酵母的筛选、鉴定及硝化作用[J].大连工业大学学报,2016,35(2):88-91.
[9] 赵紫华,韩雪,王玉营,等.一株高产β-胡萝卜素红酵母菌株的筛选及发酵工艺研究[J].饲料研究,2015(5):10-14,18.
[10] 孙建男,刘影,谢为天,等.雷州半岛近岸海域海洋红酵母的分离鉴定[J].热带海洋学报,2017,36(4):87-92.
