氨氮对nTiO2 在水体中沉降速率的影响
2020-06-21李铎,徐楠
李 铎,徐 楠
(苏州科技大学 化学生物与材料工程学院,江苏 苏州215009;江苏省环境功能材料重点实验室,江苏 苏州215009)
纳米材料具有小尺寸效应、表面效应、量子尺寸效应和宏观量子隧道效应等,从而使得纳米材料在医学[1]、化工[2]、环境[3]、微电子[4]等行业被广泛应用。纳米二氧化钛(nTiO2)作为一种常见的纳米材料,由于生产成本低、化学稳定性好以及光催化能力强,而被大量生产和广泛应用[5]。在nTiO2的生产、消费过程中,部分nTiO2会无法避免释放到自然环境中[6-7],进入环境后会类似其他环境污染物,参与生物圈的循环,在循环过程中发生复杂的迁移和转化过程,进而产生生态效应。例如Yamamoto 等人发现,nTiO2会增加肌肤细胞中的活性氧的生成[8],而这可能会伤害DNA 或者使基因发生突变,最终发展至细胞癌症[9-10]。研究发现,纳米颗粒在进入水体环境之后,其环境行为与颗粒自身的性质有关。粒径、表面电位、离子种类、离子浓度、pH 值都会影响水体中纳米颗粒聚集和沉降,进而影响其反应性和生物毒性。因此,研究nTiO2在水体中的沉降能力,可以为评估nTiO2潜在的生态风险提供重要的理论支撑。
目前,全球经济快速发展,科学技术越来越发达,在农业生产中,大量含有氨氮的农药和化肥正在被使用,湖泊、地下水、河流中的氨氮污染的现象已经越来越严重。所以,保护生态环境、防治氨氮污染在我国农业科学中是一项迫切任务,对氨氮污染的危害进行研究具有重大的现实意义。例如,李亚楠等人研究了合成碳酸钙镁材料对土壤中磷的固定发现,高pH 值有利于材料对磷的固定[11]。与此同时,Na+是地下水中分布最广、含量较多的离子之一,在研究有关水体环境时,不可避免地要将Na+考虑其中。
已有研究表明,nTiO2可以用于去除污水中的氨氮[12-13]。nTiO2在进入水体环境后,会在范德华力和静电吸引力的作用下发生聚集沉降,这可能会导致nTiO2在水中停留时间短,同时也会降低颗粒的比表面积,影响nTiO2的反应性,降低光催化性能等,最终影响nTiO2对氨氮的去除能力。目前为止,多数报道都是关于nTiO2迁移的影响,例如刘诚等人研究了磷酸盐对nTiO2在土壤中迁移的影响[14],徐小婷等人研究了磷酸盐和腐殖酸对nTiO2迁移的影响[15]。但是至今为止,还没有关于氨氮对nTiO2沉降性能影响的报道,因此,研究nTiO2在含有氨氮水体中的聚集沉降能力是十分重要的。
1 材料与方法
1.1 实验试剂
nTiO2购买自上海高全化工有限公司。其他试剂均为分析纯(AR)。
1.2 nTiO2 的团聚实验
精准量取1 g nTiO2,转移至100 mL 烧杯中,分别加入100 mL 不同浓度(1、5、10 mmol·L-1) 的NH4Cl 溶液、NaCl 溶液,并分别使用HCl 和NaOH 调节pH 值至6.0 和8.0,将nTiO2悬浮液放置在超声仪器里超声30 min,再将其静置进行间隔取样,每次取样2 mL。nTiO2的测量方法采用二安替比林甲烷方法测量[16],使用紫外分光光度计岛津UV-2450 在390 nm 处测量吸光度。用1000 mg·L-1的钛标准溶液稀释至1-5 mg·L-1,进行测量,获得nTiO2浓度的标准曲线(如图1 所示)。
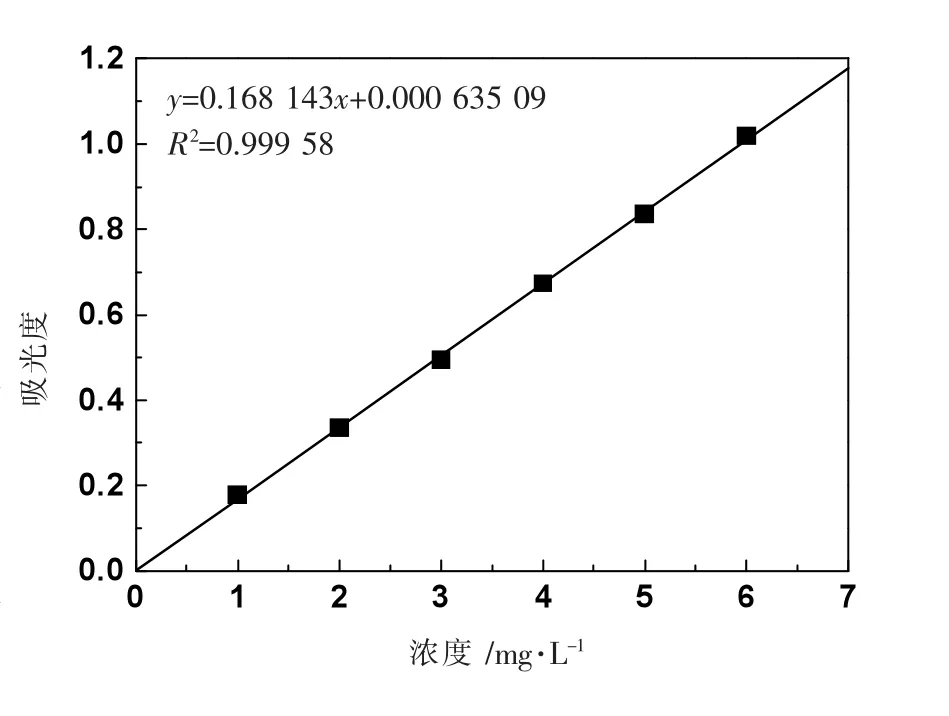
图1 紫外分光光度法测定nTiO2 浓度的曲线
1.3 nTiO2 的Zeta 电位和水力学直径测量
精确称取0.01 g nTiO2,转移至100 mL 烧杯中,分别加入100 mL 不同浓度(1、5、10 mmol·L-1)的NH4Cl溶液、NaCl 溶液,并分别使用HCl 和NaOH 调节pH 至6.0 和8.0。参考Fang 等人[17]的研究方法,为了促进nTiO2在溶液中更好的分散,悬浮液放置在超声仪器里超声10 min,之后每个样品三次取样,采用马尔文Nano-ZS90 测量Zeta 电位和水力学直径,最终取平均值。
1.4 沉降效率模型
沉降数据采用Quik 等人和Velzeboer 等人的经验模型来分析[18-19]:

其中t是沉降时间,Ct是时间t处的胶体浓度(g·L-1),Cres是某一时间的残留浓度(g·L-1),C0是初始浓度(g·L-1),Vs是沉降速率(mm·min-1),h 是取样时水面距离取样点的高度,据等式(1)可以计算聚集体的Vs。假设每种溶液中没有nTiO2样品溶解成离子态。
2 结果与讨论
2.1 nTiO2 在NaCl 溶液中的Zeta 电位和水力学直径
图2 研究了NaCl 溶液中,nTiO2在pH=6.0、8.0 条件下的Zeta 电位(a)和水力学直径(b)。
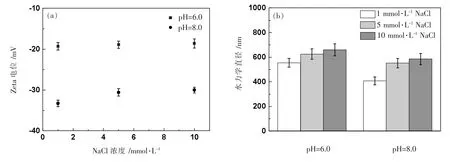
图2 pH=6.0、8.0 条件下nTiO2 在不同浓度NaCl 溶液中的Zeta 电位(a)和水力学直径(b)
在图2(a)和图2(b)中,pH=6.0 条件下,Zeta 电位随着Na+浓度的增加而变得略微少负,粒径(水力学直径)变大,易发生团聚。当pH 值继续增加到8.0 时,nTiO2在水体环境中的Zeta 电位变得更负,水力学直径也减小。针对特定的pH 值,随着Na+浓度的增加,其Zeta 电位均变得少负,这主要是因为随着Na+浓度的增加,使得nTiO2表面的电荷屏蔽效应和静电双电层被压缩[20-21],导致颗粒表面的净负电荷减少,Zeta 电位降低。
2.2 nTiO2 在NH4Cl 溶液中的Zeta 电位和水力学直径
图3 研究了NH4Cl 溶液中,nTiO2在pH=6.0、8.0 条件下的Zeta 电位(a)和水力学直径(b)。
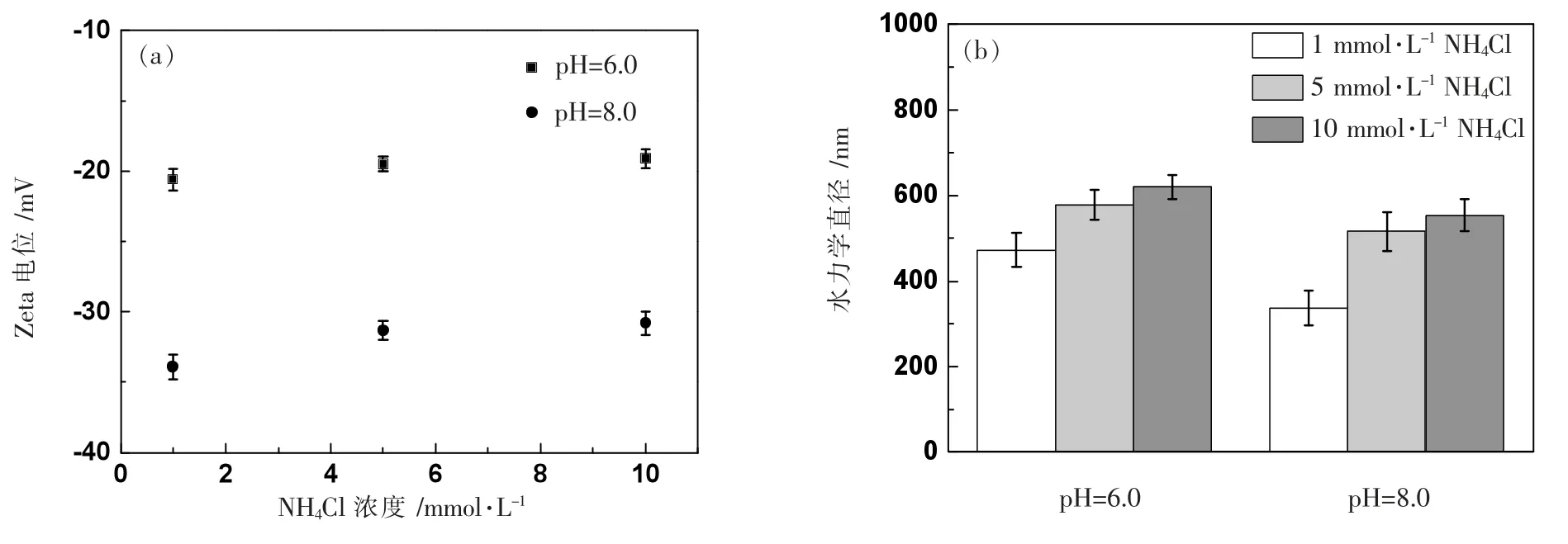
图3 pH=6.0、8.0 条件下nTiO2 在不同浓度NH4Cl 溶液中的Zeta 电位(a)和水力学直径(b)
在图3(a)中,nTiO2在pH=6.0、8.0 条件下的Zeta 电位均是负值,且相同NH4Cl 浓度下,pH=6.0 条件下的Zeta 电位要比在pH=8.0 条件下的Zeta 电位少负;图3(b)中,在相同NH4Cl 浓度下,nTiO2的粒径随着pH 值的增加而减小,导致这一现象可能的机理是,Zeta 电位少负,会导致nTiO2颗粒之间的静电斥力变小,从而使得nTiO2颗粒之间更易于团聚进而导致颗粒粒径变大。图3(a)中,针对特定pH 值,nTiO2的Zeta 电位随着离子浓度的增加而变得少负,这与Na+中的现象一致。图3(b)中水力学直径的增大与图3(a)中Zeta 电位的少负是一致的。对比图3 和图2,在相同pH 值、相同离子浓度条件下,nTiO2在NH4Cl 电解质溶液中的Zeta 电位更负,粒径也更小。比如,pH=6.0 条件下,1 mmol·L-1NaCl 溶液中nTiO2的Zeta 电位和水力学直径分别为-19.3 mV、554 nm,当电解质溶液为1 mmol·L-1NH4Cl 时,对应的数值变为-20.6 mV、472 nm。
2.3 nTiO2 在NaCl 溶液中的沉降
图4 是NaCl 溶液中,nTiO2在pH=6.0、8.0 中的沉降曲线。
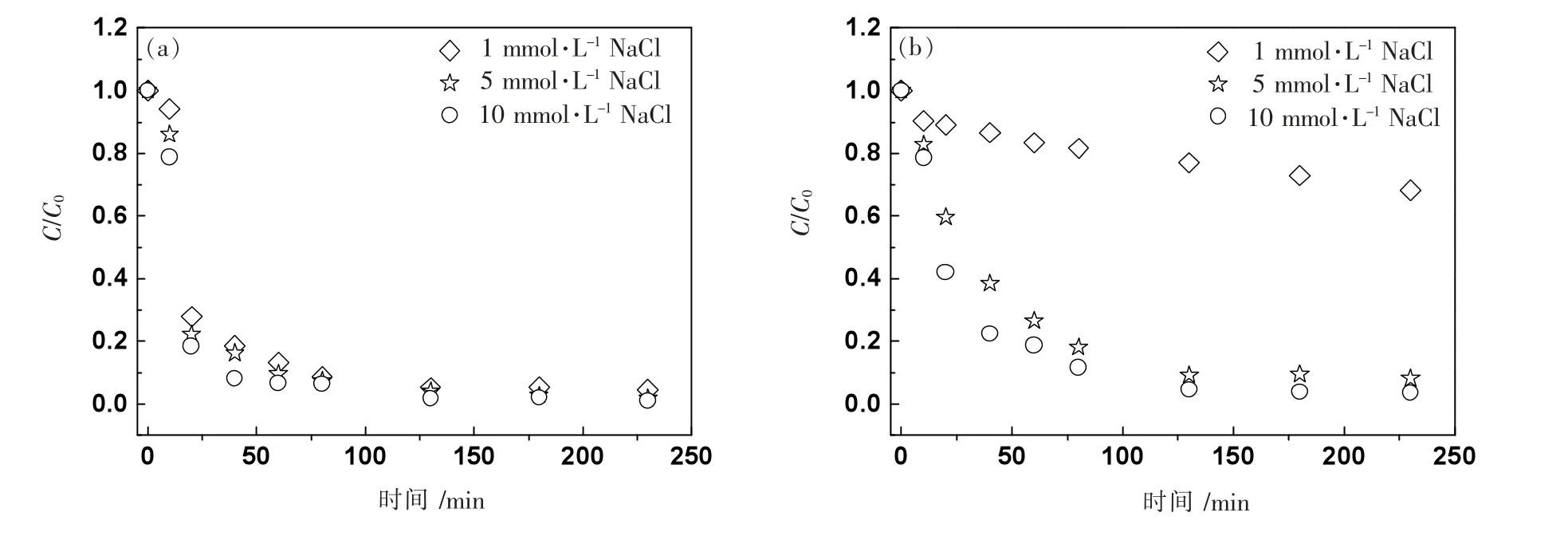
图4 nTiO2 在不同浓度NaCl 溶液pH=6.0(a)、8.0(b)中的沉降曲线
横坐标代表沉降时间,纵坐标代表对应沉降时间下取样液体中的nTiO2浓度(C)与初始nTiO2浓度(C0)的比值。比值越小,代表取样中的nTiO2浓度越低,相对应的溶液中沉降的nTiO2越多。图4(a)表明,pH=6.0条件下,NaCl 溶液的浓度对nTiO2沉降性能影响虽然不明显,但是整体上依然是离子浓度越高,沉降速率越快,悬浮稳定性越差。离子浓度的增加有利于颗粒发生沉降,但是这种影响作用不是很明显,根据公式(1)模拟计算出的沉降速率(Vs)发现:随着离子浓度的增加,Vs仅仅从0.507 mm·min-1增加到0.534 mm·min-1。而在图4(b)中,pH=8.0 条件下,低NaCl 浓度(1 mmol·L-1)对nTiO2的沉降作用明显,显著增强了nTiO2在水体环境中的悬浮稳定性。对比图4(a)和图4(b),1 mmol·L-1NaCl 条件下,pH 值是影响nTiO2在水体环境中的沉降性能的重要因子;较高离子浓度下,高pH 值对沉降的抑制作用不明显。
2.4 nTiO2 在NH4Cl 溶液中的沉降
如图5(a)所示,pH=6.0 条件下,nTiO2随着NH4+浓度的增加,其沉降速度越来越快,这表明nTiO2的沉降性能受到NH4+浓度的影响,并且NH4+浓度越高,其沉降速率越快,悬浮稳定性越差,这主要因为nTiO2表面的电荷屏蔽效应和静电双电层压缩理论[19-20],导致颗粒之间的静电斥力减弱,颗粒团聚增强,粒径变大,沉降增加。当pH 值增大到8.0 时,nTiO2的悬浮稳定性依然随着NH4+浓度的增加而减弱。表1 中的数据可以很好解释这种现象:确实随着离子浓度增加而增加。这表明,NH4+浓度是影响nTiO2的沉降性能重要因素。对比图5(a)和图5(b),还发现在同一NH4+浓度下,pH 值增大时,沉降速率变小,其沉降速率越小,悬浮稳定性越好。这与之前的Zeta 电位和水力学直径结果一致:高pH 值条件下,nTiO2的Zeta 电位更负,水力学直径也更小。而且表1 中的数据表明在pH=6.0 时高于pH=8.0 条件下的数值,这表明高pH 值的增加提高了nTiO2在水体环境中的悬浮稳定性。对比图4(a)和图5(a),不难发现,在pH=6.0 时相同离子强度条件下,与Na+相比较,NH4+抑制了nTiO2的聚集沉降。如达到沉降平衡时,10 mmol·L-1NaCl 溶液中,C/C0的值为0.029,而NaCl 溶液中这一比值为0.011。这一现象,在pH 增大到8.0 时依然适用。图2 和图3 中Zeta 电位和水力学直径也说明,更负的Zeta 电位和更小的水力学直径会使得纳米颗粒不易发生沉降,增强稳定性。由此可以看出,NH4+有利于提高nTiO2在水体环境中的悬浮稳定性。
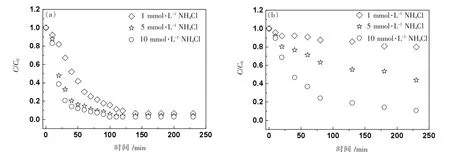
图5 nTiO2 在不同浓度NH4Cl 溶液中pH=6.0(a)、8.0(b)时的沉降曲线
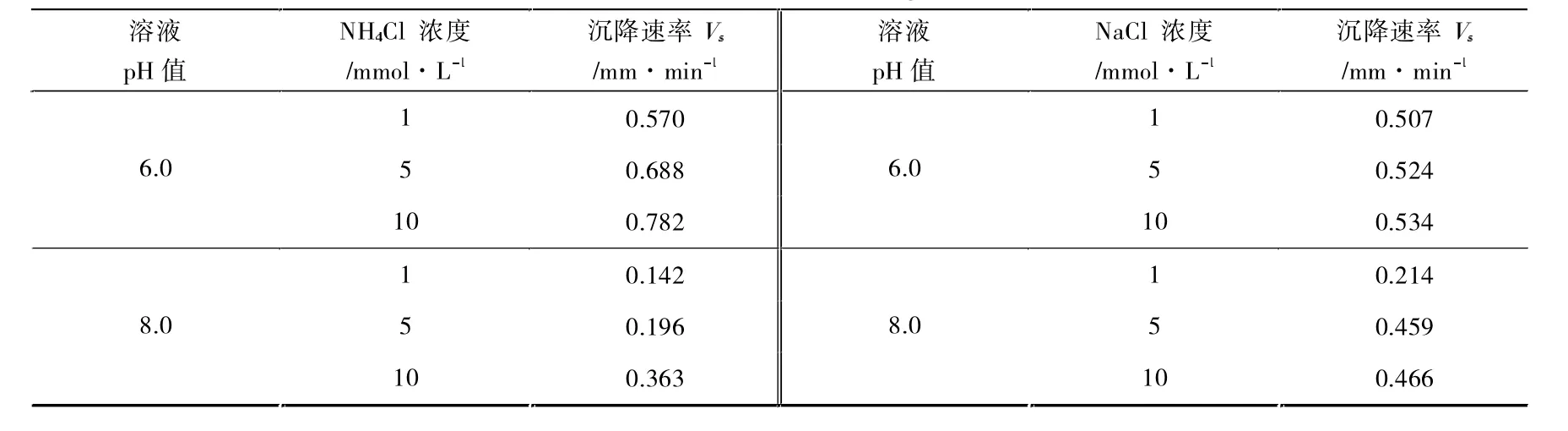
表1 不同电解质溶液中nTiO2(10 g·L-1)的沉降速率
3 结语
实验结果表明,相同离子强度条件下,高pH 值有助于提高nTiO2在电解质溶液中的稳定性,这是因为pH 值的升高,会导致颗粒表面电位变得更负,颗粒之间静电斥力变大,粒径变小,从而颗粒不易发生团聚,最终导致颗粒不易发生沉降;相同pH 值和离子强度时,水体中NH4+比Na+更有助于提高颗粒的稳定性和悬浮性,而且nTiO2的沉降速率随着NH4+浓度增加而增大。
