X射线高频高压发生器产品技术审评概要研究
2020-06-20广东省药品监督管理局审评认证中心广东广州510080
广东省药品监督管理局审评认证中心 (广东 广州 510080)
内容提要: X射线高频高压发生器装配于诊断X射线机,为X射线管组件提供电能,以发出X射线。X射线高频高压发生器为诊断X射线机的核心部件,文章针对该产品申报注册中常见问题,进行归纳和分析,为医疗器械注册相关人员提供技术参考。
诊断X射线机由X射线发生装置、X射线辅助装置和X射线成像装置等主要部件构成。发生装置包含:高压发生装置、X射线管、控制装置;成像装置包括:计算机系统和应用软件、探测器、显示设备;辅助装置包括:制动装置、诊断床、限速器及其他机械附属装置。诊断X射线机部件众多,高压发生装置是其核心部件之一。诊断X射线机最初使用工频高压发生器,其工作原理与普通变压器相同,但是缺点在于结构笨重,产生的X射线频谱宽,导致患者及医护人员接受较高的辐射剂量,曝光精度低。而高频高压发生器与工频高压发生器对比,管电压的波纹系数下,减少了X射线的频谱宽度,提高了成像质量,降低了医护人员接受辐射剂量。本文围绕X射线高频高压发生器进行讨论,就该类产品的注册申报和咨询常见问题进行归纳和分析,以期为医疗器械注册相关人员提供技术参考。
1.X射线高频高压发生器产品描述
1.1 类别
依据原国家食品药品监督管理总局2017年8月31发布《医疗器械分类目录》[1],X射线高频高压发生器属于第二类医疗器械管理。将其纳入分类编码为06(医用成像器械)—03(X射线发生、限束装置)—01(X射线高频高压发生器),需要严格控制以保证其安全性、有效性。
1.2 产品的结构和组成
通常由高压主机和高压控制器组成。主机包括:高压油箱和控制电路,灯丝驱动器,阳极启动器以及与其他设备的接口连接。
2.技术审评要求探讨
2.1 产品工作原理
X射线高频高压发生器是先将工频电压经整流、滤波转换成低波纹系数的直流电压,然后经过逆变换产生高频电压,再经过升压、整流、滤波,最后输出所需直流电压,输出到X射线管。过程见图1。
2.2 注册单元划分的原则
以产品技术结构组成、适用范围以及性能指标为注册单元的划分依据。适用范围、产品性能、技术原理和结构组成(如硬件结构相同,仅靠软件调节功率可以划为同一注册单元。增加、减少以及更换部分电路板的方式调节高压发生器,其硬件结构方式相同,仅仅只是功率不同的高压发生器原则上可以划分为同一注册单元。)但如果各型号间在适用范围、性能、结构方面(如:工频和非工频)差异较大,则划分为不同的注册单元。
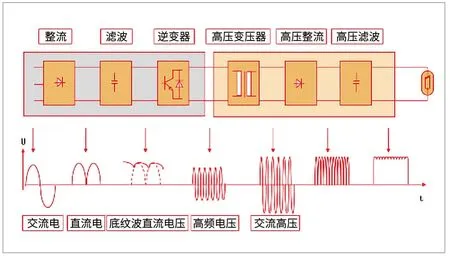
图1.X射线高频高压发生器工作原理
2.3 研究要求
2.3.1 性能研究。应当提供技术要求研究和编制说明,包括功能性指标、安全性指标以及与质量控制有关指标依据,所采用的标准、方法及理论基础。
研究资料中,可参考GB9706.3-2000、GB9706.1-2007、YY0505-2012、YY/T0741-2018、YY/T0291-2016、YY1057-2016确定性能指标,其他类型结合产品临床预期用途,参考相应标准中适用项目,说明与产品安全和有效性相关性能指标设定依据。
2.3.2 生物相容性评价研究。如直接接触或间接接触患者,应当按GB/T16886.1-2011要求进行生物相容性评价,并给出清单,提供所有与人体接触材料的名称和基本成分名称。
2.3.3 消毒工艺研究。如适用,提供推荐消毒工艺和推荐消毒方法依据以及必要的验证资料。
2.3.4 有效期和包装研究。有效期验证参考《有源医疗器械使用期限技术审查指导原则》[2]相关要求。因各企业采用的原料差别,但又考虑使用次数的差别以及不可预估的要素,实则产品有效期会有相应差别。应对有效期进行研究和验证。应明确在预期使用条件下,关键部件的使用期限,且应提供确定使用寿命的理论依据。经环境实验和模拟运输实验的验证,包装应满足运输和贮存要求。
2.3.5 软件研究。参考《医疗器械软件注册技术审查指导原则》[3]。对于产品具有网络连接功能用于进行电子数据交换、采用存储媒介或远程监测进行电子数据交换的产品,按照《医疗器械网络安全注册技术审查指导原则》[4]要求单独提交一份网络安全描述文档,产品技术要求中应明确数据接口、用户访问控制要求,在说明书中明确网络安全相关要求。
2.4 性能指标
各企业可根据自身产品技术特点制定性能指标,但不应低于相关强制性国家标准、行业标准要求。如对标准中有部分条款不适用,应提交编制说明充分阐述不适用原因。产品技术要求是审查产品主要中最重要的环节之一。应按照《医疗器械产品技术要求编写指导原则》[5]的规定编制。
可以从如下相关内容来进行审评:①规格型号。在符合注册单元划分规则的前提下可根据不同的适用范围、结构组成、技术参数分为不同的规格型号。②软件信息。根据《医疗器械软件注册技术审查指导原则》[3]以及《医疗器械网络安全注册技术审查指导原则》[4]要求,需对软件的名称、型号规格、完整版本命名规则、发布版本、运行环境等作出规定。明确软件全部临床功能纲要。③性能指标。制造商拟定的性能指标建议参考GB9706.3-2000、GB9706.1-2007、YY0505-2012、YY/T0741-2018规定的安全要求和性能要求;软件功能应满足软件描述文档中和说明书描写的功能;若产品具有网络连接功能用于进行电子数据交换、采用存储媒介或远程监测进行电子数据交换的产品,应根据《医疗器械网络安全注册技术审查指导原则》[4]要求制定。④安全性能研究。应符合GB 9706.1-2007、GB 9706.3-2000要求。⑤电磁兼容研究。应符合YY 0505-2012的要求。(应明确电磁兼容分组分类)。⑥环境试验研究。应符合YY/T 0291-2016的要求。
2.5 产品临床评价细化要求
临床评价应按照《医疗器械注册管理办法》[6]和《医疗器械临床评价技术指导原则》[7]以及相关法规中规定要求进行。该产品现已经在《免于进行临床试验医疗器械目录》内。根据《医疗器械临床评价技术指导原则》要求“在《免于进行临床试验医疗器械目录》内临床评价要求”提交临床评价资料。若声称申报产品与已上市产品临床用途、材料、技术、设计或作用机制,应提交相应临床评价资料。
2.6 产品说明书及标签要求
应符合《医疗器械说明书和标签管理规定》[8]、YY0505-2012、GB9706.1-2007、GB9706.3-2000、YY/T0741-2018、YY/T1099-2007的要求进行编写。
3.小结
近年来,人们对X射线高频高压发生器的需求越来越多,该类产品注册申报逐渐增多,并且针对该产品的咨询也在不断增多。本文结合工作的实际问题,针对X射线高频高压发生器申报中常见问题,进行归纳和分析,为医疗器械注册相关人员提供技术参考。
