甜瓜质地差异及相关细胞壁酶活性变化
2020-06-19杨丽萍马荣雪周永海程登虎魏春华张显张勇
杨丽萍 马荣雪 周永海 程登虎 魏春华 张显 张勇

摘 要: 对两种不同质地类型甜瓜果实发育过程中果肉质地的变化及相关酶活性进行研究。结果表明,花后35~40 d为软、脆两种甜瓜质地形成的关键时期。在该时期,软肉型甜瓜‘NSL细胞面积与间隙增大,果肉细胞排列疏松,细胞面积为脆肉型甜瓜的115.35%,软肉型甜瓜‘NSL与脆肉型甜瓜‘XZM质构参数差异显著,脆肉型甜瓜果实4种细胞壁酶活性总体低于软肉型甜瓜。花后35 d,软肉型甜瓜‘NSL细胞壁扩展酶基因(CmEXP3、CmEXP5、CmEXP9)相对表达量为最大值,显著高于脆肉型甜瓜‘XZM。
关键词: 甜瓜;细胞形态;质地剖面分析;细胞壁酶;基因表达
中图分类号:S652 文献标志码:A 文章编号:1673-2871(2020)05-012-06
Abstract: In this experiment, the changes of flesh texture and related enzyme activities during the development of two different texture types of melon fruits were studied. The results have shown that 35-40 d after pollination is the key period for the formation of soft and crisp melon texture. During this period, the cell area and intercellular space of the soft melon increased, and the flesh cells arranged loosely. The cell area of soft type fruit was 115.35% of crisp one. The structure parameters were significantly different. The four cell wall enzyme activities of crisp type were generally lower than those of soft one. At 35 days after pollination, the relative expression of the cell wall extension genes(CmEXP3, CmEXP5, CmEXP9) of the soft type ‘NSL was the highest, which was significantly higher than that of the crisp melon ‘XZM.
Key words: Melon; Cell morphology; Texture profile analysis; Cell wall enzyme; Gene expression
甜瓜質地品质是一个综合性指标,脆度和硬度是其两大关键因子,甜瓜口感因之而有酥脆、梗硬、软、面[1]的区别。影响质地的因素有果肉细胞大小,细胞间结合力,细胞构成物的机械强度和细胞的膨压等[2],在果实成熟过程中,胞间层细胞壁酶对质地有重要影响[3]。
TPA和穿刺法[4-5]能对甜瓜果实质地进行客观评价,刘莉[1]等研究表明甜瓜质构参数与质地相关。形态学研究表明[6],果肉细胞的大小是甜瓜果实质地影响因素之一,细胞越小,甜瓜果肉质地越硬[7],在苹果、枣等[8-10]研究中有相同结论。在果实软化过程中对其生理和分子机制也有相关研究[11-12],细胞壁酶活性增强促进果实软化[13]。
脆肉型甜瓜是目前育种的方向,笔者研究5个不同甜瓜材料质地差异的内在因素,为脆肉型甜瓜育种及探究甜瓜质地形成的机制提供理论指导。
1 材料与方法
1.1 材料
5份试验材料(表1)均由西北农林科技大学园艺学院选育,试验于2019年3—6月在陕西省咸阳市杨凌示范区西瓜试验示范基地进行。每个处理重复3次,随机区组设计,50穴育苗盘育苗,植株2叶1心定植,株距45 cm,行距80 cm,小区面积4 m2,每小区20株,按常规种植方法管理。花后15 d开始采样,随机采6个果形端正、大小一致且无病虫害的果实。选择5种甜瓜材料中口感差异明显的脆肉型甜瓜材料‘XZM和软肉型甜瓜材料‘NSL两种材料探究果实发育不同时期果肉细胞显微结构、果肉细胞形态学参数、细胞壁扩展酶基因相对表达量的变化,探究包括‘XZM和‘NSL在内的5种甜瓜材料果实发育不同时期果肉细胞壁酶活性的变化。
1.2 方法
1.2.1 TPA法 参照刘莉[1]等的方法,有改进。沿甜瓜果实赤道横向切成厚度约1.0 cm的薄片,果实切薄片去皮,去瓤,留下可食用部分果肉,用直径0.8 cm的打孔器,用力方向为垂直于薄片打孔,将柱状果肉高度修饰为0.8 cm,置于TA. XT. Plus物性分析仪(英国Stable Micro System公司)的平板上,采用P/75探头(Φ 75 mm压板),设置测试参数条件如下:预压速度2.0 mm·s-1,下压速度3.0 mm·s-1,压后上行速度3.0 mm·s-1,2次压缩间停顿3.0 s,试样受压形变30.0%,触发力10.0 g。
1.2.2 穿刺法 参照刘莉[1]等的方法,有改进。果肉取样方法与 TPA 法一致,样品采用直径为1.6 cm的打孔器进行打孔,圆柱厚度约为2.0 cm。将果肉置于物性分析仪的测试平板上,采用 P/2 探头(Φ 2 mm 不锈钢圆柱探头),测试参数设置如下:预压速度5.0 mm·s-1,下行速度 2.0 mm·s-1,穿刺后上行速度2.0 mm·s-1,下压距离为10.0 mm,触发力10.0 g。
1.2.3 果肉细胞显微结构观察 将新鲜组织用固定液固定24 h以上,依次梯度酒精进行脱水,将浸好蜡的组织于包埋机内进行包埋,修整好的蜡块置于石蜡切片机切片,厚4 μm,石蜡切片脱蜡至水,最后将植物组织切片放入染液约2~5 min后水洗,镜检。
1.2.4 细胞壁酶活性的测定 酶液的提取参照曹建康等[14]的方法,有改进。PG(多聚半乳糖醛酸酶)活性(以鲜质量计,后同)及Cx(纤维素酶)活性用DNS(3,5-二硝基水杨酸)比色法[15]测定;β-Gal(β-半乳糖苷酶)活性用硝基半乳糖苷水解法[16-17]测定;PME(果胶甲酯酶)活性参照曾秀丽等[18]及张娟等[19]的方法测定。
1.2.5 细胞壁扩展酶基因表达的实时荧光定量 PCR检测 采用TaKaRa多糖多酚试剂盒提取果肉总RNA(有改进),所提取的总RNA于UV-1700紫外分光光度计测定 A260、A280、A230,1%琼脂糖凝胶电泳,检测RNA质量和完整性。采用 Primer 5.0软件进行qRT-PCR引物设计,引物序列如表2。使用TaKaRa 逆转录试剂盒进行cDNA第一链的合成,RNA模板量为1 000 ng。PCR反应总体积10.0 μL,其中包括2.0 μL模板(cDNA),0.2 μL特异引物,5.0 μL SYBR? Premix Ex TaqTM(2×),2.6 μL ddH2O补齐。PCR程序为,94 ℃ 3 min,94 ℃ 10 s,60 ℃ 30 s,40个循环,每个样品设置3次重复,引物序列如表2。
1.2.6 数据统计分析 使用Image-pro plus 6.0软件对果肉组织切片进行图像分析,获得细胞形态学相关参数;使用SPSS 22.0软件对质地参数及细胞形态参数等数据进行统计分析;使用Excel 2010作图。
2 结果与分析
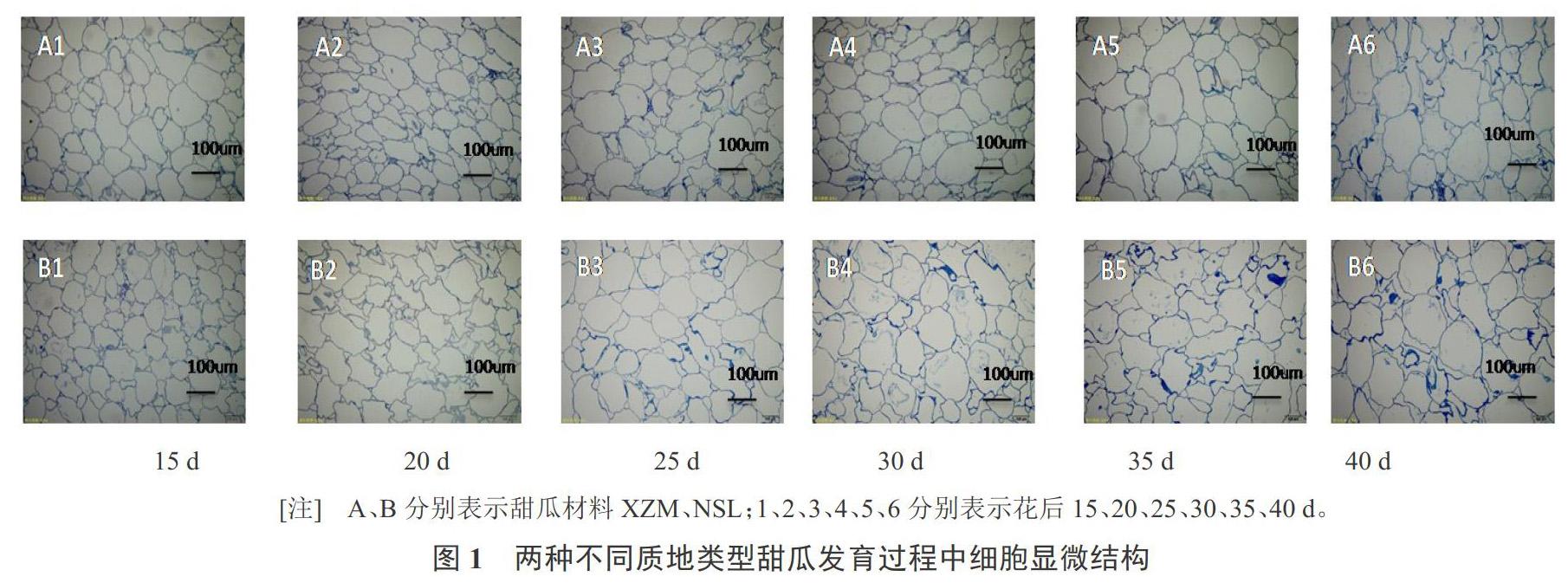
2.1 两种质地甜瓜发育过程中细胞形态学观察
在甜瓜发育不同时期,不同类型甜瓜的细胞大小、排列方式存在差异,在甜瓜果实发育时期细胞增大(图1)。花后15 d到25 d,‘NSL果肉细胞小,细胞排列紧密,褶皱多,随着果实发育成熟,细胞增大,相同视野下细胞数量减少,细胞褶皱减少,细胞间隙增大,细胞排列疏松。成熟期软肉型甜瓜‘NSL的细胞比酥脆型果肉甜瓜‘XZM的大,且排列整齐不一,较疏松,细胞间隙较大,‘XZM细胞较圆,细胞壁褶皱较少。软肉型甜瓜‘NSL花后40 d细胞大小和间隙增大,排列疏松。综上所述,甜瓜果肉的质地受细胞形态、排列方式的影响。
2.2 两种质地甜瓜发育过程中的细胞形态相关参数的变化
不同细胞形态学参数在果实发育不同时期变化趋势不同(表3)。细胞形态参数变化趋势无细胞大小参数明显,花后40 d,软肉型甜瓜材料‘NSL与酥脆型甜瓜材料‘XZM细胞大小和细胞形態等6个细胞相关参数差异均显著,两种材料细胞长度总体呈现逐渐增加的趋势,花后35~40 d,‘NSL细胞大小的增长趋势高于‘XZM,细胞圆度总体呈逐渐减小的趋势,纵横比呈逐渐增大的趋势。
2.3 两种质地甜瓜发育过程中质构参数的变化
甜瓜果实发育不同时期不同口感材料其质构参数变化不同(表4)。脆肉型材料‘XZM果实发育各个时期变化不明显,软肉型材料TPA硬度呈现先升高后降低趋势,花后35~40 d的下降趋势明显,花后40 d为最小值358.96 g,与‘XZM差异显著。花后40 d,‘NSL的咀嚼性与‘XZM差异显著,‘NSL的咀嚼性为各个时期的最小值(64.53 g),‘XZM是其9.84倍。花后25 d,‘XZM的黏附力与各个时期差异显著。‘XZM的穿刺硬度呈先升高后降低的趋势,‘NSL的穿刺硬度呈下降趋势。
2.4 甜瓜果实发育过程中果肉细胞壁酶活性的变化
由图2可知,不同口感类型甜瓜在发育、成熟不同时期,细胞壁酶活性有所不同,同一材料甜瓜在发育、成熟不同时期,质地相关酶酶活性不同。PG活性在甜瓜花后15~35 d,其变化规律不明显,在花后35~40 d,5种材料PG活性均呈上升趋势,且软肉型甜瓜比脆肉型甜瓜的上升趋势明显。Cx活性在花后15~35 d总体呈逐渐上升趋势,花后35~40 d呈下降趋势,且软肉型甜瓜的下降趋势比脆肉型甜瓜的明显。β-Gal活性在软肉型甜瓜中总体呈上升趋势,花后30 d起,上升趋势增大,在脆肉型甜瓜,花后15~20 d呈上升趋势,花后20~40 d呈下降趋势。PME活性在软肉型甜瓜中呈逐渐下降趋势,且软肉型甜瓜中的PME活性在花后15~40 d的任一时期均比脆肉型的高,脆肉型甜瓜PME活性呈先升高后下降的趋势,花后15~20 d呈上升趋势,20~40 d呈下降趋势。以上结果表明,果实质地的变化受多种酶共同影响,不同细胞壁酶在果实发育成熟不同时期发挥作用。
2.5 细胞壁扩展酶基因的表达分析
由图3可知,CmEXP3、CmEXP5、CmEXP9的相对表达量在‘XZM和‘NSL果实发育、成熟不同时期均高于CmEXP6,花后35 d的相对表达量增加,与各时期差异显著。CmEXP3、CmEXP9的相对表达量在脆肉型甜瓜材料‘XZM中总体呈先升高后降低的趋势,花后25 d相对表达量降低。花后35 d,‘NSL的CmEXP3、CmEXP9的相对表达量呈先升高后降低的趋势,花后35 d达到最大值,分别为花后15 d的17.8倍和7.94倍,花后40 d的表达量下降,但相对表达量均高于花后35 d前的各个时期,且相对表达量均高于 ‘XZM。CmEXP5的相对表达量在花后35 d显著增加,达到最大值,为花后15 d的2.74倍。CmEXP6的相对表达量在两材料各个时期的相对表达量较低,总体呈下降趋势。综上所述,花后35 d为细胞壁扩展酶基因表达的关键时期。
3 讨论与结论
笔者对脆肉型甜瓜材料‘XZM和软肉型甜瓜材料‘NSL果实发育不同时期的果肉细胞显微结构、果肉细胞形态学参数进行了研究。花后15~25 d,细胞增大较为明显,该时期为甜瓜果实细胞壁物质积累时期。软肉型甜瓜花后40 d细胞大小和间隙增大,排列疏松。甜瓜果肉的质地受到细胞形态、排列方式的影响,这与李三培等[7]在甜瓜上的研究结果一致。可使用扫描电镜对果肉组织自然断裂面观察,进一步研究‘XZM和‘NSL的果肉组织自然断裂模式对甜瓜质地的影响。通过质构剖面分析测定花后15~40 d每隔5 d各个时期的质构参数变化,花后35~40 d为软肉型甜瓜质构参数变化的关键时期。
对口感不同的甜瓜材料细胞壁酶活性的研究结果表明,果实质地的变化受多种酶共同影响,不同细胞壁酶在果实发育、成熟不同时期发挥作用,可进一步探究甜瓜质地形成过程中的关键酶。张娟等[19]在苹果中研究表明,PG和PME是‘秦冠果实质地变化的关键酶,而β-Gal在‘富士质地变化中发挥关键作用。细胞壁扩展酶基因表达量变化研究表明,甜瓜质地的形成受多个细胞壁扩展酶基因共同调控,花后35 d为细胞壁扩展酶基因表达的关键时期,这与果实质构或许在其发育阶段就已经被决定了[21]的研究结果一致。
笔者研究发现,花后35~40 d为甜瓜质地形成的关键时期,可以从质地差异形成生理、分子机制方面对这一时期深入研究。甜瓜种质资源丰富[22],口感质地多样,笔者取材感官上有区别的软肉和脆肉材料,二者之间细胞壁相关酶活性分析未见显著差异,因此对甜瓜质地研究还需从感官评价、质构等方面进行综合评价。
参考文献
[1] 刘莉,高星,华德平,等.不同的质构检测方法对甜瓜果肉质构的评价[J].天津大学学报(自然科学与工程技术版),2016,49(8):875-881.
[2] 关军锋.果品品质研究[M].石家庄:河北科学技术出版社,2001.
[3] BANK A D.Cell wall disassembly in ripening fruit[J].Functional Plant Biology,2006,33(2):103-119.
[4] 贾艳茹,魏建梅,高海生.质构仪在果实品质测定方面的研究与应用[J].食品科学,2011,32(S1):184-186.
[5] 刘亚平,李红波.物性分析仪及TPA在果蔬质构测试中的应用综述[J].山西农业大学学报(自然科学版),2010,30(2):188-192.
[6] 潘好斌,刘东,邵青旭,等.不同品种薄皮甜瓜成熟期果实质地品质分析及综合评价[J].食品科学,2019,40(21):35-42.
[7] 李三培,华德平,高星,等.不同类型甜瓜成熟过程中果肉质地及其细胞显微结构的变化[J].西北植物学报,2017,37(6):1118-1125.
[8] 李红光,刘俊灵,党美乐,等.苹果新品种‘瑞阳及其亲本果实组织结构的比较分析[J].果树学报,2018,35(10):1182-1189.
[9] HOU J,SUN Y,CHEN F,et al.Analysis of microstructures and macrotextures for different apple cultivars based on parenchyma morphology[J].Microscopy Research and Technique,2016,79(4):304-312.
[10] 刘世鹏,刘申,文欣.枣果肉解剖结构及其裂果性研究[J].北方园艺,2017(14):32-38.
[11] TOIVONEN P M A,BRUMMELL D A.Biochemical bases of appearance and texture changes in fresh-cut fruit and vegetables[J].Postharvest Biology and Technology,2007,48(1):1-14.
[12] GOULAO L F,OLIVEIRA C M.Cell wall modifications during fruit ripening:when a fruit is not the fruit[J].Trends in Food Science and Technology,2007,19(1):4-25.
[13] SANEV A,CHOURASIA A,NATH P.Softening in mango (Mangifera indica cv.Dashehari) is correlated with the expression of an early ethylene responsive,ripening related expansin gene,MiExpA1[J].Postharvest Biology and Technology,2005,38(3):223-230.
[14] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[15] 魏建梅,马锋旺.苹果果实发育期间细胞壁组分变化特性[J].西北植物学报,2009,29(2):314-319.
[16] ORTIZ A,GRAELL J,LARA I.Preharvest calcium applications inhibit some cell wall-modifying enzyme activities and delay cell wall disassembly at commercial harvest of ‘Fuji Kiku-8apples[J].Postharvest Biology & Technology,2011,62(2):161-167.
[17] 魏建梅,马锋旺.苹果果实β-Gal和LOX活性变化特性及其与果实软化的关系[J].园艺学报,2009,36(5):631-638.
[18] 曾秀丽,张光伦,李春燕,等.三个脐橙品種果实主要细胞壁酶动态变化研究[J].亚热带植物科学,2006(2):12-16.
[19] 张娟,高滋艺,杨惠娟,等. ‘秦冠和‘富士质地差异的解剖学观察及相关酶活性研究[J]. 西北农业学报,2015,24(10):88-94.
[20] 胡宝刚.西瓜ACC合成酶基因的表达分析与克隆[D].天津:天津大学,2010.
[21] CHAIB J,DEVAUX M,MARIE-GHISLAINE G,et al.Physiological relationships among physical,sensory,and morphological attributes of texture in tomato fruits[J].Journal of Experimental Botany,2007,58(8):1915-1925.
[22] 王吉明,尚建立,李娜,等.我国西瓜甜瓜种质资源收集、保存与利用研究进展[J].中国瓜菜,2018,31(2):1-6.
