sCD163及相关因子在稳定期哮喘炎症表型中的表达及临床意义
2020-06-19李睿宣立航胥国文冯显莉曾雪梅
李睿 宣立航 胥国文 冯显莉 曾雪梅
1四川省八一康复中心内科,成都611135;2四川省八一康复中心门诊部,成都611135;3成都市青羊区黄田坝成飞医院呼吸科610091
支气管哮喘 (哮喘)是一类由多种炎症细胞参与的慢性气道炎症反应性疾病,根据诱导痰炎症细胞分类可分为嗜酸粒细胞增多型哮喘(eosinophiis asthma,EA)、中性粒细胞增多型哮喘(neutrophilic asthma,NA)、粒细胞缺乏型哮喘 (paucigranulocytic asthma,PA)及混合细胞型哮喘 (mixed granulocytic asthma,MA)[1],不同的哮喘炎症表型患者其临床特征和治疗反应性具有异质性[2]。但是笔者基于常年的临床经验,认为哮喘患者的气道炎症表型在稳定期和急性发作期时可能存在一定的差异性,对治疗的反应性亦有所不同。巨噬细胞在免疫反应调整中处于中心位置,与各种免疫细胞之间均存在密切联系[3]。IL-6、IL-8等典型的抗炎介质可通过与单核-巨噬细胞膜表面的CD163 蛋白结合,调节炎症反应的发生[4]。CD163作为活化的M2型巨噬细胞特异性表面分子标志物,在炎症反应中的生物学作用已被证实[5],并且有研究显示,CD163 可能还参与气道组织重塑[6]。因此我们推测可溶性CD163 (soluble CD163,sCD163)可客观、定量的反映气道炎症水平。现研究报道如下。
1 对象与方法
1.1研究对象 随机选择2016年1月至2018年10月期间在成都中医药大学附属四川省康复医院/四川省八一康复中心内科接受治疗且符合以下纳入标准和排除标准的哮喘病患者172 例,作为哮喘组,男98例,女74例,年龄(61.74±16.35)岁,年龄范围为18~82岁。哮喘患者纳入标准: (1)成年患者,男女不限;(2)符合中华医学会呼吸病学分会哮喘学组制订的 《支气管哮喘防治指南》[7]关于哮喘的诊断标准;(3)患者4周内无哮喘急性发作,或者因急性发作于门诊就诊或住院的哮喘患者,哮喘稳定4周后来院复查时采集诱导痰液样本和血清样本。排除标准:(1)4周内发生呼吸道感染者;(2)合并肺栓塞,肺间质纤维化,活动性肺结核史,肺炎,肺气肿,血液系统疾病,消化系统疾病,严重心、肝、肾功能不全,恶性肿瘤患者;(3)近半年内接受过大手术治疗者。另外,随机选择30例同时期在四川省八一康复中心门诊进行体格检查且同意做支气管激发试验的健康志愿者作为健康组,男15 例,女15 例,年龄 (60.75±18.44)岁,年龄范围为26~80岁。健康志愿者肺功能检查正常,支气管激发试验阴性;排除入组前4周出现呼吸道感染症状以及其他慢性疾病者。2组研究对象的年龄、性别比差异无统计学意义(P >0.05)。参与该试验的所有受试对象均签署知情同意书,该试验经过四川中医药区域伦理审查委员会批准(SC20160216)。
1.2研究方法
1.2.1肺功能检查 采用美国麦加菲肺功能仪测试所有患者的肺部功能指标,包括第1秒用力呼气容积 (forced expiratory volume in one second,FEV1)、FVC、FEV1/FVC。
1.2.2诱导痰的收集 FEV1占预计值百分比(forced expiratory volume in one second as a percentage of expected value,FEV1%pred)<60%者雾化吸入0.9%氯化钠溶液20 min进行痰诱导,其余受试者则使用4.5%氯化钠溶液进行痰诱导。当FEV1%pred下降≥15%超过2次时或者患者不能耐受时停止痰诱导。选取诱导痰中的浓稠痰液3~5 ml。保证在2 h内完成对痰液的检测 (室温),否则可暂时储存于4 ℃冰箱中。
1.2.3诱导痰的处理 将痰液置于无菌培养皿中,记录痰细胞团块体积。加入0.1% DTT 工作液,充分裂解痰细胞团块。30 min后加入PCS终止裂解反应。过滤,收集滤液,显微镜下计数。全细胞计数 (total cell count,TCC)=炎性细胞计数(活细胞+死细胞)×0.02/象限数,细胞存活率%=活细胞数/总细胞数×100%。制备单层痰细胞涂片,分别进行Chromotrope 2R (C2R 酸)染色和May-Grunwald Giemsa染色。
1.2.4痰涂片炎症细胞计数 将痰涂片置于光学倒置显微镜下,随机选择10个视野,计数400个非鳞状上皮细胞的炎症细胞和鳞状上皮细胞个数。
1.2.5酶联免疫吸附测定 (enzyme linked immunosorbent assay,ELISA)法测定血清炎症介质水平 采集受试者肘静脉血3 ml,分别置于EDTA 抗凝管和促凝管中。采用ELISA 试剂盒检测sCD163、IL-1β、IL-4、IL-5、IL-8、IL-9、IL-6水平。试剂盒购自加拿大瑞邦公司。所有操作按照试剂盒说明书或仪器操作说明书规定的步骤进行。
1.2.6呼出气一氧化氮 (fractional exhaled nitric oxide,FeNO)检测 受试者取坐位,进行最大呼气,将过滤器迅速含入嘴中,呼气至最大肺活量,采用NIOX 一氧化氮测定仪 (瑞典尼尔斯公司)检测FeNO (ppb) (1 ppb=1×10-9mo1/L),立即以持续50 ml/s的速率呼气10 s,进行3次,取平均值。
1.3哮喘患者分组 根据诱导痰液炎症细胞比例进行分型,EA 型:嗜酸粒细胞≥3%,中性粒细胞<64%;NA 型:嗜酸粒细胞<3%,中性粒细胞≥64%;MA 型:嗜酸粒细胞≥3%,中性粒细胞≥64%;PA 型:嗜酸粒细胞<3%,中性粒细胞<64%。
1.4统计学分析 本资料采用SPSS 17.0统计学软件对数据进行处理。所有计量资料均进行正态性检验,近似正态分布或正态分布的计量资料以±s 表示。2组间比较采用独立样本t 检验,多组间比较采用方差分析。计数资料以例数 (%)表示,组间比较用χ2检验。相关性分析采用Spearman分析。P <0.05为差异有统计学意义。
2 结果
2.12组受试者一般临床资料和血清炎性介质水平比较 2组受试者的年龄、性别构成、吸烟者比例、血清IL-4、IL-9含量差异均无统计学意义 (t=1.460、1.828,P 值均>0.05)。但是哮喘组患者IL-1β、IL-5、IL-6、IL-8、sCD163水平明显高于健康组志愿者,差异均有统计学意义 (t =7.788、5.385、3.144、8.216、11.038,P 值均<0.05)。见表1。
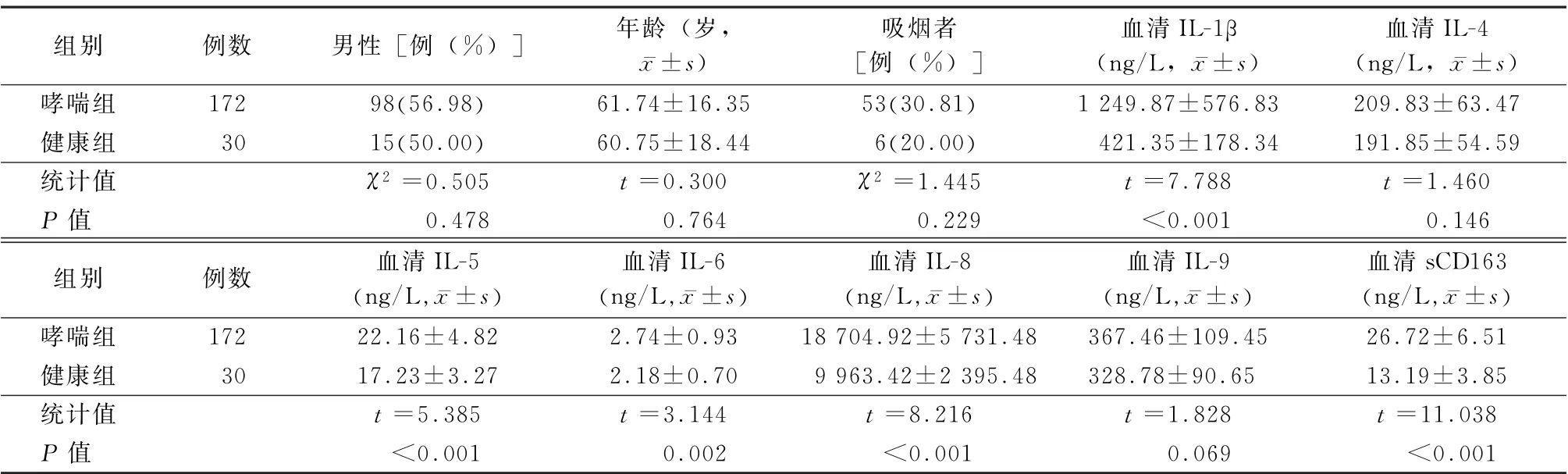
表1 2组受试者一般临床资料和血清炎性介质水平比较
2.2哮喘患者炎症分型 对172例稳定期哮喘患者的合格诱导痰标本进行诱导痰细胞薄层涂片。其中79 例 (45.93%) 患 者 为 EA 型,83 例(48.26%)患者为PA 型,3例 (1.74%)患者为MA 型,7例(4.07%)患者为NA 型。
2.3不同炎症表型患者的临床特点 EA 型患者FeNO 值高于其他3个表型患者,差异有统计学意义(F =12.509,P <0.05)。4 个表型患者诱导痰样本中TCC基本一致,差异无统计学意义(F=1.900,P >0.05)。另外,MA 型患者痰中性粒细胞计数远远高于其他3 个表型患者,并且MA 型和NA 型患者痰中性粒细胞百分比高于EA 型和PA 型患者,差异均有统计学意义 (F =695.904、2.890,P 值均<0.05)。EA 型和MA 型患者诱导痰嗜酸粒细胞计数和百分比明显高于PA 型和NA型患者,差异均有统计学意义 (F =1 080.975、136.314,P 值均<0.05)。而EA 型和PA 型痰巨噬细胞计数和百分比明显高于MA 型和NA 型患者,差异均有统计学意义 (F = 23.149、464.899,P 值均<0.05)。见表2。
2.4不同炎症表型患者血清炎性介质水平比较 经ELISA 检测,EA、PA、MA、NA 组稳定期哮喘患者外周血清中IL-1β、IL-4、IL-9水平差异均无统计学意义 (F =2.378、2.378、0.648,P 值均>0.05);而NA 组患者血清IL-6 和IL-8 水平明显高于其他3个表型患者,差异均有统计学意义(F =2.890、12.329,P 值均<0.05)。PA 组患者血清IL-5水平明显低于其他3个表型患者,而sCD163水平却高于其他3个表型患者,差异均有统计学意义 (F =21.182、14.506,P 值均<0.05)。见表3。
2.5各炎症介质与哮喘患者临床特性的相关性分析 如表4所示, (1)血清IL-1β、IL-6、IL-8水平与FeNO 呈负相关 (r =-0.439、-0.571、-0.372,P 值均<0.05);sCD163 水平与FeNO呈正相关 (r=0.364,P <0.05)。 (2)IL-1β、IL-6、IL-8与痰中性粒细胞计数均呈正相关 (r=0.374、0.264、0.325,P 值均<0.05)。(3)IL-5与痰嗜酸粒细胞计数呈正相关 (r=0.298,P <0.05),而IL-6、IL-8、sCD163与痰嗜酸粒细胞计数均呈负相关(r=-0.329、-0.201、-0.411,P 值均<0.05)。(4)除了IL-1β和IL-5以外,其余各血清炎症介质水平与痰巨噬细胞计数均呈正相关(r=0.369、0.409、0.189、0.473、0.322,P值均<0.05)。见表4。
3 讨论
表2 比较4个表型患者的临床特点 (±s)
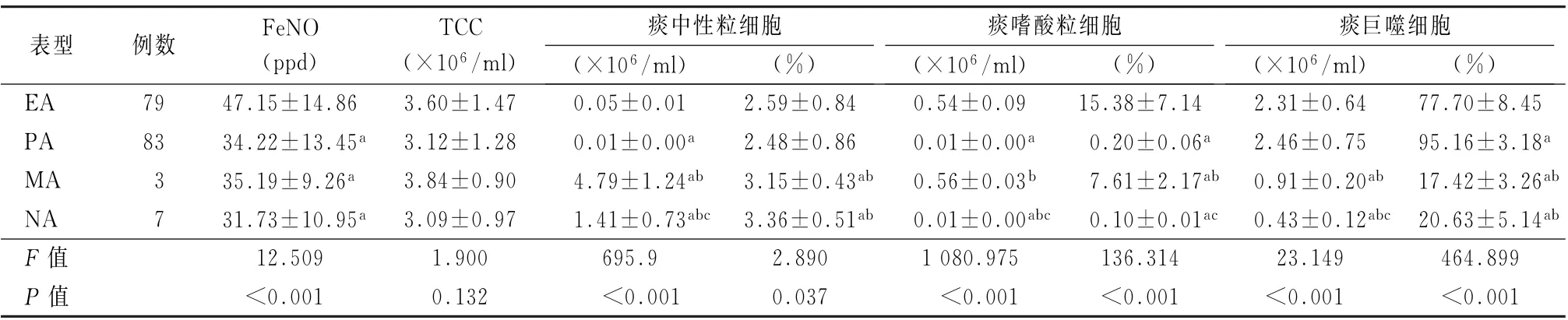
表2 比较4个表型患者的临床特点 (±s)
注:EA 为嗜酸粒细胞增多型哮喘;PA 为粒细胞缺乏型哮喘;MA 为混合细胞型哮喘;NA 为中性粒细胞增多型哮喘;FeNO 为呼出气一氧化氮;TCC为全细胞计数;与EA 型患者比较,a P <0.05;与PA 型患者比较,b P <0.05;与MA 型患者比较,c P <0.05;1 ppb=1×10-9/mol/L
表型 例数 FeNO(ppd)TCC(×106/ml)痰中性粒细胞痰嗜酸粒细胞痰巨噬细胞(×106/ml) (%)(×106/ml) (%)(×106/ml) (%)EA 79 47.15±14.86 3.60±1.47 0.05±0.01 2.59±0.84 0.54±0.09 15.38±7.14 2.31±0.64 77.70±8.45 PA 83 34.22±13.45a 3.12±1.28 0.01±0.00a 2.48±0.86 0.01±0.00a 0.20±0.06a 2.46±0.75 95.16±3.18a MA 3 35.19±9.26a 3.84±0.90 4.79±1.24ab 3.15±0.43ab 0.56±0.03b 7.61±2.17ab 0.91±0.20ab 17.42±3.26ab NA 7 31.73±10.95a 3.09±0.97 1.41±0.73abc 3.36±0.51ab 0.01±0.00abc 0.10±0.01ac 0.43±0.12abc 20.63±5.14ab F 值 12.509 1.900 695.9 2.890 1 080.975 136.314 23.149 464.899 P 值 <0.001 0.132 <0.001 0.037 <0.001 <0.001 <0.001 <0.001
表3 比较4个表型患者血清IL-1β、IL-4、IL-5、IL-6、IL-8、IL-9、sCD163水平的差异 (ng/L,±s)
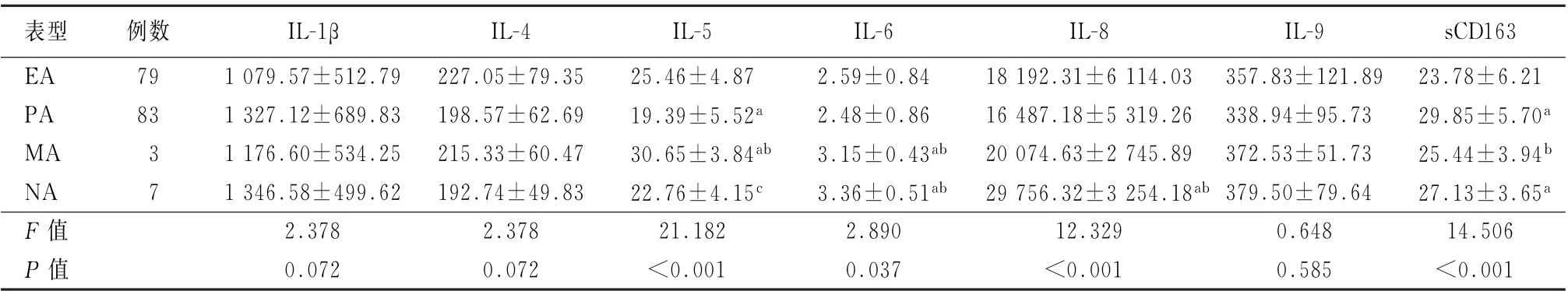
表3 比较4个表型患者血清IL-1β、IL-4、IL-5、IL-6、IL-8、IL-9、sCD163水平的差异 (ng/L,±s)
注:EA 为嗜酸性粒细胞增多型哮喘;PA 为粒细胞缺乏型哮喘;MA 为混合细胞型哮喘;NA 为中性粒细胞增多型哮喘;sCD163为可溶性CD163;与EA 型患者比较,a P <0.05;与PA 型患者比较,b P <0.05;与MA 型患者比较,c P <0.05
表型 例数 IL-1β IL-4 IL-5 IL-6 IL-8 IL-9 sCD163 EA 79 1 079.57±512.79 227.05±79.35 25.46±4.87 2.59±0.84 18 192.31±6 114.03 357.83±121.89 23.78±6.21 PA 83 1 327.12±689.83 198.57±62.69 19.39±5.52a 2.48±0.86 16 487.18±5 319.26 338.94±95.73 29.85±5.70a MA 3 1 176.60±534.25 215.33±60.47 30.65±3.84ab 3.15±0.43ab 20 074.63±2 745.89 372.53±51.73 25.44±3.94b NA 7 1 346.58±499.62 192.74±49.83 22.76±4.15c 3.36±0.51ab 29 756.32±3 254.18ab 379.50±79.64 27.13±3.65a F 值 2.378 2.378 21.182 2.890 12.329 0.648 14.506 P 值 0.072 0.072 <0.001 0.037 <0.001 0.585 <0.001
哮喘属于一类气道慢性变态反应性炎症性、且具有典型的异质性呼吸道疾病,发病机制复杂。2009年,全球哮喘防治指南首次引入炎症表型的概念,根据气道内炎症细胞浸润的种类,将哮喘患者分为EA 型、NA 型、PA 型和MA 型[8]。但是稳定期和急性发作期的炎症表型通常是不一致的,因此单纯依靠患者表型评估对治疗的反应性以及判断预后可能敏感性欠佳。
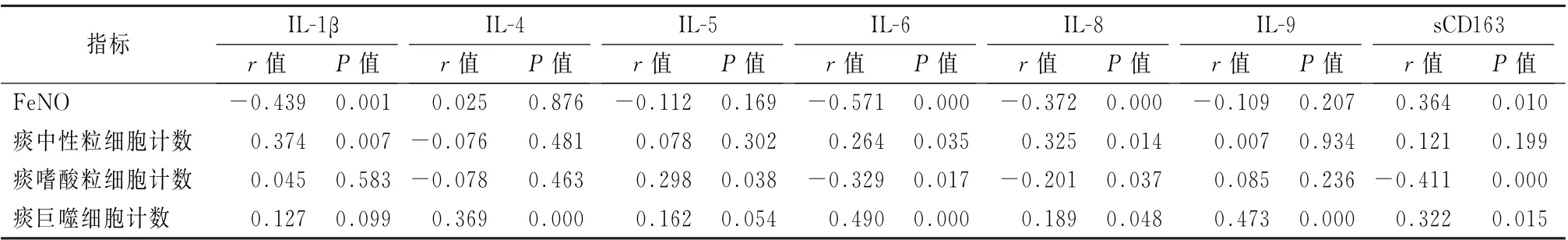
表4 血清炎症介质与诱导痰中各炎症细胞之间的相关性
除了嗜酸粒细胞、中性粒细胞等炎症细胞以外,单核/巨噬细胞在哮喘发作的过程中也发挥着重要作用。传统观点认为,辅助性T 细胞 (T helper cell,Th)亚群失衡是诱发哮喘的重要机制之一[9]。IL-4、IL-5、IL-9等都属于典型的Th2细胞因子,可以促使嗜酸粒细胞浸润,大量释放组织胺类物质,从而诱发哮喘。但是近几年,越来越多的研究证实固有免疫应答也是哮喘发作的主要原因之一。Alvarado-Vazquez等[10]通过建立哮喘小鼠模型,发现肺泡灌洗液中M1型巨噬细胞的计数升高,而M2型巨噬细胞计数降低,两者呈负相关。提示M2型巨噬细胞在抑制哮喘气道炎症发展中可能扮演重要角色。巨噬细胞是最重要的固有免疫细胞,在不同的微环境中可被诱导为MA 型和M2型两种不同表型。而M2 型巨噬细胞主要参与Th2反应,例如在免疫系统疾病、变态反应中对抗促炎反应和细胞免疫应答,从而减轻炎性浸润和组织损伤[11]。CD163是表达于巨噬细胞表面的清道夫受体之一,是M2型巨噬细胞活化的重要标志分子。其胞外段可被酶水解进入外周循环中成为sCD163片段,利用ELISA 方法可进行检测。范春红等[12]证实,重症肺炎者血清sCD163 水平可迅速升高,并且与患者预后密切相关,提示sCD163可能参与呼吸道炎症反应。Zhi等[13]也提出sCD163可作为哮喘治疗的潜在靶点。
为了探讨炎症细胞和炎性介质在哮喘中的作用机制以及关联意义,我们采用ELISA 法检测了哮喘患者外周血清中sCD163以及相关重要IL 分子的水平。发现哮喘患者IL-1β、IL-5、IL-6、IL-8及sCD163 水平明显高于健康志愿者,而且sCD163水平与FeNO 呈正相关。FeNO 是反应哮喘患者气道炎症程度的重要指标之一,说明sCD163有可能也参与了早期气道炎性浸润和组织损伤过程。除此以外,我们还发现,血清sCD163水平与诱导痰样本中嗜酸粒细胞计数呈负相关,且在PA 型患者中的水平最高,而在EA 型患者中的水平最低。因此我们推测血清中CD163水平可反应气道内嗜酸粒细胞的炎症水平,嗜酸粒细胞大量分泌通过促使某些炎性介质的释放,刺激M2型巨噬细胞活化,使血清中sCD163水平降低。但是具体的调控机制需要后续从细胞和分子水平进一步证实。
除此以外,IL-1β、IL-4、IL-5、IL-6、IL-8、IL-9等都是哮喘炎症反应中重要的促炎因子。IL-1β、IL-4、IL-5、IL-9 都是由单核-巨噬细胞分泌的细胞因子,可以促进Th2 细胞分化,刺激嗜酸粒细胞增殖、活化,进而分泌多种炎症介质引起气道慢性炎症[14]。但是本项研究中并未发现IL-1β、IL-4与哮喘患者炎症表型有关,可能由于稳定期哮喘患者MA 型和NA 型较为少见,导致纳入研究的患者人数太少有关。但是MA 型患者血清IL-5水平明显高于其他3种类型患者,且与痰嗜酸粒细胞计数呈正相关。据推测可能由于IL-5对嗜酸粒细胞的刺激和活化作用可能是特异性的,对中性粒细胞和巨噬细胞并没有趋化影响。另外,IL-9属于一类多效性细胞因子,可以促进肥大细胞和M2型巨噬细胞的分化和成熟,对嗜酸粒细胞和中性粒细胞的作用较弱。IL-6和IL-8是由单核/巨噬细胞、内皮细胞及中性粒细胞等产生的、常见的经典的炎症介质,对白细胞有极强的趋化、聚集活性,可显著诱导中性粒细胞、巨噬细胞的吞噬、脱颗粒等作用[15]。在本项研究中,我们也发现,IL-6、IL-8水平与中性粒细胞计数和巨噬细胞计数呈正相关,但是与嗜酸粒细胞呈负相关。可能由于IL-6、IL-8可促使巨噬细胞向M2型转化,导致巨噬细胞对嗜酸粒细胞的吞噬能力增加。
综上所述,哮喘患者在稳定期时血清sCD163水平较健康志愿者明显升高,可能参与了哮喘的发病过程,并且与炎症细胞和炎性介质之间存在一定关联。但是不同炎症表型的哮喘患者其炎症细胞和炎性介质的水平也存在较大差异,血清sCD163在EA 患者中表达水平相对较低,因此更倾向于抑制气道内嗜酸粒细胞性的炎性介质浸润,为进一步研究巨噬细胞及其他炎症细胞在哮喘中的作用提供了一定的理论基础。
利益冲突所有作者均声明不存在利益冲突
