一株高效降解青霉素菌的筛选及鉴定
2020-06-19王礼君冯丽妍徐建中张伟国
王礼君 , 冯丽妍 , 徐建中 *, 张伟国
(1.江南大学生物工程学院,江苏无锡214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡214122)
青霉素作为一种高效、广谱的抗生素具有很强的抑菌杀菌作用,但是在实际生活中,特别是医疗和畜禽养殖业很容易过度使用而导致抗生素渗入环境介质中,进而影响环境微生物群的结构和活性,诱导产生各类抗生素耐药菌[1-2]。当前,国内外在城市污水、养殖场废水与土壤中都有检测到较高的抗生素残留,因此从源头上控制抗生素的使用,以及在对含抗生素的废渣废液进行排放前进行高效的处理显得尤为重要。此外,我国是世界上最大的青霉素生产国和出口国,会产生大量的青霉素菌渣,传统处理中菌渣作为废弃物进行填埋或者焚烧处理,浪费了大量有机资源,且不能有效处理掉菌渣中残留的青霉素,对环境存在巨大的潜在威胁。目前,我国还没有完整且成熟的化学集中处理工艺,且耗资较大,不适用于菌渣大规模的处理。相比之下,利用堆肥化处理青霉素菌渣,通过堆肥过程中微生物作用降解残留青霉素,拥有绿色、环保、经济、处理方式简单等优点。因此,从土壤或菌渣中筛选得到一种具有高效降解青霉素能力的菌株,将极大地缩短堆肥化的时间,提高菌渣中残留青霉素降解效率,不仅实现了菌渣的无害化处理,还对菌渣的进一步回收利用具有极大的实际意义和经济价值。
国内已有部分关于降解青霉素的研究,例如岳喜庆[3]等分离出一株能高效降解青霉素钠的菌WM1,在菌株接种体积分数为10%并以青霉素钠为惟一碳源的条件下,培养9 h对初始质量浓度为10 mg/L的青霉素钠的降解率达到100%;付欢[4]等筛选出一株对青霉素具有高效降解能力的菌JZ6,在培养条件为30℃、pH 6.7并且外加碳氮源的条件下,培养24 h可以对初始质量浓度为300 mg/L的青霉素的降解率达到99.98%;赵娟[5]等分离出一株具有高效降解青霉素能力的菌PC-2,在接种体积分数为14%,培养温度为37℃、pH 7.0左右的培养条件下,外加碳氮源,培养6 h可使菌株对初始质量浓度为400 mg/L的青霉素的降解率达到98%。已研究菌株对青霉素的抗性较低,降解效率虽然可在较短时间内达到99%,但青霉素初始质量浓度较低,无法满足工业特别是一些含有较高质量浓度的青霉素的菌渣的初步处理要求,限制了菌株在实际生产生活中的应用。
作者通过从青霉素钠生产企业附近的土壤样品中分离筛选出具有较高青霉素钠抗性的菌株,考察菌株对青霉素钠的降解能力,并探究菌株在一定条件下的最佳降解条件,以期得到一种高浓度的青霉素钠的高效降解菌。此菌株可用于处理含有较高浓度的青霉素钠的菌渣、工业废水及农场废弃物等,带来更大的实际效益,实现安全、高效的排放。
1 材料与方法
1.1 材料与仪器
样品为取青霉素生产企业附近的土壤若干,青霉素钠160万单位,华北制药集团生产。主要仪器有电子显微镜、紫外可见光分光光度计、高效液相色谱仪、PCR仪、电泳仪、凝胶成像仪等。
1.2 主要培养基
LBG培养基:葡萄糖5 g,蛋白胨10 g,酵母膏5 g,NaCl 10 g,蒸馏水定容至 1 000 mL,pH 7.0。
降解培养基:KH2PO43 g,K2HPO41 g,NaCl 0.1 g,MgSO4·7H2O 2 mg,MnSO42 mg,FeSO4·7H2O 2 mg,CaCl21 mg,碳源 5 g,氮源 5 g,蒸馏水定容至1 000 mL。
培养基于121℃灭菌20 min,如要制成固体培养基则向培养基中加入终质量浓度为20 g/L的琼脂条。对于降解培养基,青霉素钠溶液过滤除菌后按一定终质量浓度添加。
1.3 方法
1.3.1 菌株鉴定
1)降解青霉素钠菌株的富集和分离 称取样品土壤各10 g,分别放入装有100 mL无菌水和一层玻璃珠的锥形瓶中,100 r/min摇床振荡15 min,充分打散,制成菌悬液,取蒸馏水稀释至10-4~10-6倍,取菌悬液150 μL涂布到含青霉素钠质量浓度为5 g/L的LBG培养基上,置于30℃恒温培养箱中培养48 h。挑取生长良好的菌株逐步转接至含青霉素钠质量浓度为 10、15、20、30 g/L 的 LBG 培养基上,选择能耐受较高质量浓度的青霉素钠的菌株进行分离纯化。通过对菌落菌体的形态特征观察初步确定菌株的种属。
2)全基因组的提取及18S rRNA的扩增 全基因组的提取采用康为世纪酵母基因组DNA提取试剂盒。使用通用引物ITS1和ITS4对菌株的18S rRNA进行PCR扩增,PCR产物测序由通用生物系统(安徽)有限公司完成。
3)序列同源性比对及系统发育树的构建 根据测序结果在NCBI中进行Blast比对,并在MEGA 7.0软件中用Neighbor-Joining法构建系统发育树,并进行1 000次Bootstraps检验。
1.3.2 青霉素钠降解菌株生长曲线的测定 挑取1~2环菌株接入LBG培养基中,30℃摇瓶培养至菌液浑浊后以1%接种体积分数接入降解培养基中,并于最适生长条件下进行摇瓶培养,定时取样测定菌液的OD600值。
1.3.3 青霉素钠降解菌降解效率的测定
1)样品制备与液相色谱条件 向基础培养基中加入终质量浓度为10 g/L的青霉素钠,含有最佳碳氮源的降解培养基记作第一组,不加入碳氮源的降解培养基记作第二组。取于最佳生长条件下培养32 h的发酵液1 mL加入4 mL缓冲液 (乙腈∶水=4∶1)中,混匀后10 000 r/min高速离心10 min,上清液进行液相处理。色谱检测条件为225 nm,进样量20μL,流速 0.5 mL/min,流动相选用V(磷酸二氢钾(pH 3.5))∶V(甲醇)=38∶62[6]。
2)青霉素钠溶液标准曲线的测定 青霉素钠溶液的标准质量浓度曲线:用降解培养基作为溶剂配置不同质量浓度的青霉素钠溶液并作3个平行样,在相同色谱条件下进样,以青霉素钠质量浓度为横坐标,对应色谱图的峰面积为纵坐标绘制青霉素钠质量浓度的标准曲线。
1.3.4 接种体积分数对降解效率的影响 在含有青霉素钠终质量浓度为10 g/L的降解培养基中分别接种体积分数1%、5%、10%、15%、20%、30%的菌液,于30℃的恒温摇床中培养,取24 h的菌液进行液相色谱分析。
1.3.5 青霉素钠的初始质量浓度对降解效率的影响 在已知最佳菌株接种体积分数的降解培养基中,加入终质量浓度分别为 5、10、15、20、30、40 g/L的青霉素钠,于30℃的恒温摇床中培养,取24 h的菌液进行液相色谱分析。
1.3.6 培养时间对降解效率的影响 确定出菌株的最佳接种体积分数和青霉素钠的初始质量浓度后,在该条件于30℃的恒温摇床中培养,分别取12、24、36、48、60、72、84 h 的菌液进行分析,探究培养时间对降解效率的影响。
1.3.7 Anti-Pen20降解青霉素钠的产物分析 取菌株在降解培养基中培养24 h的发酵液进行液相色谱-质谱联用技术分析,确定菌株降解青霉素钠的产物。
2 结果与讨论
2.1 菌株的鉴定
2.1.1 菌株的初步鉴定结果 将土壤样品中的菌株涂布在含有质量浓度为5 g/L青霉素钠的LBG培养基上,培养后挑选出8株耐药菌株,分别编号为J1、J2、J3、J4、J5、J6、J7、J8, 通过划线分离纯化再逐步提高培养基中青霉素钠的质量浓度至30 g/L,以及后期对各菌株降解青霉素钠效率的比较,最终在青霉素钠的质量浓度为20 g/L的LBG培养基上挑选出一株生长良好的青霉素钠高效降解菌株J4,命名为Anti-Pen20。对Anti-Pen20的划线分离结果见图1(a)。在LBG固体培养基上菌落呈橙红色且具有光泽,圆形,边缘光滑,易挑起。从电镜图片1(b)中可以看到菌株Anti-Pen20为椭圆形,无鞭毛,菌体表面光滑,有出芽现象,菌体长5μm,宽3μm左右。

图1 菌株Anti-Pen20的菌落特征及电镜扫描图Fig.1 Colony characteristics and electron microscope scans of strain Anti-Pen20
2.1.2 菌株的分子鉴定结果 经初步的生理生化鉴定菌株Anti-Pen20为酵母菌属,采用康为世纪酵母基因组DNA提取试剂盒提取Anti-Pen20的全基因组,通过PCR扩增获得菌株的18S rRNA基因的目的片段,由琼脂糖凝胶电泳显示片段的大小约为700 bp左右,见图2。对PCR产物纯化后进行测序,测序结果显示,菌株Anti-Pen20的18S rRNA长度为621 bp,其序列如下:


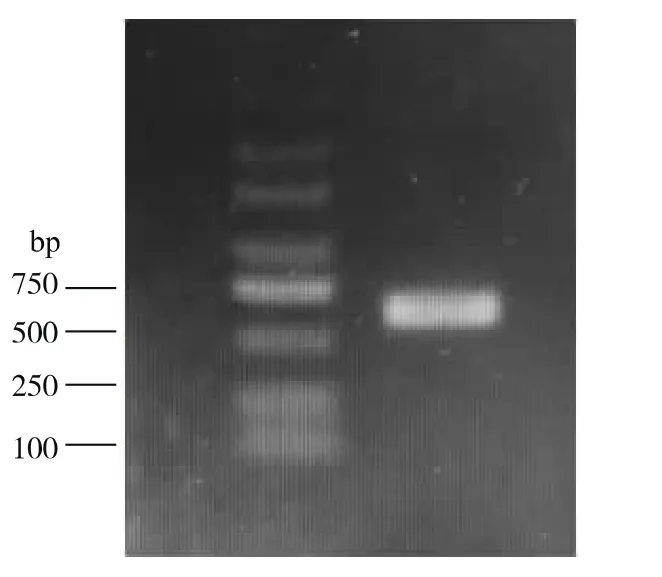
图2 18S rRNA PCR扩增结果Fig.2 PCR amplification of 18S rRNA
将测序结果在NCBI上进行序列比对,发现菌株Anti-Pen20 与粘质红酵母(Rhodotorula mucilaginosa)的序列同源性在99%以上,通过MEGA7软件中的Neighbor-Joining分析方法构建出菌株的系统发育树图[7-8],见图3。菌株Anti-Pen20已保藏在中国典型培养物保藏中心 (China Center for Type Culture Collection,简称 CCTCC),菌种保藏登记号为:CCTCC M 2018202。
目前部分关于粘质红酵母(Rhodotorula mucilaginosa)的研究表明,粘质红酵母表现出良好的拮抗酵母特性,其能在水果表皮上生长而对由病菌引起的水果病变表现出显著的拮抗效果[9-10],可以控制并降解水果及其制品中的展青霉素[11]。另有报道表明,粘质红酵母可通过添加至鱼类、家禽类的养殖饲料中来增强养殖动物的抗病性,提高产品质量[12-13]。
2.2 菌株Anti-Pen20的生长曲线
图4为菌株Anti-Pen20在降解培养基中的生长曲线图,生长温度为30℃,pH 7.0,恒温摇床转速100 r/min。由图4可以看出,Anti-Pen20在前8个小时内生长较慢,培养的第8~16小时为菌株的生长对数期,在培养20 h后进入了生长稳定期。

图3 菌株Anti-Pen20的系统发育树图Fig.3 Phylogenetic tree of strain Anti-Pen20
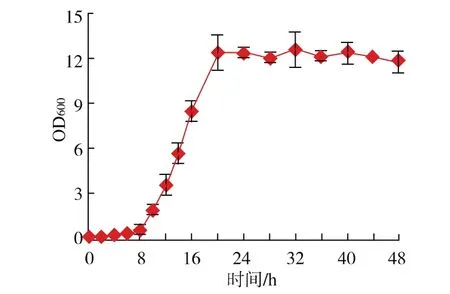
图4 Anti-Pen20的生长曲线图Fig.4 Growth curve of Anti-Pen20
2.3 接种体积分数对降解效率的影响
在培养基中青霉素钠初始质量浓度为10 g/L、30℃恒温摇床培养24 h的条件下,不同接种体积分数Anti-Pen20菌液的青霉素钠降解率见图5。从图5可知,青霉素降解率在接种体积分数为1%~15%区间逐步上升,但在接种体积分数超过15%时,降解率显著降低,因此菌株Anti-Pen20降解青霉素钠的最佳接种体积分数为15%。
2.4 青霉素钠的初始浓度对降解效率的影响
在确定接种体积分数为15%的条件下,向培养基中加入不同质量浓度的青霉素钠溶液,在30℃恒温摇床中培养24 h,得到的降解结果见图6。从图6可知,在测试的青霉素钠质量浓度为5~20 g/L范围内,菌株Anti-Pen20对青霉素钠的降解率都保持较高水平,其中青霉素钠质量浓度为20 g/L时的降解率达到85%。然而,但青霉素钠质量浓度大于20 g/L时,降解率显著下降,其原因可能是高质量浓度的青霉素钠溶液抑制了菌株的生长,从而影响青霉素钠的降解。因此,确定菌株Anti-Pen20最佳青霉素钠降解质量浓度为20 g/L。
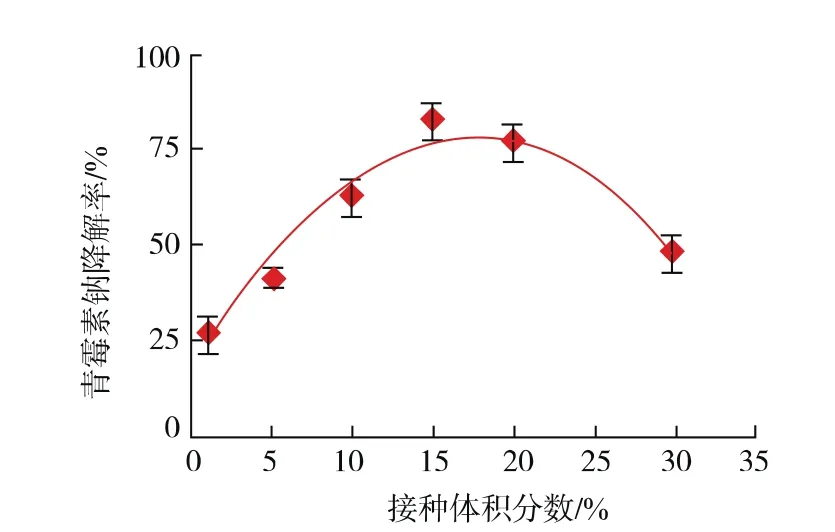
图5 接种体积分数对降解效率的影响Fig.5 Effect of inoculum size on degradation efficiency
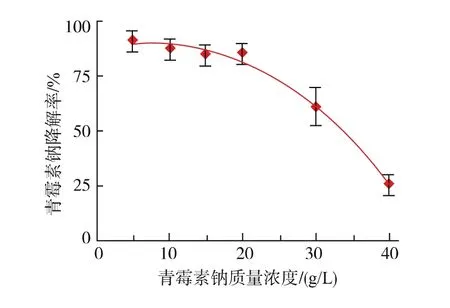
图6 青霉素钠的初始质量浓度对降解效率的影响Fig.6 Effect of initial concentration of penicillin sodium on degradation efficiency
2.5 培养时间对青霉素钠降解效率的影响
菌株Anti-Pen20在接种体积分数为15%,青霉素钠初始质量浓度为20 g/L的条件下,在前24小时内的降解青霉素钠的速率较快,12 h时降解率可达41%,24 h降解率可达83%,而在24 h后青霉素钠降解率虽然仍在增加,但降解速率显著下降,见图7,这可能与培养基中营养物质的消耗、代谢产物的的积累有关[15-16]。
2.6 菌株Anti-Pen20降解青霉素钠的产物分析
将菌株Anti-Pen20在降解培养基中培养24 h后的发酵液处理后进行液质联用分析,得到的质谱图见图8。由物质的质荷比联系物质的分子结构分析可知,产物中存在着青霉素的几种标志性降解产物,主要有青霉素噻唑酸及去羧青霉素噻唑酸,符合β-内酰胺酶作用的降解产物,见表1[17]。
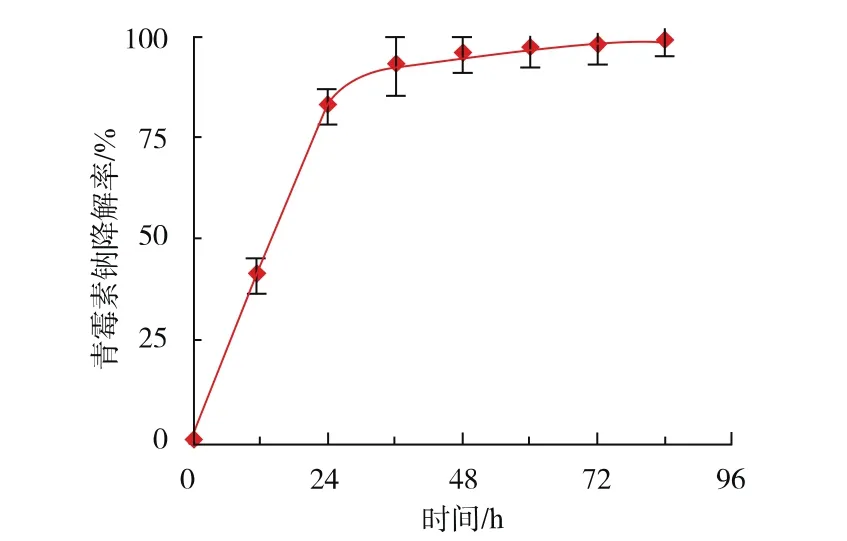
图7 培养时间对青霉素钠降解率的影响Fig.7 Effectofculture time on penicillin sodium degradation rate
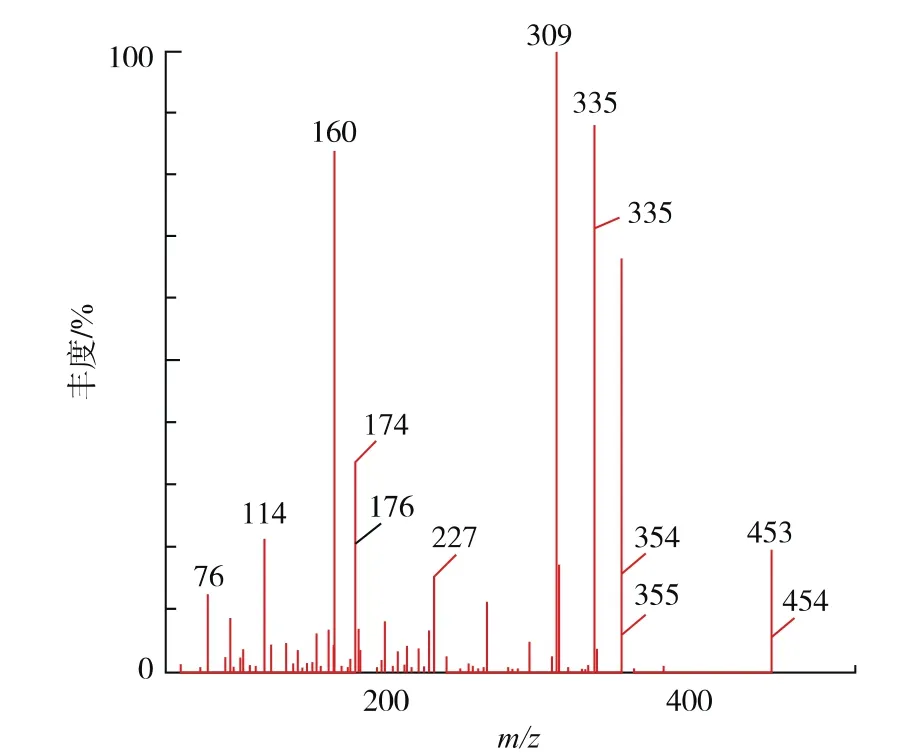
图8 降解产物二级质谱图Fig.8 Secondary spectra of degradation products
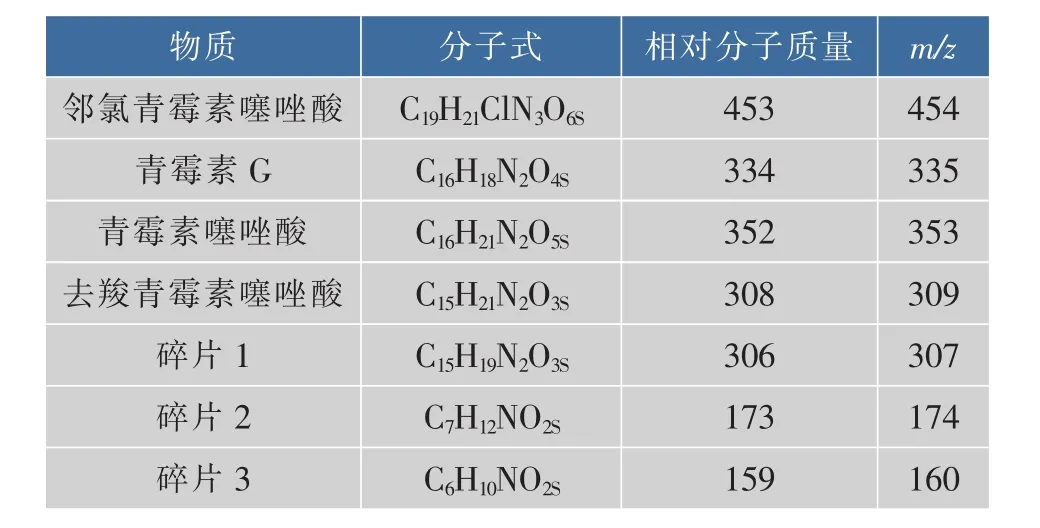
表1 Anti-Pen20降解青霉素钠的主要产物Table 1 Main degradation products of penicillin sodium
3 结 语
从青霉素钠生产企业附近的土壤中筛选出一株具有青霉素钠抗性的菌株Anti-Pen20,通过生理生化以及分子水平鉴定,发现该菌与粘质红酵母(Rhodotorula mucilaginosa)的序列同源性超过99%。通过高效液相色谱分析作图,发现青霉素钠在10 g/L范围内响应峰的峰面积与青霉素钠质量浓度高度契合一级反应动力学方程式y=244.21x+1.608 7,其中y表示液相色谱响应峰面积,x表示青霉素钠质量浓度,R2=0.999 9。优化降解条件后发现,Anti-Pen20降解青霉素钠的最佳接种体积分数为15%,青霉素钠的最佳质量浓度为20 g/L,随着培养时间的增加,菌株对青霉素钠降解效率逐渐降低。通过对Anti-Pen20降解青霉素钠的产物进行质谱分析,发现产物中主要有青霉素噻唑酸及去羧青霉素噻唑等。
Anti-Pen20所具有的高效降解青霉素钠的能力以及粘质红酵母本身的特性,有望应用于具有高质量浓度青霉素钠菌渣的处理回收,也可以为Anti-Pen20在动物饲料添加剂以及果业中作为防病变添加剂的应用提供研究依据。
