非致残性缺血性脑血管事件患者早期进展的危险因素
2020-06-19万慧娟蒋伟超庄雄杰
万慧娟,蒋伟超,庄雄杰
非致残性缺血性脑血管事件(Non-Disabling Ischemic Cerebrovascular Events,NICE)定义为发病后未遗留显著残疾的缺血性脑血管事件,包括:短暂性脑缺血发作(transient ischemic attack,TIA)、轻型缺血性卒中(minor ischemic stroke)、症状迅速缓解但未遗留残疾的缺血性脑血管事件[1]。NICE具有较为庞大的人群基础,基于中国人群的TIA流行病学调查中显示,TIA的患病率为2.27%[2]。而基于中国国家卒中登记研究(China National Stroke Registry-Ⅱ,CNSR-Ⅱ)的数据显示,NICE占全部缺血性脑血管病事件的51.2%[3]。
早期TIA和轻型缺血性卒中症状轻微而易被忽视,但患者脑组织处于早期不稳定的状态,急性期容易出现病情恶化,从而导致不良的远期预后[4]。因此,早期TIA和轻型缺血性卒中被认为是中国脑血管病的最佳防控窗口,尽早的发现和实施有效的干预措施,能够有效预防不良结局的发生。对NICE患者进行综合评估,早期识别引起患者病情进展的危险因素、对易感人群进行危险分层,并积极治疗,对于最大程度的降低NICE早期进展、改善患者生活质量、减轻家庭及社会负担有着重要的意义。本研究回顾性收集NICE患者的基线资料、临床及影像学特征并进行分析,寻找影响NICE患者早期进展的因素。
1.1对象与方法
1.1 研究对象 回顾性连续纳入2016年1至2019年12月期间,在厦门大学附属第一医院神经内科住院的非致残性缺血性脑血管事件的患者。入选标准:(1)年龄≥60岁,性别不限;(2)所纳入的患者均符合《高危非致残性缺血性脑血管事件诊疗指南》中非致残性缺血性脑血管事件的诊断标准[1];其中,TIA定义为:脑或视网膜局灶性缺血所致的、未伴急性梗死的短暂性神经功能障碍[5]。轻型卒中的诊断定义为美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分≤3分[6]。症状迅速缓解,未遗留残疾的缺血性脑血管事件定义为:发病时临床症状重,但就诊时症状已缓解为TIA或轻型缺血性卒中。排除标准:(1)合并严重基础疾病,如心、肾、肝功能衰竭,恶性肿瘤,或自身免疫系统疾病者;(2)心源性脑栓塞;(3)NIHSS评分>3分的缺血性脑卒中;(4)既往有脑外伤或脑血管畸形病史;(5)伴有精神类疾病。
1.2 数据收集
1.2.1 患者的临床资料 包括年龄、性别;既往病史如高血压、高脂血症、糖尿病、缺血性卒中或TIA病史、缺血性心脏病病史;危险因素如吸烟史、饮酒史;本次发病后的超声及影像学检查结果;入院时NIHSS评分;住院期间并发症如急性感染和新发缺血性卒中;住院期间主要用药情况等。
1.2.2 相关指标评价标准或定义 (1)吸烟:距发病6 m内,平均每天吸烟至少1支;(2)饮酒:大量饮酒超过1 y,平均每天至少50g白酒或1瓶啤酒;(3)既往缺血性心脏病史:发病前已行冠状动脉造影或CT血管造影证实,或经心电图、心脏彩超明确诊断;(4)既往缺血性卒中或TIA病史:既往经神经内科明确诊断,并距本次入院时间≥6 m;(5)症状性颅内外责任动脉狭窄或闭塞(以下简称责任动脉狭窄或闭塞):所有患者均行颈部血管超声或 MRA评估颈内动脉及椎动脉颅外段,根据 NASCET研究诊断标准[7],颅外动脉狭窄率≥50%定义为狭窄。发病后行经颅多普勒或MRA评估颈内动脉和椎动脉颅内段,大脑中动脉M1段和大脑前动脉A1段,大脑后动脉P1段和基底动脉,根据WASID研究的诊断标准[8]。责任动脉是指此次TIA症状或缺血性脑梗死的责任病灶在病变血管供血区内。(6)急性感染包括住院期间新发生的经尿常规、尿培养明确诊断的泌尿系感染和(或)肺部感染。肺部感染参考《卒中相关性肺炎诊治中国专家共识》中的诊断标准[9],即NICE发生后胸部CT新出现或进展性肺部浸润性病变,同时合并≥2项以下临床症状:①发热(体温≥38 ℃);②新出现咳嗽、咳痰或者原有呼吸道症状加重;③肺实变体征,和(或)湿啰音;④外周血白细胞计数≥10×109/L或≤4×109/L。(7)早期进展定义为患者发病7 d内神经功能缺损症状加重,即NIHSS评分较发病时基线水平增加≥2分[10,11]。(8)影像学检查:所有图像均经高年资影像科医生及神经内科医生以盲法进行判读。
1.2.3 脑白质高信号的评估及评分标准 脑白质高信号(white matter hyperintensity,WMH)的影像学表现为颅脑MRI T2序列及FLAIR 序列上呈斑点或斑片状高信号,T1序列呈等信号或稍低信号,并经DWI排除了急性脑梗死。使用Fazekas评分[12]对WMH进行视觉评分(0~3分),首先,根据病灶位置[12,13]分为:脑室旁白质高信号(periventricular white matter hyperintensity,PWMH)及深部脑白质高信号(deep white matter hyperintensities,DWMH)。其次,根据WMH严重程度分别进行评分:(1)PWMH:0分,无异常高信号;1分,帽状或细铅笔状高信号;2分,光滑“晕状”高信号;3分,高信号病灶不规则向深部白质延伸;(2)DWMH:0分,无异常信号;1分,点状高信号病灶;2分,高信号病灶有融合趋势;3分,高信号病灶大片状融合。并将PWMH与DWMH得分相加计算WMH的总负荷(总分0~6分)。最后,根据既往文献[14]将WMH由严重程度进行分组研究,PWMH与DWMH分别分为0~1分组,2~3分组;PWMH+DWMH总负荷分为0~2分组和3~6分组。

2 结 果
2.1 进展组与非进展组基线人口学特征、临床特点、影像学特点比较 共纳入NICE患者324例,其中进展组70例,非进展组254例,2组间性别、年龄差异无统计学意义,组间均衡可比。进展组糖尿病、责任动脉狭窄或闭塞、急性感染、新发缺血性卒中比例较非进展组高,差异有统计学意义(P<0.05),两组间PWMH、PWMH+DWNH评分,进展组得较高分数(PWMH 2~3分、PWMH+DWNH 3~6分者)比例较非进展组高,差异有统计学意义(P<0.05)。两组间吸烟史、饮酒史、高脂血症、高血压、缺血性卒中/TIA病史、缺血性心脏病、抗血小板及降脂治疗的比例,差异无统计学意义(P>0.05)(见表1)。
2.2 影响NICE早期进展的多因素Logistic回归分析 糖尿病、新发缺血性卒中、急性感染、责任动脉狭窄或闭塞、较高的Fazekas评分(PWMH+DWMH 3~6分、PWMH 2~3分)是影响NICE早期进展的危险因素(见表2)。
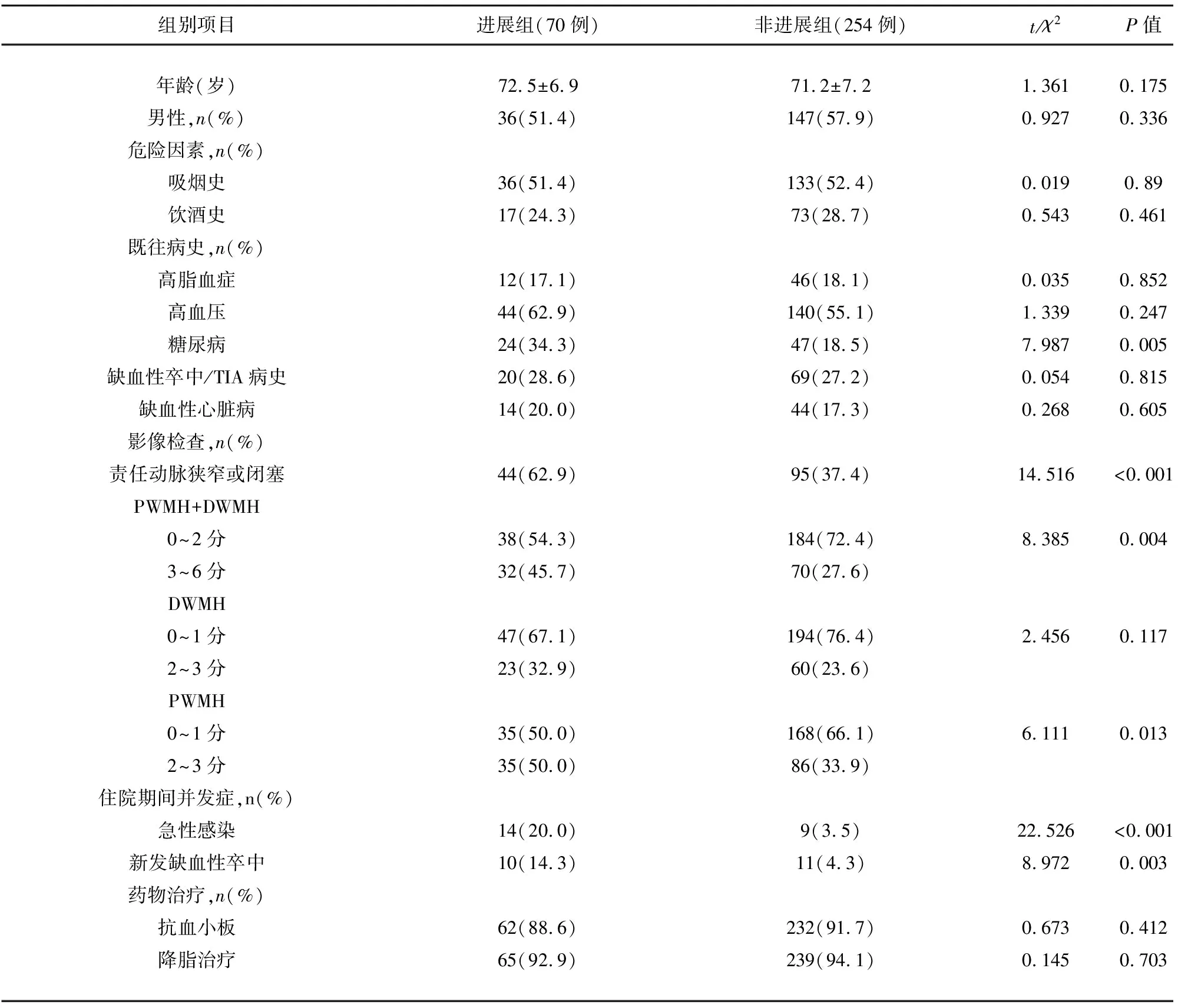
表1 研究对象的人口统计学、临床特征和影像学特点比较

表2 影响NICE进展的多因素Logistic回归分析
3 讨 论
本研究探讨了NICE患者早期进展的相关预测因素。根据本研究结果显示,早期进展者比例为21.6%。一项加拿大学者的研究中TIA和轻型卒中早期进展的比例为4.1%[15],但该研究中入组的是年龄≥18岁的患者。本研究与既往类似研究的早期进展比例不完全一致,考虑与各研究入组标准及对于早期进展的定义不一致相关。本研究选取的年龄范围为≥60岁的老年患者,常合并动脉粥样硬化或糖尿病等基础疾病,因此早期进展比例较高。
根据多因素Logistic回归分析,糖尿病为NICE患者早期进展的独立预测因素,这与既往研究中的结论一致[16]。在多项急性缺血性脑卒中的临床研究均发现,发生卒中后血糖持续增高可预示梗死灶的扩大及神经功能预后不良,并增加远期的致残率[17,18]。血糖增高患者易发生早期进展的原因如下述:(1)高血糖对神经的直接毒性作用,可加重脑水肿,并促进金属基质蛋白酶-9(MMP-9)的生成[19],MMP-9是降解细胞外基质以及内皮细胞之间紧密连接的蛋白酶,可降解毛细血管周围基底层的分子,并促进血管生成和神经发生,从而促进细胞死亡[20],加重脑损伤及神经功能缺损。(2)血糖增高可导致脑内乳酸水平增高,加重酸中毒,继而加重早期的神经功能缺损。因此,积极控制血糖水平是预防卒中后功能残疾的重要因素。
根据我国的CICAS研究显示,颅内动脉粥样硬化性狭窄占所有缺血性脑血管病因的46.6%,病情预后较差[21]。虽然上述结论不能完全代表NICE人群,但在本研究中也发现,责任动脉的狭窄和闭塞可预测NICE患者早期进展。Maas等[22]的研究显示,NIHSS评分对急性缺血性卒中患者近端动脉(基底动脉、颈内动脉、大脑中动脉M1和(或)M2段、大脑前动脉A1和(或)A2段、大脑后动脉、椎动脉)闭塞的预测能力很差。Asdaghi等[23]的一项前瞻性基于多模态核磁共振的队列研究表明,TIA和轻型卒中患者虽然急性期梗死灶较小,临床症状轻微,但通常伴有显著的缺血半暗带,基线组织低灌注患者7 d时DWI病灶复发率明显高于基线无灌注异常患者,所有在7 d时的新病变都发生在最初的低灌注组织区域内,因此,Asdaghi等认为这些病例中的早期缺血的“复发”代表了缺血过程的自然演变和半暗带缺损区内梗死的“完全化”,而并非新发的缺血性梗死灶。基于上述原因,对于伴有责任动脉狭窄或闭塞,但NIHSS评分低的NICE患者虽然诊断为轻度卒中,应特别警惕低灌注导致的梗死灶扩大,在治疗上需更加积极。
在本研究中早期进展组有14.3%的患者出现新发缺血性卒中,一项来源于21个国家的登记结果研究,TIA和轻型卒中发生后的2 d及7 d再发生卒中的风险分别为1.5%、2.1%[24]。中国国家卒中登记研究(CNSR)的数据显示,对于轻型卒中患者,在急性期尽管给予了规范的卒中治疗,在发病7 d内仍有11.5%的复发率[3]。以上数据均显示,NICE患者急性期卒中复发也是导致早期进展的原因之一。对于卒中复发患者,早期识别并给与个体化的干预措施是尤为重要的。
缺血性卒中患者常合并肺部感染等急性感染。针对全部缺血性卒中人群的数据显示,约5.6%的缺血性卒中患者合并肺部感染,15%~25%死于肺部感染[25]。毫无疑问,住院期间的急性感染加重卒中患者的病情,延长卧床时间,增加发生肺栓塞、下肢静脉血栓等并发症的可能,继而导致反复感染及不良预后。Wartenberg等[26]发现,急性感染是卒中后不良功能结局的独立预测因素。本研究也发现,在NICE人群中,急性感染(包括泌尿系感染和肺部感染)增加卒中早期进展的风险。
随着颅脑MRI的普及,WMH的检出率逐渐增高,我国一项基于社区的前瞻性队列的数据显示,35岁以上的人群中,PWMH的患病率为72.1%,DWMH的患病率为65.4%。WMH在缺血性中风患者中比普通人群更为常见[27]。近年来许多研究均发现,WMH与脑小血管病、阿尔茨海默病等神经系统疾病有良好的相关性[28,29]。WMH不仅与普通人群的缺血性卒中风险增高相关,WMH负荷增加在非房颤缺血性卒中患者队列中与复发缺血性卒中发生风险独立相关[30]。越来越多的研究均提示缺血性卒中患者的WMH与不良预后独立相关,包括痴呆[31]、功能性残疾[32]和死亡[33]。WMH的严重程度与缺血性卒中患者的梗死扩大和更大的梗死体积有关[34,35],但大部分研究是基于整个缺血性卒中人群或研究其长期预后。我们的回顾性队列着重揭示了较高的Fazekas评分(PWMH+DWMH 3~6分、PWMH 2~3分)和NICE患者早期进展之间的相关性。目前,WMH的发病机制尚不明确,可能是由多种复杂因素相互作用的结果。Panton等[36]认为各种危险因素所致的管腔狭窄、管壁增厚、平滑肌细胞丢失等可引起慢性脑低灌注,血管自我调节功能障碍,继而引起慢性、弥漫性脑缺血,从而导致脱髓鞘、少突胶质细胞的丢失及轴索损伤,最终引起MRI上可见的WMH。而血管的结构性病变(管腔狭窄、管壁增高、平滑肌细胞丢失)或高血压等危险因素导致的内皮损伤,破坏血脑屏障,从而引起脑缺血及WMH[37]。因此,我们推测,WMH存在较高的Fazekas评分的患者所代表的慢性低灌注、血脑屏障破坏、血管调节功能差等病理变化增加了脑组织对急性缺血的易感性,引起NICE患者的早期进展。但我们并未发现DWMH 2~3分与早期进展的相关性,推测其可能的原因在于PWMH与DWMH发病机制的异质性。Kim等[13]认为光滑的PWMH可能与间质液体的增加有关,不规则的PWMH更有可能是由慢性血流动力学不足(低灌注)决定的,而DWMH可能更多地归因于小血管疾病。综上所述,重度WMH负荷增加NICE进展的风险,而影像学检查有助于WMH的早期发现。本研究采用的是对于临床中更为便捷的Fazekas视觉评分法评估WMH,Zerna等[38]认为,对于TIA及轻型卒中患者,基于Flair序列对WMH进行定量测量与Fazekas视觉评分高度相关。而在实际临床工作中,Fazekas视觉评分具有更强的可操作性。WMH的评估可能有助于临床预测,也可能影响治疗决策,但这需要在严格设计的随机对照试验中进行验证。但目前为止,还没有被证实有效的治疗方案来减缓或阻止WMH病变的进展。
综上所述,NICE患者早期进展与多种因素相关,如存在糖尿病及发病时血糖高的患者;影像上可见责任动脉狭窄或闭塞、较高的Fazekas评分(PWMH+DWMH 3~6分、PWMH 2~3分);住院期间的并发症如急性感染、新发缺血性卒中,对于这部分易感人群,应积极进行早期干预,预防疾病进展。但本研究仍存在一定的局限性。首先,本研究为单中心的回顾性研究,对于入组病例的选择可能存在偏移。其次,对于早期进展的判断标准、发生时间等,国内外研究仍未达到统一。最后,研究样本量较小,仍需多中心大样本的前瞻性研究来进一步探索NICE患者早期进展的指标及其中的病理生理学机制。
