基于网络药理学探讨黄芪治疗骨质疏松有效成分及作用机制
2020-06-18吴雍真陈云志杜海洋柴艺汇
吴雍真,陈云志,朱 星,杜海洋,李 倩,柴艺汇
贵州中医药大学(贵州 贵阳 550025)
骨质疏松(Osteoporosis,OP)是以单位体积内骨基质含量减少、骨密度降低、骨组织微细结构退化为特征的代谢性骨病。随着人口老龄化加速,OP的发病率不断攀升,并被世界卫生组织认为是除冠心病外的主要健康问题[1]。OP易导致患者出现腰背全身疼痛、呼吸功能下降、身长缩短、驼背,严重者还可出现骨折、脊柱变形等症状,影响患者生活质量[2]。近年来,通过中医药治疗OP的研究发现[3-4],中医学重视辨证论治、内外并重,不仅疗效良好、副作用低,还可减轻患者痛苦、提高生活质量。中医虽无明确记载,但根据OP的临床表现可将其归属“骨痹”、“骨痿”等范畴,“肾藏精,主骨,为先天之本”,骨藏髓,髓充骨,精血可生养骨髓,精、血均由肾精所化,故认为肾精亏虚是引起OP的重要因素。
黄芪(Astragalusmembranaceus)为豆科植物蒙古黄芪或膜荚黄芪的干燥根,具有补气升阳,敛疮生肌,利尿消肿,固表止汗,补益肾气等功效[5-6]。黄芪药理作用广泛,除具有抗感染、免疫调节、保护肝肾等脏器和调节血压外,还具有抗骨质疏松生物活性[7]。相关研究表明[8]黄芪总黄酮提取物可有效改善维甲酸致OP大鼠模型的骨密度[8];同时,黄芪多糖可通过促进成骨细胞增殖,达到防治OP的作用[9]。因此,黄芪具有一定防治OP的药理基础。
网络药理学涉及多个学科的技术与知识,可多方位揭示药物治疗疾病的潜在作用机制,为研究中药或复方有效活性成分、作用靶点、潜在机制等提供有效研究策略。前期通过中医理论依据、基础实验研究发现黄芪具有防治OP的作用,但对黄芪的药效作用物质基础与机制阐释尚不明确。鉴于此,本研究利用网络药理学,筛选药物的活性成分及黄芪防治OP的潜在靶点,构建“药物-活性成分-靶蛋白-疾病”网络,对靶点进行富集分析,探讨其潜在作用机制,为后续实验提供科学依据。
1 方法
1.1筛选黄芪有效活性成分与OP靶蛋白通过TCMSP(http://tcmspw.com/tcmsp.php)数据库搜集黄芪的化学成分;以口服生物利用度(OB)≥30%,药物相似度(DL)≥0.18为标准,筛选黄芪有效活性成分,并查询有效活性成分相对应的靶点。在GeneCards数据库(https://www.genecards.org/)、CTD数据库(http://ctdbase.org/)获得OP相关靶点。所得化合物的靶点与OP靶点取交集,使用Cytoscape v 3.7.2软件构建药物-活性成分-靶蛋白-疾病可视化联系。
1.2构建蛋白-蛋白互作网络将交集得到靶点导入String数据库(https://string-db.org/),构建蛋白质-蛋白质(PPI)互作网络。将Degree从大到小排序,以前30为标准筛选核心靶点。
1.3GO功能富集分析和KEGG富集分析将1.2筛选出的核心靶点导入DAVID数据库(https://david.ncifcrf.gov),以人类为研究对象进行GO(gene ontology)注释和KEGG(Kyoto encyclopedia of genes and genomes)通路富集分析,将P值设为小于0.01。其中GO分析包括生物过程(BP)、细胞成分(CC)和分子功能(MF)。
2 结果
2.1黄芪有效成分及靶蛋白分析通过TCMSP数据库检索关键词“黄芪”获得成分87个,通过相关条件筛选得到黄芪有效成分20个,见表 1,并查询获得有效活性成分相对应的靶点,剔除4个未查询到靶点的活性成分,结果显示16个活性成分共对应210个靶点。在GeneCards、CTD数据库检索关键词“Osteoporosis”,筛选得到相应靶点后取并集,删除重复项后获得OP相关靶点。将筛选获得的有效活性成分对应的靶点与OP相关靶点取交集,获得64个靶点分别对应15个活性成分。利用Cytoscape软件建立“药物-活性成分-靶蛋白-疾病”网络(见图 1)。Degree排前5的有效活性成分为槲皮素(quercetin)、山萘酚(kaempferol)、异鼠李素(isorhamnetin)、刺芒柄花素(formononetin)、毛蕊异黄酮(Calycosin),这些可能为黄芪治疗OP的关键有效成分,见表2。

图1 黄芪治疗OP的“药物-成分-靶点-疾病”网络

表1 TCMSP数据库筛选出黄芪有效成分

表2 关键有效成分
2.2构建蛋白-蛋白互作网络将重合的64个靶点导入String作PPI网络,网络共有64个节点,603条边,见图2,根据Degree大小排列,取前30筛选为核心靶点,见图3。将核心靶点对应的有效成分与2.1所得的5个可能为黄芪治疗OP的有效成分取交集,结果显示交集与之前5个有效成分相同,故推测,槲皮素、山萘酚、异鼠李素、芒柄花黄素、毛蕊异黄酮可能是黄芪治疗OP的关键有效成分。

图2 黄芪治疗OP靶点PPI网络
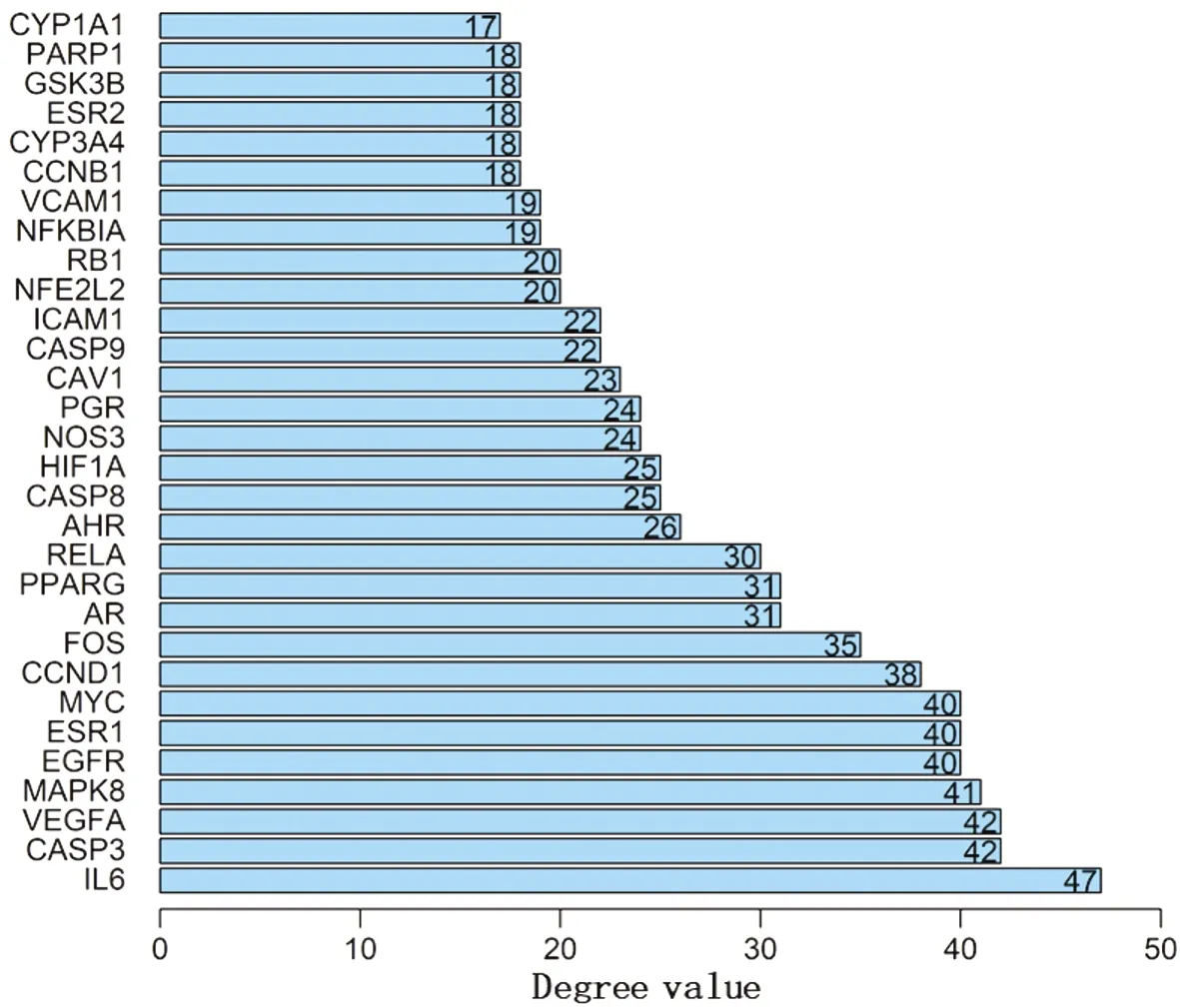
图3 Degree前30个靶蛋白
2.3基因功能与通路富集分析通过DAVID数据库对黄芪治疗OP的30个潜在作用的核心靶点进行分析,根据P<0.01,共得到120个GO注释,52条KEGG通路。按P值大小,筛选出前20个GO注释,见表3,表中GO注释9个与BP有关,9个与MF有关,2个与CC有关,GO注释大多与BP和MF相关,如酶结合、RNA聚合酶Ⅱ对转录的正调控作用、转录因子结合、对药物的反应等。
KEGG结果显示,30个核心靶点共富集在52条通路上,主要集中在癌症信号通路、乙型肝炎、肿瘤坏死因子(TNF-α)信号通路、催乳素信号通路、人嗜T淋巴细胞病毒I型感染、军团菌病、病毒性心肌炎、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)信号通路、低氧诱导因子(HIF-1)信号通路、Toll样受体信号通路、胰岛素抵抗等。按P值大小,排列前20条通路,见图4。

表3 黄芪治疗OP核心靶点GO注释

图4 黄芪治疗OP核心靶点KEGG富集通路分析
3 讨论
骨形成、骨重塑主要与成骨细胞和破骨细胞密切相关,机体维持正常骨稳态有赖于二者的协同作用,而当骨形成与骨吸收失衡,则会导致骨量、骨质产生变化,进而造成OP[10]。OP的发病与性别、年龄关系密切,流行病学研究显示[11]我国50岁以上OP患病率女性为20.7%,男性为14.4%,且随年龄增长而呈上升趋势。目前治疗OP的药物主要分为骨形成促进剂、骨吸收抑制剂两大类,但长期使用此类药物可出现众多不良反应[12],故研发更安全高效的药物成为亟待解决的问题。近年来,众多实验及临床观察均证实黄芪对OP具有良好的疗效,但对其有效成分与机制尚不明确。本研究在TCMSP数据库共筛选出20个黄芪有效活性成分。对“药物-活性成分-靶蛋白-疾病”网络分析,根据Degree值排序前5种有效成分为槲皮素、山萘酚、异鼠李素、刺芒柄花素、毛蕊异黄酮,故推测这些可能为黄芪治疗OP的关键有效成分。槲皮素为多羟基黄酮类化合物,具有抗病毒、抗肿瘤、保护肝脏等生物学活性。相关研究发现[13],槲皮素可调节骨代谢,抑制破骨细胞介导的骨吸收、诱导破骨细胞凋亡及增强成骨细胞活性,也可促进OP模型大鼠成骨细胞分化,调节骨代谢改善OP。山奈酚为黄酮醇类化合物,不仅有免疫调节、抗氧化、抗肿瘤等生物学活性,还具有提高成骨细胞内碱性磷酸酶活性,促进成骨细胞增殖分化,增加骨形成的作用。同时实验也证实[14],山奈酚可增加骨小梁数目、增高去势大鼠骨密度,有效改善OP。异鼠李素为槲皮素在体内的代谢形式,与槲皮素是共生黄酮。相关研究显示[15],异鼠李素可改善去势大鼠的骨微结构破坏,具有防治OP的作用。此外,对刺芒柄花素、毛蕊异黄酮药理学研究发现二者均具有抗OP作用[16-17]。上述研究与本研究结果呈现一致性,提示槲皮素、山萘酚、异鼠李素、刺芒柄花素、毛蕊异黄酮5个活性成分可能在黄芪治疗OP中发挥关键作用。
根据Degree分析PPI网络,结果显示白介素-6(IL-6)、半胱氨酸天冬氨酸蛋白酶(CASP)3、血管内皮生长因子A(VEGFA)等30个靶点可能在黄芪治疗OP过程中起关键作用。IL-6生物学功能复杂,不仅是炎症免疫反应的调节因子,也在骨代谢过程中发挥重要作用,其可干扰碱性磷酸酶的活性,并且IL-6过表达与包括OP在内的多种疾病的病理过程有关,例如IL-6和其受体的过表达对成骨细胞分化具有拮抗作用[18]。IL-6还被认为是经典的骨吸收促炎细胞因子,不仅可通过接触破骨细胞前体刺激破骨细胞的形成,还可通过刺激成骨细胞表达核因子-κB受体活化因子配体(RANKL)来促进破骨细胞生成,破坏骨代谢平衡[19]。半胱氨酸天冬氨酸蛋白酶(Caspase)家族在细胞凋亡过程中起重要作用,Caspase-3为凋亡效应子,位于Caspase家族介导的蛋白酶级联反应的下游;Caspase-8是死亡受体途径的关键因子,与凋亡启动子Caspase-9同为启动型蛋白酶,位于级联反应的上游。相关实验发现,骨质疏松患者成骨细胞的Caspase-3、Caspase-9的表达水平高于正常组,并且动物实验结果也显示与对照组比较Caspase-3、Caspase-8在OP模型大鼠中的表达水平显著上调,而给予OP模型大鼠黄芪等中药组成的复方治疗可有效改善OP并下调Caspase-3、Caspase-8表达水平[20-21],提示黄芪治疗OP的机制可能与下调Caspase-3、Caspase-8有关。VEGF为促有丝分裂因子,分为VEGFA、VEGFB、VEGFC、VEGFD和VEGFE,其中VEGFA被认为是传统意义上的VEGF。研究显示[22],VEGF除是血管生长因子外,还是在骨代谢过程中发挥重要作用的骨生长因子。通过检测体内VEGF的表达发现,在绝经后骨质疏松患者体内的VEGF水平远低于正常人。动物实验也证实[23],利用表达VEGF的腺病毒载体注入新西兰兔股骨远端可显著增加骨量及成骨细胞的数量。此外,其余靶点与OP也存在密切关系,如雌激素受体1(ESR1)、ESR2参与骨细胞的代谢,丝裂原活化蛋白激酶(MAPK)、核转录因子kappaB(NF-κB)可通过调控细胞增殖和分化、炎症相关信号通路,直接或间接影响OP。
GO功能富集分析结果提示黄芪治疗OP可能是通过调控酶结合、RNA聚合酶Ⅱ对转录的正调控作用、转录因子结合、对药物的反应等基因功能有关。KEGG通路富集分析,发现靶点主要富集在癌症信号通路、乙型肝炎信号通路、TNF信号通路、催乳素信号通路、人嗜T淋巴细胞病毒I型感染、军团菌病、病毒性心肌炎、PI3K/Akt信号通路、HIF-1信号通路、Toll样受体信号通路、胰岛素抵抗等通路上。其中显著性最高的癌症信号通路较为复杂,具有多个下游通路,如Wnt信号通路、过氧化物酶体增殖物激活受体(PPAR)信号通路、MAPK信号通路、VGEF信号通路等[24]。Wnt蛋白为分泌型糖蛋白,在成骨细胞分化中起关键作用,也是调节成骨细胞活性的关键因子[25]。实验发现[26],黄芪甲苷可通过调节去势大鼠骨组织Wnt2蛋白表达水平达到改善OP的作用。PPAR-γ与骨代谢关系密切,若PPAR-γ处于长期激活的状态下则会导致骨髓间充质干细胞向脂肪细胞分化,使成骨细胞减少影响骨形成[27]。c-Jun氨基末端激酶(JNK)、p38MAPK为MAPK信号通路的重要成员,研究发现[28]JNK通路可影响成骨细胞的分化,在骨形成中具有重要作用;p38通路可促进成骨细胞生成并对破骨细胞的分化具有抑制作用。PI3K/Akt信号通路广泛存在于多种组织中,具有调节细胞增殖、分化、凋亡等生物学作用,并且PI3K/Akt信号通路及其下游靶蛋白在骨重建、骨形成过程中起重要作用[29]。其它显著性高的通路如TNF信号通路、HIF-1信号通路、Toll样受体信号通路、胰岛素抵抗通路等均可通过直接或间接影响机体骨代谢[30]。
综上所述,本研究初步验证和预测黄芪治疗OP的分子机制,发现黄芪治疗OP有效成分及作用机制呈现多成分、多靶点、多通路的特性,为后续深入研究其具体机制提供了思路和基础。
