游泳运动诱导的自噬激活对动脉粥样硬化形成的影响
2020-06-17李洋孙大康郑园园程艳丽
李洋 孙大康 郑园园 程艳丽
滨州医学院附属医院心血管内科(山东滨州256603)
动脉粥样硬化(atherosclerosis,AS)导致的心血管疾病是世界范围内第一大致死因素。脂质沉积和动脉壁炎症失衡是AS主要特征[1]。氧化脂质的内膜下沉积启动免疫反应,进一步介导可溶性细胞间黏附分子(soluble intercellular adhesion molecule-1,sICAM-1)、白细胞介素6(interleukin-6,IL-6)、E-选择素和肿瘤坏死因子-α(tumor necrosis factor ɑ,TNF-ɑ)等炎性因子的释放[2,3],加重炎性损伤。此外,巨噬细胞迁移至内皮下,吞噬大量氧化低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)而转化为泡沫细胞[4],泡沫细胞过度分泌基质金属蛋白酶9(matrix metalloprotein,MMP-9)会损害斑块周围的纤维帽强度[5],加剧斑块的不稳定性。随着疾病的发展,在慢性炎症、细胞迁移和增殖、纤维化和钙化等诸多因素作用下,脆弱的斑块破裂和随后的血栓形成最终导致急性心血管疾病的发生[6]。考虑到AS 是一种长期的慢性疾病,因此加强AS 的早期预防显得尤为重要。
研究表明,早期体育锻炼能显著降低动脉粥样硬化性心血管疾病的发病率和死亡率[7],可能与运动改善高脂血症、2 型糖尿病和高血压等AS 相关危险因素有关[8]。前期研究发现,长期游泳运动能够上调小鼠主动脉血管壁的自噬水平[9]。由于自噬与AS 的发生、发展密切相关,有研究显示银杏叶提取物可通过上调自噬活性、减轻内质网应激来抑制链脲佐菌素诱导的糖尿病ApoE-/-小鼠的动脉粥样硬化[10]。我们推测长期游泳运动可能以一种“自然”的方式激活自噬系统,并在机体对抗AS 发生、发展中发挥保护作用,故本研究采用ApoE-/-小鼠建立动脉粥样硬化模型,在此过程中通过长期游泳运动进行干预,探讨游泳运动对动脉粥样硬化形成的影响及其作用机制,为AS的防治提供新的分子机制和理论基础。
1 材料与方法
1.1 实验动物
8 周龄SPF 级C57BL 小鼠、ApoE-/-小鼠,购买于北京维通利华动物实验中心,许可证号:SCXK(京)2016-0006。动物饲养符合滨州医学院附属医院动物伦理委员会的伦理学标准,所有小鼠饲养于滨州医学院附属医院实验动物中心,环境温度为21℃。12小时循环光/暗周期。
1.2 实验方法
选用8 周龄SPF 级雄性C57BL 小鼠20 只、ApoE-/-小鼠40 只。在适应性喂养1 周后将其随机分为3 组,定期(2周)测量体重。对照组为C57BL小鼠(n=20),给予正常普通饮食、饮水,不干涉其活动。模型组为AopE-/-小鼠(n=20),给予富含脂质的西方饮食,加速自发性动脉粥样硬化斑块的形成。自由饮水,不干涉其活动。实验组为AopE-/-小鼠(n=20),给予富含脂质的西方饮食,自由饮水。参考Szostak等人的运动方案[11],实验组小鼠在31℃~33℃的水中进行为期12周的游泳训练(5天/周),训练时间逐步增加,从第1周的30分钟开始,逐渐过渡到第3 周的50 分钟。从第4 周至实验结束,小鼠每次连续游泳60分钟。采用团体游泳训练刺激运动,两个水槽各放置10 只小鼠,同时进行游泳锻炼,每次训练结束后,用毛巾将小鼠擦干。
1.3 取材
1.3.1 血液标本留取
于末次运动并禁食12 小时后,使用4%水合氯醛0.1 ml/10 g 腹腔注射麻醉小鼠,通过摘眼球收集血液标本,离心后取其上清(3000 rpm,15 min)置于-80℃冰箱保存,用于检测总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、sICAM-1、MMP-9、IL-6 水平。
1.3.2 主动脉标本的留取
小鼠麻醉后充分暴露手术视野,用输液器针头从心尖部插入左心室,用PBS匀速灌流,同时剖开右心房排液,待肝脏变为灰白色后,游离主动脉弓至腹主动脉整段血管。每组5只小鼠取主动脉血管组织用4%的福尔马林固定,用于后续HE染色及IHC;每组5只小鼠取主动脉血管组织制备冰冻切片用于后续油红O 染色;每组10 只小鼠取血管组织保存在-80℃冰箱中,用于后续Western-Blot及Real-Time PCR分析。
1.4 酶联免疫吸附实验(ELISA法)
小鼠血清中TC、TG、sICAM-1、MMP-9、IL-6 水平的测定,均按照ELISA试剂盒说明书操作。
1.5 HE染色
血管组织常规脱水、透明、透蜡、包埋,每隔4 μm连续制备石蜡切片30 张,每隔10 张取一张行HE 染色。依次将切片放入二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、75%酒精5 min,自来水洗。切片入苏木素染液染3 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗。切片依次入85%、95%的梯度酒精脱水各5 min,入伊红染液中染色5 min。切片依次放入无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、无水乙醇Ⅲ5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ5 min 透明,中性树胶封片。显微镜镜检及图像采集分析。用Image-ProPlus6.0 软件对每张切片的AS斑块面积比进行分析。
1.6 油红O染色
血管组织每隔10 μm连续制备冰冻切片30张,每隔10 张取一张行油红O 染色。将冰冻切片复温干燥,固定液中固定15 min,自来水洗,晾干。切片入油红染液浸染8~10 min(加盖避光),蒸馏水洗;75%酒精稍分化,蒸馏水洗。切片入苏木素染液染3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗。甘油明胶封片剂封片。显微镜镜检,图像采集分析。
1.7 免疫组化
取材及石蜡切片制备同1.5 所述。将切片放置在60℃烘箱内烘烤45 min,常规脱蜡、脱水、水化,3%过氧化氢去离子水封闭,室温下孵育20 min,以去除内源性过氧化物酶活性,柠檬酸盐缓冲液高压热修复,山羊血清封闭,37℃下育孵30 min,一抗(LC3 1︰200、Beclin-1 1∶200)4℃冰箱孵育过夜,二抗37℃下孵育30 min后冲洗,DAB显色,阳性细胞胞质呈棕黄色;苏木素复染;酒精脱水;二甲苯透明;中性树胶封片。图像采集后用Image-ProPlus6.0软件进行平均光密度分析。
1.8 Westen-Blot检测
将小鼠主动脉剪成小碎块,加入200 μl RIPA 裂解液并用玻璃匀浆器匀浆,充分裂解后离心提取上清,BCA蛋白定量法测定蛋白浓度,按照4︰1加入5×蛋白上样缓冲液,100℃煮沸10 分钟,根据蛋白大小选择配制合适浓度的SDS- PAGE 分离胶浓度(LC3 15KD12%,Beclin-1 60KD10%),每孔上样量为20 μg。电泳后300 mA转膜1小时,5%脱脂奶粉封闭1小时,4℃孵育一抗过夜(抗体浓度均为1∶1000),TBS-T洗涤3次,室温孵育二抗(1∶5000)1小时,TBS-T洗涤3次,ECL发光试剂盒显色,图像拍照保存。ImageJ 软件分析蛋白条带。以GADPH 为内参照标化相关蛋白表达量。
1.9 Real-Time PCR分析
将小鼠主动脉剪碎,玻璃匀浆器匀浆,采用RNAisoPlus 试剂提取组织总RNA,按逆转录试剂盒步骤逆转录合成cDNA。应用CFX96 Real-Time PCR Detection System 的操作方法,反应体系为20 μl,将PCR 反应液放入仪器中进行扩增,扩增程序为:95℃30 秒,PCR 反应,39Cycles,95℃5 秒,60℃30 秒。数据采用2-ΔΔCT方法计算Beclin-1、LC3、GAPDH mRNA 的相对表达量[12](表1)。

表1 目的基因的引物序列
1.10 统计学分析
采用Graph Pad Prism7 软件进行统计学分析,计量资料以±s表示,组间对比采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 游泳运动对小鼠体重的影响
实验开始时3 组小鼠体重基本相同,差异无统计学意义。随着实验的进行,与对照组相比,高脂喂养的模型组小鼠体重增加迅速,并于第6 周开始出现显著差异(P<0.01)。实验组小鼠经游泳运动后体重较模型组下降,并于第10 周开始出现显著性差异(P<0.05)。实验结束时,模型组小鼠体重净增长量较对照组显著增加(P<0.01),而实验组小鼠体重净增长量较模型组减少,差异有统计学意义(P<0.01)。如图1所示。
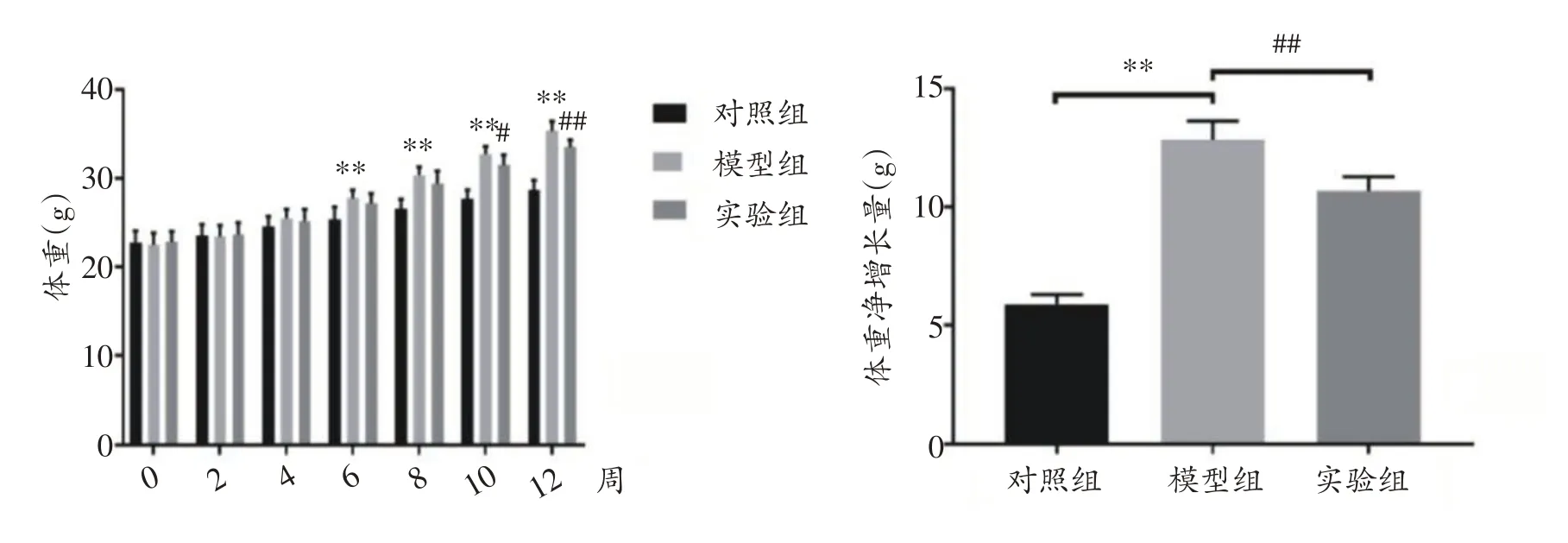
图1 各组小鼠体重比较(n=20)
2.2 游泳运动对小鼠血脂及相关炎性因子的影响
模型组ApoE-/-小鼠血清TC、TG 以及炎性因子sICAM-1、MMP-9、IL-6 较对照组显着增加(P<0.01),而实验组小鼠经运动干预后,TC、TG、sICAM-1、MMP-9、IL-6 的水平均较模型组显著降低(P<0.01)。如表2所示。

表2 各组小鼠TC、TG、sICAM-1、MMP-9和IL-6水平比较(n=20)
2.3 游泳运动对小鼠AS形成的影响
通过HE染色(图2)和对斑块面积的测量(图3)以及油红O染色(图4)可知:对照组小鼠的主动脉中几乎没有肉眼可见的病变,血管结构、形态正常,内膜连续性完整。与对照组相比,高脂饮食喂养的ApoE-/-小鼠则出现明显的粥样斑块(P<0.01),在内膜下可清楚地观察到泡沫细胞聚集和胆固醇晶体沉积。相比之下,实验组小鼠主动脉内粥样斑块病变程度明显减轻(P<0.01)。12 周的游泳干预可以部分逆转实验组小鼠主动脉病变。
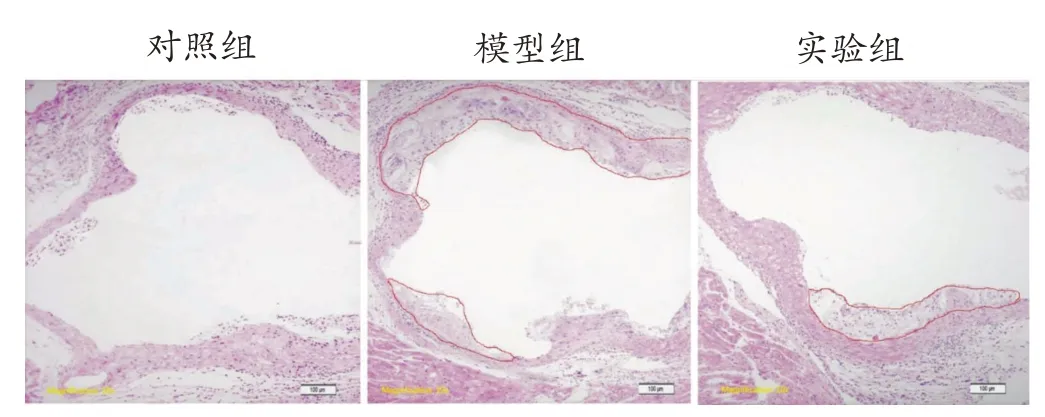
图2 各组小鼠主动脉横断面HE染色(×100)

图3 各组小鼠主动脉横断面斑块面积比较(n=15)
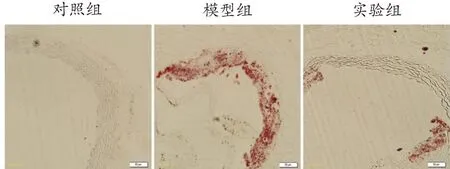
图4 各组小鼠主动脉横断面油红O染色(×200)
2.4 游泳运动对小鼠血管自噬活性的影响

图5 各组小鼠主动脉自噬标记物(Beclin-1、LC3)免疫组化染色(×200)及平均光密度比较(n=15)
在免疫组织化学检测中,Beclin-1和LC3主要在细胞浆内以棕黄色颗粒阳性表达。本研究结果显示,模型组中的棕黄色阳性颗粒较对照组减少(P<0.01)。而与模型组相比,实验组中的棕黄色阳性颗粒表达显著增多(P<0.01),这提示运动训练增强了小鼠主动脉的自噬活性(图5)。
此外,我们通过实时RT-PCR和Western-Blot技术进一步验证了我们的假设。实验组小鼠主动脉组织中Beclin-1和LC3的mRNA和蛋白水平均显著升高,与模型组存在显著性差异(P<0.01)(图6、7)。
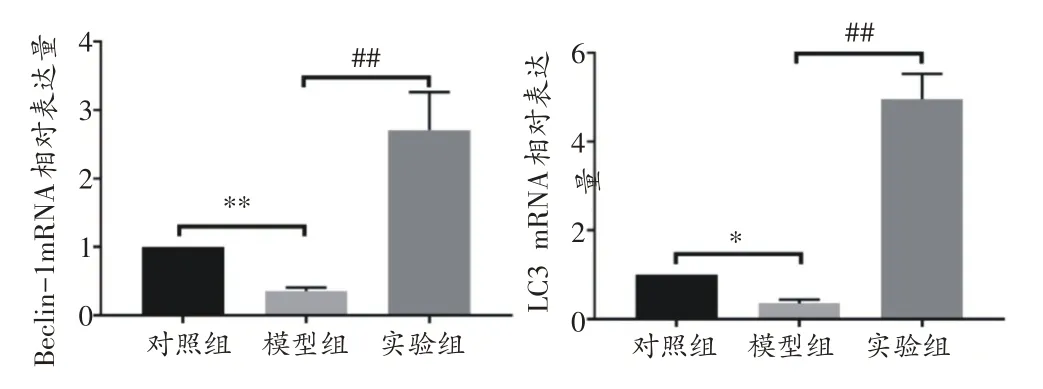
图6 各组小鼠主动脉自噬标记物(Beclin-1、LC3)mRNA表达比较(n=5)
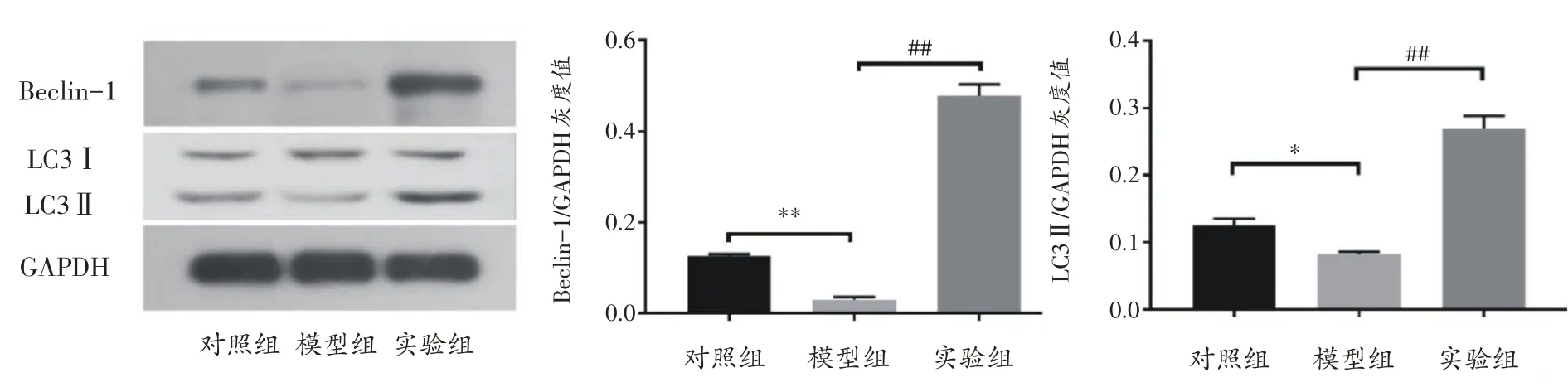
图7 各组小鼠动脉组织自噬标记物(Beclin-1、LC3)蛋白表达比较(n=5)
3 讨论
3.1 运动对主动脉自噬水平的影响
自噬是一种复杂的降解途径,通过溶酶体融合和水解酶的作用来转运、降解受损的蛋白质或功能障碍的细胞器,在饥饿、肥胖、体力活动增加等能量应激条件下,自噬通常会被激活,分解受损的蛋白质和细胞器,并重新合成新的细胞器和三磷酸腺苷(adenosinetriphosphate,ATP),在维持细胞内环境稳态和影响细胞存活等方面发挥着重要作用[13]。近些年来,人们发现运动能够引起适应性自噬活性增强,并对AS等多种慢性疾病的防治有积极作用。但运动过程中自噬相关的调控机制尚不明确。Beclin-1 是在自噬途径中影响自噬小体形成与成熟的关键物质,其水平的上调通常意味着自噬活性的增强。LC3被ATG4裂解,产生胞质定位的LC3-Ⅰ,该蛋白被泛素样系统修饰并与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)共价结合形成LC3-Ⅱ,并定位在自噬体膜上。LC3-Ⅱ与LC3-Ⅰ比值的大小可以衡量自噬水平,其比值的增加说明自噬增强[14]。
本研究中,我们选择被广泛应用于AS 模型的ApoE-/-小鼠。在实验结束时,动脉粥样硬化模型组小鼠主动脉中的LC3 和Beclin-1 较对照组小鼠在mRNA和蛋白水平均降低,LC3-Ⅱ与LC3-Ⅰ比值减少,这与Ding等[12]的研究一致。Cao等[15]也通过透射电镜观察到AS 小鼠主动脉斑块中自噬小体显著减少,LC3-Ⅱ/LC3-Ⅰ比值降低,这表明自噬活性在AS 期间受到抑制。这可能与细胞内大量脂质沉积阻碍了自噬体与溶酶体的融合有关。本研究中,经12 周的游泳运动干预,与模型组小鼠相比,实验组小鼠LC3和Beclin-1在mRNA和蛋白质水平均有所升高,LC3-Ⅱ与LC3-Ⅰ比值增加,说明运动可以通过提高自噬相关蛋白水平而增加主动脉自噬活性。其原因可能是长期运动产生的机械压力、能量应激导致多种蛋白质及细胞器受损,自噬适当激活,将受损的胞质内容物清除,抑制氧化应激、炎症反应等介质诱导的细胞凋亡[16],提高了细胞对病变部位应激环境的抵抗力。Green等[17]研究认为,运动引起的间歇性血流动力学刺激能够增强血管壁的结构和功能,有助于抑制AS 形成。最近研究发现,规律的体育锻炼促进动脉血管内皮细胞一氧化氮合酶(endothelial nitric oxide synthase,eNOS)磷酸化及一氧化氮(nitric oxide,NO)生成,同时伴随着自噬标志物,包括Beclin1、LC3、ATG3、溶酶体相关膜蛋白2A(lysosomal-associated membrane protein 2,LAMP2)的升高以及p62水平的降低[18]。综上可知,长期游泳运动可以提高ApoE-/-小鼠主动脉的自噬水平。但也有研究表明,训练啮齿类动物5 天至3 个月后,自噬相关蛋白如ATG5/12 或LC3-Ⅱ/LC3-Ⅰ比值未见明显变化[19]。研究发现,不同年龄段的小鼠运动后自噬相关蛋白Beclin-1 和AGT7 的表达也存在差异[20],这提示运动对自噬的影响是多变的,可能受到运动强度、机体状态、营养程度、组织类型等多种因素的影响。
3.2 运动激活的主动脉自噬通过调节炎症反应及脂质代谢抑制AS的形成
炎症反应及脂质代谢异常是AS 发生发展的重要危险因素。正常情况下,细胞内胆固醇的流入与流出存在微妙的平衡关系,这种平衡的破坏导致脂质集聚于内皮下并形成脂质条纹,成为AS早期阶段的显著特征,包括TNF-ɑ、IL-6,IL-1、人单核细胞趋化蛋白-1(MCP-1)、MMP-9、sICAM-1在内的多种炎性因子都参与了动脉粥样硬化的发病过程[21,22]。
本研究中,我们对ApoE-/-小鼠进行12 周高脂饮食喂养。模型组表现出典型的动脉粥样硬化表现。在相同的饮食条件下,实验组进行了早期预防性运动,结果显示,实验组小鼠主动脉斑块负荷明显减少,胆固醇结晶及泡沫细胞数量显著减少,说明12周规律游泳运动对AS的预防有积极作用。
本研究对游泳激活自噬抑制动脉粥样硬化斑块形成的作用机制做了初步探讨。结果发现,游泳运动能改善小鼠体内的脂质代谢异常。模型组除表现出典型的动脉粥样硬化表现外,其体重及循环TC、TG 水平更高,这与前人的研究结果一致[11]。而实验组小鼠经游泳运动,其循环TC、TG 较模型组显著降低,说明12 周规律的游泳运动对脂质代谢调节有积极作用。Wu 等[23]研究观点相近,但Cesar 等[24]认为运动引起食物摄入量增加,会削弱运动的抗AS 作用。在Pellegrin[25]的研究中,循环中TC、TG的浓度不受运动因素的干扰,这与我们的实验结果不一致。这种差异的主要原因可能与两个实验的运动方式和饮食配方不同有关。
值得注意的是,我们发现在动脉粥样硬化动物模型中,通过游泳运动能显著抑制炎症反应。模型组小鼠的斑块不仅具有较丰富的脂质核心,同时其循环中的sICAM-1、MMP-9和IL-6水平显著高于对照组。而运动组炎性因子的表达水平显著低于模型组,可能由于游泳运动激活的自噬活动负向调控动脉粥样硬化模型中的炎症反应,进而抑制AS的病理进程。大量文献表明,细胞自噬激活能有效抑制炎症反应。Jones 等[26]认为,自噬通过调节炎性因子的分泌而影响微环境中的免疫应答,一般来说,细胞自噬及其相关蛋白往往对于炎症反应具有明显的负调控作用。当自噬调控基因ATG7 被敲除时,脂多糖依赖的炎性小体被激活,并伴随着IL-1β、IL-18 等多种炎性因子的释放[27]。但目前为止,细胞自噬抑制炎症反应的机制尚不明确。一种解释是,细胞自噬会下调ROS的产生,进而抑制炎症小体;另一解释为,自噬会加快凋亡细胞的清除而弱化炎症反应[28]。Zhou等[29]发现,桑黄素能够抑制ApoE-/-小鼠动脉粥样斑块的形成,并降低其炎性细胞因子(TNFα、sICAM-1、COX-2)水平,其抗炎作用可能与cAMPPRKA-AMPK-SIRT1信号通路诱导自噬激活有关。蛋白酶活性的增加是不稳定斑块的特征之一。运动降低小鼠体内循环MMP-9 水平,可能有益于斑块的稳定性。Shon等[30]的研究也出现了类似的结果。我们推测游泳运动激活的自噬活动通过负向调控动脉粥样硬化模型中的炎症反应,以及调节机体的脂质代谢,抑制AS的病理进程。
4 结论
游泳运动能够上调小鼠主动脉血管壁自噬活性,改善ApoE-/-小鼠体内脂质代谢失衡和降低相关炎性因子的水平,有效抑制动脉粥样硬化斑块的形成。
