干细胞稳态和动员的自主神经调控研究进展
2020-06-17陈小燕综述李清梅季诗梦程婷婷陈翠翠宋元林审校
陈小燕(综述) 李清梅 季诗梦 程婷婷 周 建,2 陈翠翠,2 苏 枭 宋元林,2,3,4△(审校)
(1复旦大学附属中山医院呼吸与危重症科 上海 200032;2上海市呼吸病研究所 上海 200032;3复旦大学附属中山医院青浦分院呼吸科 上海 201700;4国家老年疾病临床医学研究中心(华山) 上海 200040;5中国科学院上海巴斯德研究所 上海 200032)
干细胞是一类具有自我不断更新和多向分化潜能的细胞,它们在维持机体稳态和组织修复过程中起着重要作用。研究发现干细胞自我更新潜能的维持依赖于干细胞龛。干细胞龛即干细胞周围微环境,包括各种干细胞毗邻的细胞、基质和黏附分子。他们为干细胞提供了一个维持静止状态的场所,在受干细胞动员分化相关信号刺激后,调控干细胞的激活、增殖、分化和迁移等活动以适应机体需求[1-2]。其中参与调控干细胞龛稳态的主要因素就是自主神经系统。
自主神经系统是一个复杂而精确的系统,通过中枢的远程调控调节机体的各种反应。自主神经系统包括交感神经系统(sympathetic nervous system,SNS)和副交感神经系统(parasympathetic nervous system,PNS)[3]。但小部分 SNS 在出生后的一些特殊部位如骨膜和唾液腺体,其神经纤维性质由去甲肾上腺素能转换成胆碱能纤维成分[3-5]。自主神经纤维及其受体广泛分布于机体的脏器和组织中,调控着机体重要的生理功能,如图1 所示。
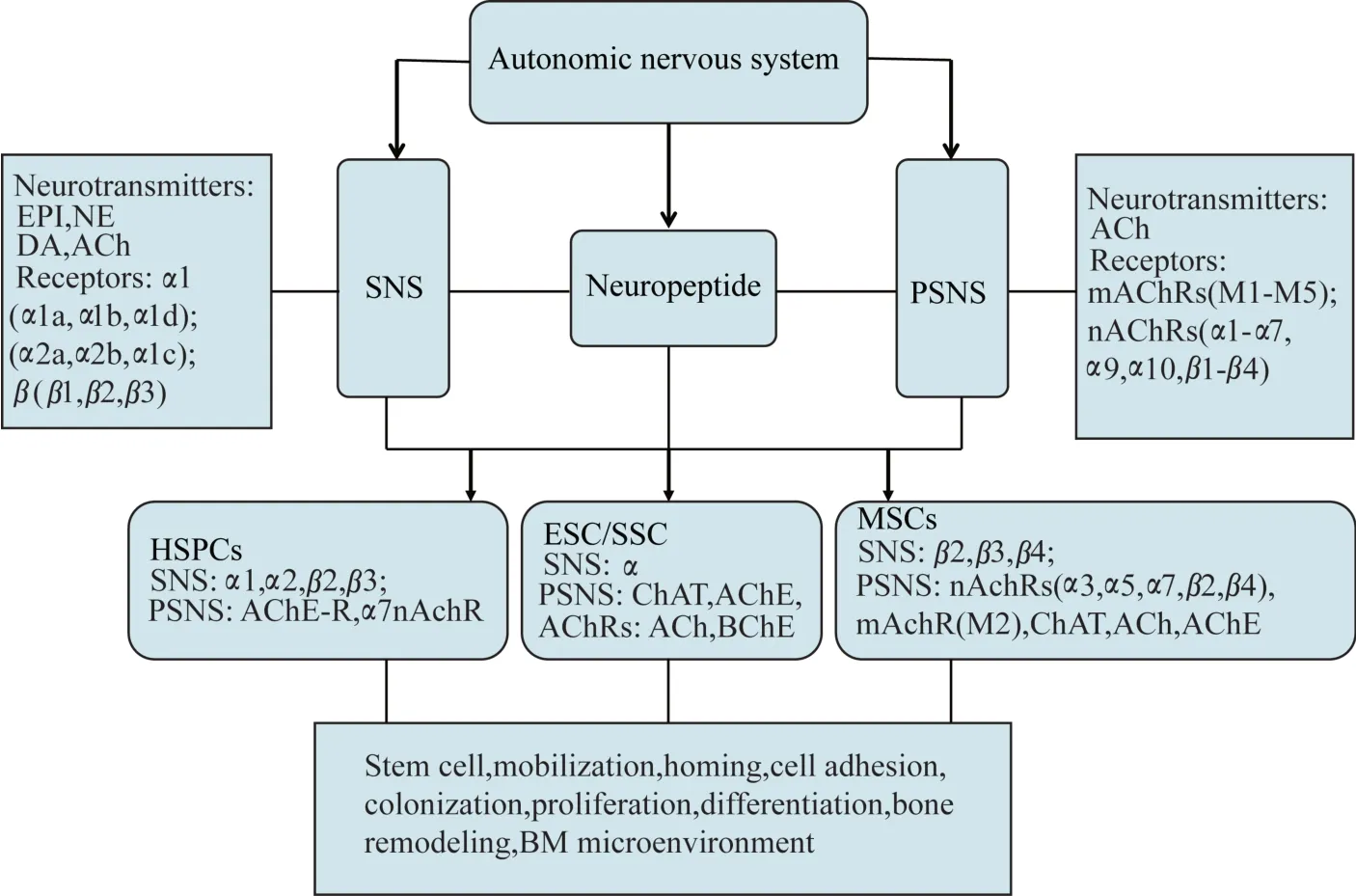
图1 自主神经对干细胞的调控Fig 1 The autonomic nervous regulation of stem cell
交感(去甲肾上腺素能)神经系统对干细胞的调控交感(去甲肾上腺素能)神经由脊髓胸腰段侧角内发出神经纤维到交感神经节,再从神经节换元发出纤维分别到内脏、心血管和腺体。交感(去甲肾上腺素能)神经系统的主要神经递质是儿茶酚胺类,包括肾上腺素(epinephrine,EPI),去甲肾上腺素(norepinephrine,NE)和多巴胺(dopamine,DA),还有一些分泌性神经递质如神经肽Y 和嗜铬颗粒蛋白也可影响交感(去甲肾上腺素能)神经的兴奋性。交感(去甲肾上腺素能)神经系统的受体亚基主要分为 α1、α2 和 β 3 类,组成至少 9 种受体复合体,分 别 是 3 个 α1 类 受 体(ADRAlA、ADRAlB 和ADRAlD)、3 个 α2 类受体(ADRA2A、ADRA2B 和ADRA2C)和 3 个 β 类 受 体(ADRBl、ADRB2 和ADRB3)。研究显示干细胞上表达有交感神经受体,干细胞的增殖、迁移分化以及动员、归巢受交感神经调控[6]。
交感(去甲肾上腺素能)神经系统调控HSPCs造血干祖细胞(hematopoietic stem and progenitor cells,HSPCs)作为一种成体干细胞,是发现最早、研究最深入及应用最广泛的干细胞,其具有极强的自我更新潜能和多向分化能力[7]。静息状态的HSPCs 主要存在于机体的骨髓造血龛中,包括骨内膜龛和血管周围龛。造血龛中的成骨细胞,nestin+间充质干细胞,富含CXCL12 的CAR 细胞和骨巨噬细胞,通过各种黏附分子如成骨细胞的CAMs,nestin+间充质干细胞的 ANGPT-1,VCAM-1,SCF,CXCL-12 以及 CAR 细胞的 SCF 和 CXCL12 共同维持HSPCs 的静息状态。尽管研究报道仅有5%左右的交感神经分布在骨髓[8],但相较于大面积的骨内膜区的神经支配而言,骨髓腔的自主神经支配密度已经很高。人和啮齿类动物的HSPCs 均表达肾上腺素能受体,主要是 α1,α2 和 β2[6]。SNS 对造血干细胞调控的研究最早报道于1998 年,Maestroni等[9]描述了骨髓NE 的昼夜节律改变和造血干细胞增殖呈正相关。SNS 通过调控造血龛来调控HSPCs 激活和动员入血[10]以及昼夜节律变化。HSPCs 的归巢行为依赖于交感神经对HSPCs 和骨髓造血龛的精细调控。前期研究发现交感(去甲肾上腺素能)神经可调节骨髓HSPCs 动员的昼夜生理节律[11]、迁移能力、骨髓重建[12]及 G-CSF 或者岩藻多糖诱导的HSPCs 动员入血以及归巢[13]。其中β2 和 β3 肾上腺素能受体参与 HSPCs/WBCs 的动员和归巢[14]。CXCL12-CXCR4 轴是调节 HSPCs 和白细胞动员入血和迁移的主要化学轴[15-16]。Mendez-Ferrer 等[11]报道了通过光刺激 SNS 削弱骨髓龛CXCL12 表达,促进HSPC 动员入血,而这一过程是需要 β2 和 β3 肾上腺素能受体的参与[14]。基因敲除或者化学性切除SNS 则可抑制G-CSF 诱导的CXCL12 减少,从而抑制HSPCs 的动员。尿苷二磷酸盐-半乳糖神经酰胺半乳糖基转移酶CGT 为半乳糖脑苷脂合成酶,可影响神经髓鞘形成以及神经传导 功 能 。 Katayama 等[17]发 现 敲 除Cgt引 起 的HSPCs 动员缺陷不是直接由半乳糖脑苷合成减少导致,更确切地说应该是交感神经对造血龛的调控所致。一项研究采用脓毒血症、镰刀细胞性血管闭塞和骨髓移植模型证实骨髓白细胞和干细胞募集至局部组织依赖于由β 肾上腺素能受体以及局部微环境NE 调控的内皮细胞黏附分子的昼夜节律性表达[13]。以上研究说明与生物钟密切相关的中枢神经系统分子可能通过调控局部NE 释放影响HSPCs在骨髓中的定植、动员和归巢。
交感(去甲肾上腺素能)神经系统调控MSCs间充质干祖细胞(mesenchymal stem and progenitor cells,MSCs)是一种多能干细胞,最先在骨髓中被发现并提取。随后在其他组织器官如脂肪[18]、皮肤[19]、脐带血[20]和肺[21]等也发现了 MSCs。在骨髓中造血龛的成骨细胞和nestin+MSCs 均表达β 肾上腺素受体。不同的是成骨细胞是通过β2 肾上腺素受体调控骨的重塑[22],而 nestin+MSCs 则是通过 β3肾上腺素受体调控骨髓微环境的稳态以及干细胞动员[11]。在去神经的动物模型中发现阻断交感神经信号传递促进了静息MSCs 的增殖;肾上腺素刺激则通过β3 肾上腺素受体抑制成骨细胞分化和抑制调控 HSPCs 的相关基因表达[14]。
副交感(胆碱能)神经系统对干细胞的调控副交感(胆碱能)神经发自延髓内侧核,包括疑核、背核、三叉神经脊束核和孤束核[23-24]。副交感(胆碱能)系统还包括乙酰基转移酶(acetyltransferase,ChAT)和 乙 酰 胆 碱 酯 酶(acetylcholinesterase,AChE)。 研究发现人 CD34+造血祖细胞表达AChE-R 且胆碱能系统可调控造血系统的发展。迷走神经是第十对脑神经,其主要成分是副交感神经纤维,由传入神经(80%的感觉神经纤维)和传出神经(运动神经纤维)[25]组成。机体局部损伤、感染或炎症信号可通过迷走传入纤维将信号传至孤束核[26]。迷走神经的传出纤维分布广泛,其节后纤维可支配多种内脏器官。传统观点认为迷走神经主要功能是通过神经递质乙酰胆碱(acetylcholine,Ach)调控心率、支气管舒缩、胃肠道功能[27]和骨质增生[28]。目前进一步研究发现迷走神经受体还表达在一些非神经细胞上,包括巨噬细胞、树突状细胞、淋巴细胞、角质细胞、内皮细胞[25]以及干细胞[29-31],从而发挥免疫调节、抗炎症作用以及影响干细胞增殖迁移归巢等能力。 乙酰胆碱受体(acetylcholine receptors,AChRs)主要分为两大类:毒蕈碱型(muscarinic acetylcholine receptors,mAChRs;M1-M5)[32-33]和烟碱型(nicotinic,nAChR)[33]。 mAChRs是G蛋白偶联受体家族。nAChRs 则有异型或者同型亚基围成一个促离子型阳离子受体跨膜通道,可被尼古丁激活。人体中存在 9 种 α 亚基包括 α1-7,α9 和 α10和4种β亚家族(β1-β4)[33]。除了 α7,α9 和 α10 nAChRs 为同聚体外,大部分nAChRs 是异聚体。典型的nAChRs 主要是钾离子和钠离子通道,而α7 同聚体则是钙离子通道。有趣的是,除了通过AChRs 发挥生理调控作用,α7在胆碱能系统对非神经组织的调控中也起重要作用,其中就包括对干细胞及其干细胞龛的调控。
副交感(胆碱能)神经系统调控 HSPCsGahring 等[34]采用α7nAChRCre:YFP小鼠确切地检测到骨髓细胞包括造血干细胞lineage-Sca1+c-kit+(LSK)表达迷走神经受体α7nAChR。这个结果与早期研究[35]认 为 nAchR 在 造 血 细 胞 系 FDCP-mix 中 不 表达的结论不一致。这可能与两个原因有关,一方面是nAchR 本身表达量很低,很难用简单的FACS 流式方法检测,另一方面可能是早期研究仅用了一种造血细胞系来检测,不能代表骨髓的所有细胞。Gahring 等[36]证实在造血干细胞 LSK、淋巴细胞或其他骨髓细胞均有约16.67%细胞表达α7nAChR,说明α7nAChR+细胞在造血早期就形成且比例不变,而且 α7nAChR+细胞包括 α7nAChR+LSK 具备骨髓重建能力。研究发现胆碱能系统参与干细胞造血过程,尼古丁(nAChR 激动剂)可抑制骨髓干细胞重建和造血功能。
干细胞滚动和黏附是干细胞归巢和动员的关键步骤,nAChRs 参与了这个复杂而高度协调的生理过程。Khaldoyanidi 等[37]研究发现尼古丁通过减少骨髓基质细胞及其细胞系MS-5 的CD44 表达抑制HSPCs 归巢。同时,尼古丁还可降低肺微血管内皮细胞系LEISVO 和骨髓来源的内皮细胞系STR-12 的 CD44 表达,增加 LEISVO 细胞系 E-selectin 表达[37]。尽管nAChRs 敲除不会引起小鼠造血异常[38-40],但有研究表明尼古丁激活内皮细胞上的nAchR 可引起快速的细胞骨架重构和足突形成,抑制 SDF-1 介导的 HSPCs 跨内皮迁移[35]。用非选择性的nAChR 阻滞剂美加明可阻断尼古丁介导的造血干细胞系黏附于内皮细胞的作用。HSPCs 迁移减少和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)活性降低以及内皮细胞CD44 表达减少有关。因此,nAChRs 参与干细胞归巢,促进干祖细胞黏附内皮细胞,增强干细胞在组织血管定植能力[35]。 GDNF 受 体 家 族 α2(GDNF family receptor alpha 2,GFRα2)是促进副交感(胆碱能)纤维[41]和交感(胆碱能)纤维生长存活的蛋白[42]。因此,Gfra2-/-敲除鼠可作为骨髓胆碱能神经缺失模型来探究胆碱能神经对HSPCs 的调控作用。最新研究发现Gfra2-/-敲除鼠夜间因骨髓血管黏附增多导致HSPCs 朝骨髓归巢增强[43]。
Pierce 等[44]发现中枢胆碱能信号通过激活大脑毒蕈碱型受体(muscarinic receptor type-1 receptor,Chrm1R)传递激素转导信号从而影响G-CSF 诱导的造血干细胞(hematopoietic stem cells,HSCs)动员。胆碱能神经通过激活下丘脑-垂体-甲状腺(hypothalamic-pituitary-adrenal,HPA)轴,促进糖皮质激素合成。糖皮质激素可激活HSCs 的Nr3c1 受体上调其肌动蛋白重组分子,从而增强的HSCs 迁移能力。进一步研究还发现胆碱能信号可双向调节HSPCs 和白细胞的昼夜节律性迁移[43]。
副交感(胆碱能)神经系统调控MSCs副交感(胆碱能)神经系统也能调控MSCs 的迁移和分化[29-30,45]。Hoogduijn 等[30]发现人骨髓MSCs表达迷走神经受体nAChRs(α3,α5,α7),mAChR(M2),ChAT,ACh 和 AChE,且证实有机磷(AChE 抑制剂)可影响 MSC 增殖和分化[46]。Schraufstatter 等[47]也发现人 MSCs 表达 nAChRs 受体亚基 α 7,β2 和 β 4。 最新研究发现胆碱能神经系统缺陷小鼠EPGfra2-/-骨髓Nestin-GEPlowMSCs 减少了40%。
SNS 和PNS 协同调控干细胞去甲肾上腺素能和胆碱能纤维均存在交感神经中,因此SNS 和PNS 很可能存在交叉对话协同调控干细胞行为。光可以兴奋交感神经而抑制副交感张力[48-49]。研究发现在白天光通过去甲肾上腺素受体β3 兴奋骨髓外周交感神经,破坏CXCL12 化学浓度梯度,促进HSPCs 和白细胞动员入血;同时胆碱能纤维能减少干细胞血管黏附分子VCAM-1 和E-selectin 的表达,减少血管黏附和干细胞归巢[43]。相反,夜间交感神经的胆碱能纤维抑制骨髓去甲肾上腺素受体β 3 表达,破坏夜间内分泌来源的高水平肾上腺素诱导的去甲肾上腺素受体β2 依赖的HSPCs 血管黏附和归巢。正常生理状态下,夜间中枢PNS 可抑制外周交感去甲肾上腺素张力,促进夜间干细胞归巢[43]。该结论和前期研究发现从白天向夜间过渡时小鼠副交感张力增加一致[50]。但是奇怪的是,夜间机体通过HPA 轴释放更多肾上腺素[51-52]。交感神经还可调控乙酰胆碱受体的稳定性从而影响PNS 系统对干细胞的调控[53]。目前,仅有少数文献报道骨髓局部胆碱能神经的调控且主要集中在骨重塑方面,胆碱能信号可通过抑制交感张力影响骨代谢[28,54]。因此,PNS 和 SNS 也可能交互作用共同调控干细胞行为。
其他神经肽系统对干细胞的调控神经肽(Neuropeptide Y,NPY)是交感神经和脑细胞分泌的一种重要神经递质。最近越来越多研究发现NPY 在骨髓造血干细胞的动员中发挥不可忽视的作用[55-59]。G-CSF 动员 HSPCs 的过程也依赖 NPY信号转导。NPY1 可维持血管完整性,NPY2 和NPY5 则可介导内皮细胞间VE-Cadherin 和CD31降解增加内皮细胞的间隙。研究发现DPP4/CD26可使骨髓窦内皮细胞的NPY1 降解为NPY2 和NPY5,使得骨髓窦血管通透性增加,HSPCs 跨内皮动员增加[55]。神经生长因子(neurturin,NRTN)[60]与其受体GFRα2 结合可维持胆碱能神经元的生长发育。囊泡乙酰胆碱转运体(vesicular acetylcholine transporter,VAChT)是交感神经的胆碱能纤维的标志[42]。 García-García 等[43]发 现和Gfra2-/-鼠相 比 ,Nrtn-/-鼠骨的VAChT+胆碱能纤维增加两倍,但是中枢交感/副交感纤维数量不变。因此Nrtn-/-鼠可用作骨的胆碱能神经回复实验模型。研究还发现Nrtn-/-鼠白天骨髓HSPCs 归巢减少了25%,说明局部交感(胆碱能)纤维抑制骨髓干细胞归巢[43]。再者,Nrtn-/-鼠夜间骨髓粘附分子VCAM-1 和E-selectin 显著减少,说明了局部交感(胆碱能)信号纤维抑制干细胞的血管黏附。
自主神经系统对其他干细胞的调控自主神经系统也参与其他干细胞的干性维持、增殖和分化过程。研究发现刺激nAChRs 可上调小鼠胚胎干细胞(embryonic stem cells,ESCs)胚胎干性标志 Oct-4 和Rex-133。随后研究还报道了小鼠和人的ESCs具 有 胆 碱 能 系 统(ChAT,AChE,AChRs,ACh,BChE[36,61-62],尼古丁可激活 ESCs 上的 nAChRs 从而激活MAPK 信号转导系统使ESCs 朝成血管方向分化[36]。 ACh 增 加 了 ESCs 细 胞 活 性 但是抑 制 了 增殖。ESCs 细胞早期分化时 ACh 合成增加[63];哺乳动物胰腺副交感(迷走)神经和交感神经纤维分布密集,其中迷走神经促进胰腺 β 细胞增殖[64],诱导内分泌祖细胞、α 细胞和 β 细胞再生[65]。交感神经还参与了肝脏祖细胞的损伤修复过程[66]。
临床意义造血干细胞的移植治疗依赖于有效的外周血HSPCs 动员。临床上常用G-CSF 诱导干细胞动员,用于各种恶性血液疾病,如淋巴母细胞白血病、淋巴瘤和多发性骨髓瘤的治疗。但在一些接受了抗肿瘤化疗的患者中这种动员效率往往较低[67]。研究报道化疗药的神经毒性可削弱交感神经张力使得干细胞的动员效率降低[68]。例如化疗方案中的高剂量糖皮质激素最终可导致肾上腺功能不全,从而导致这些患者的干细胞动员效果差[44]。在1 型和2 型糖尿病动物模型和糖尿病患者中,干细胞动员能力显著下降。这与骨髓龛中成骨细胞较少、颅盖骨骨髓神经纤维增加以及β-肾上腺素受体敏感性改变密切相关[69]。骨髓造血微环境的改变,包括交感神经损伤可促进各种血液病的恶性进展。在白血病模型中,儿茶酚胺能神经损伤后,表达β2 受体的MSCs 大量增殖。在骨髓增殖异常综合征疾病模型中,基因突变的HSPCs 分泌IL-1β 可损伤交感神经和施旺氏细胞。相反地,在急性髓细胞白血病小鼠中,神经病变可引起表达β3 受体的MSCs 凋亡而致其数量减少[70]。通过这些基础研究我们推测未来通过刺激自主神经或者给予神经受体激动剂、抑制剂或者神经递质类似物可能可以实现通过调控干细胞及其微环境,从而改变疾病的进展。
自主神经系统对干细胞调控的机制是错综复杂的,尽管目前对于这些机制的研究有了很大的进步,但是确切的机制还需要进一步探究。例如,迷走神经除了作用在骨髓龛外是否直接作用在干祖细胞本身,以及这些机制是否单一因素就足够诱导动员还是需要彼此配合共同发挥作用,这些都尚未被完全阐明。相信随着影响自主神经来动员干细胞机制研究的不断深入,继而转化并指导临床中治疗各种疾病,如肺纤维化、慢性阻塞性肺病及神经退行性病变等都将成为可能。
