乳腺癌促性腺激素释放激素受体(GnRH-R)的表达及临床意义
2020-06-17陈宏亮孙艺华张明迪吴克瑾
陈宏亮 程 倩 孙艺华 王 超 柏 方 张 鹏 张明迪 林 清 吴克瑾△
(1复旦大学附属妇产科医院乳腺外科,2病理科 上海 200011;3同济大学附属第十人民医院放疗科 上海 200072)
促性腺激素释放激素受体(gonadotropin releasing hormone receptor,GnRH-R)最初被发现分布于腺垂体。GnRH 类似物(GnRH analogs,GnRHa)通过与垂体的GnRH-R 结合,从而抑制垂体促性腺激素的生成,使得卵巢性腺激素水平处于绝经后的状态,发挥药物去势的作用。基于这一作用机制,GnRHa已被广泛应用于辅助生育技术、治疗青春性早熟、性激素依赖性疾病,如子宫内膜异位症等。在激雌素受体(estrogen receptor,ER)阳性的乳腺癌中,GnRHa 通过药物去势作用加强了内分泌治疗。随着SOFT、TEXT、ASTRA 等大型Ⅲ期随机对照临床试验结果的陆续公布,明确了在口服内分泌药物的基础上加上GnRHa 卵巢功能抑制(ovarian function suppression,OFS)能够显著提高绝经前中高危患者的生存率[1-3]。而GnRHa 在激素受体阴性乳腺癌中的应用主要是在化疗中抑制卵巢功能从而降低化疗致卵巢早衰的风险[4]。这两种应用都是基于GnRHa对于下丘脑-垂体-卵巢性腺轴的抑制作用。
近年来发现在腺垂体以外的组织中亦有GnRH-R 的表达[5]。研究发现,在许多生殖系统肿瘤中,如子宫内膜癌、卵巢癌、前列腺癌等,存在GnRH-R 的充分表达[6-10];而在其他一些非生殖系统肿瘤中,如黑色素瘤、胰腺癌、结肠癌等,也存在GnRH-R 的表达[11-14]。肿瘤细胞表达的 GnRH-R 与分布于垂体的GnRH-R 在构象与信号传导通路方面都存在着显著的差异[15-16]。许多肿瘤细胞株的体外实验中发现,GnRHa 通过与肿瘤细胞表达的GnRH-R 相互作用,发挥着抑制肿瘤细胞增殖、转移、新生血管生成等作用[17-18]。
关于乳腺癌组织中GnRH-R 的表达状况以及临床意义,目前文献报道较少。本文旨在分析乳腺癌GnRH-R 表达状况及其与临床病理因素的相关性,并进一步探讨不同亚型乳腺癌中GnRH-R 的表达与生存预后的相关性。
资料和方法
组织标本收集2013 年至2018 年在复旦大学附属妇产科医院以及同济大学附属第十人民医院行手术的787 例早期乳腺癌病理组织标本,包括656例浸润性导管癌组织以及131 例癌旁组织的石蜡组织块。所有乳腺癌组织对应的病例要求临床病理资料以及随访数据完整。所有患者均签署留取组织标本的知情同意书,术前均未接受放化疗或内分泌治疗。定义 ER、PR≥10% 阳性为 ER、PR 阳性表达。
免疫组化染色及分析所有组织样本经10%甲醛溶液固定、常规石蜡包埋、4 μm 切片,制成组织芯片。经脱蜡,柠檬酸缓冲液(pH 6.0)修复,3%过氧化氢甲醇溶液去内源性过氧化物酶,10%正常兔血清封闭。一抗采用抗GnRH-R 抗体(英国Abcam公司,ab183079),二抗采用辣根过氧化物酶标记的山羊抗兔抗体(武汉塞维尔生物科技有限公司,GB23303)。DAB 显色液显色,苏木精染液复染细胞核。苏木精染细胞核为蓝色,DAB 显出的阳性表达为棕黄色。GnRH-R 表达于细胞膜和细胞质。扫描组织芯片,图片扫描完成后使用Quant center 分析软件自动识别计算组织切片上所有点的H-score评分(阳性的细胞数量及其染色强度转化为相应的数值)。所有点的免疫组化H-score 评分由低至高排序,前50%的定义为GnRH-R 低表达,后50%的定义为高表达。
随访采用门诊就诊或电话随访。随访时间为手术诊断乳腺癌之日起至末次随访时间或肿瘤复发或死亡。随访截止日期为2018 年12 月31 日。无病生存期(disease free survival,DFS)指从手术诊断乳腺癌之日起至第一次发现肿瘤复发或任何原因的死亡。
统计学方法运用SPSS 22.0 统计学软件进行统计分析。组间构成比的比较采用χ2检验,通过单因素分析筛选出GnRH-R 高表达的相关因素。采用Logistic 回归多因素分析筛选GnRH-R 高表达的独立相关因子。生存分析采用Kaplan-Meier 法,采用Log-Rank 检验比较两组间无病生存率。采用双侧检验,P<0.05 为差异具有统计学意义。
结 果
临床病理资料与GnRH-R 的表达状况本项研究共纳入2013 年至2018 年间诊断的乳腺癌病理组织样本656 例以及癌旁组织131 例。所有病例诊断时均无远处转移,接受全乳切除术或保乳手术,平均年龄57 岁(23~89 岁)。52.3%的病例肿块最大径≤2 cm,53.4%的病例腋窝淋巴结阴性,50.3%的病例组织学分级Ⅲ级,17.5%的病例伴脉管淋巴管侵犯(lymphovascular invasion,LVI)阳性,3.2%为多灶性病灶。65.5%的病例ER 阳性,49.7%的病例 PR阳性 ,23.3%的病例HER2过表达 、5 6.7%HER2 阴性,另20.0%的病例HER2 状态不明。免疫组化检测表明,癌组织中GnRH-R 的高表达率显著高于癌旁组织(54.0%vs.28.2%,P<0.001);而在ER 阴性的病例中,GnRH-R 高表达率显著高于ER阳性的病例(65.3%vs.48.0%,P<0.001)(图1)。

图1 GnRH-R 在乳腺癌及癌旁组织中的表达(×40)Fig 1 The expression of GnRH-R in breast cancer and paracancerous tissue(×40)
GnRH-R 表达率的相关因素分析根据单因素χ2检验,GnRH-R 高表达的患者中,N0 期的比例较高,ER、PR、LVI 阴性的比例较高、Ki-67 高表达的比例亦较高。此外,多灶性病变的比例呈相对较低的趋势。将单因素分析中P<0.2 的因子纳入多因素Logistic 回归分析中,可以得出,较低的N 分期、LVI 阴性以及高Ki-67 是GnRH-R 高表达的独立相关因素(表1,Hosmer-LemeshowP=0.024)。
GnRH-R 与乳腺癌生存预后分析为了确保足够的随访时间,我们将2018 年前诊断的537 例乳腺癌样本纳入生存分析。中位随访时间为32 个月(1~70 个月)。其中,63 例患者发生疾病的复发或转移。在整体样本中,GnRH-R 高表达与低表达患者的DFS 差异无统计学意义(Log RankP=0.132)(图2)。但是在ER 阴性的患者,GnRH-R 高表达的患者较低表达的患者DFS 显著改善(Log RankP=0.023),而在 ER 阳性的患者中,两者的 DFS 差异无统计学意义(Log RankP=0.676,图3)。

图2 GnRH-R 高表达与低表达乳腺癌患者的无病生存曲线Fig 2 Kaplan-Meier curves of DFS between breast cancer patients with GnRH-R high expression and low expression

表1 乳腺癌患者GnRH-R 表达相关的临床病理特征以及多因素Logistic 相关性分析Tab 1 Clinical-pathological characteristics related with expression of GnRH-R in patients with breast cancer and multiple Logistic analysis[n(%)]
讨 论
本研究发现,乳腺癌组织表达GnRH-R 显著高于癌旁组织,且GnRH-R 在激素受体阴性乳腺中的表达强度显著高于激素受体阳性的肿瘤。ER 阴性乳腺癌中,GnRH-R 高表达的肿瘤生存率显著高于GnRH-R 低表达肿瘤,提示在ER 阴性乳腺癌中,肿瘤细胞表达的GnRH-R 可能成为潜在的肿瘤治疗靶点。
目前已知GnRH-R 在许多生殖系统肿瘤中充分表达,如卵巢癌、子宫内膜癌等。肿瘤细胞表达的GnRH-R 与垂体系统GnRH-R 的作用机制有所不同[15,19]。肿瘤细胞表达的 GnRH-R 同样为 7 次跨膜G蛋白偶联受体,但是α亚基为αi亚基[16]。GnRH-R 激活后可增强胞内蛋白酪氨酸磷酸酶的活性,抑制下游一系列生长因子样受体如EGFR、IGFR 等的磷酸化过程,从而阻断下游促肿瘤进展的信号通路[16];亦或通过激活下游 p38、JNK 等信号通路,促进肿瘤细胞凋亡[20]。因此,肿瘤细胞表达的GnRH-R 与肿瘤的增殖、转移、血管生成等生物学行为密切相关,是潜在的治疗靶点[17-18]。
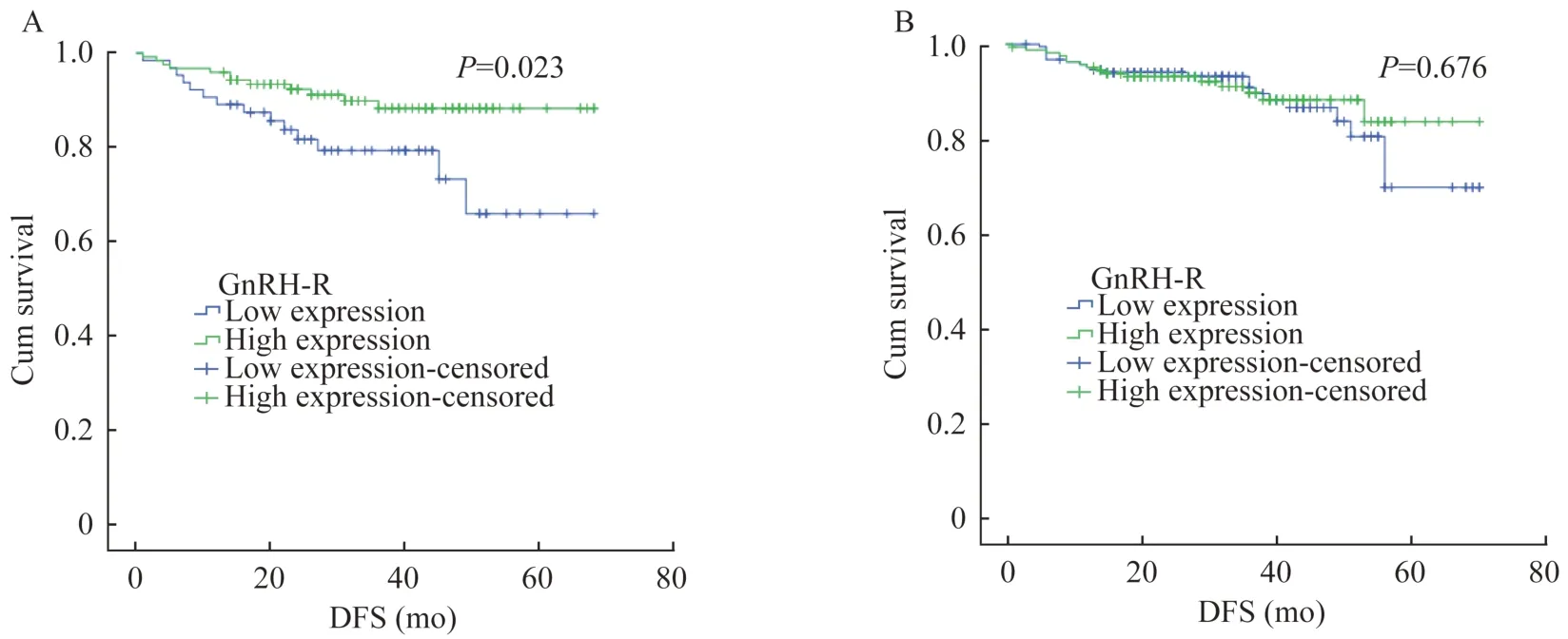
图3 GnRH-R 高表达与低表达乳腺癌患者的亚组无病生存曲线Fig 3 Subgroups Kaplan-Meier curves of DFS between breast cancer patients with GnRH-R high expression and low expression
GnRH-R 在乳腺癌基础研究方面的报道比较有限,主要集中在三阴性乳腺癌(triple negative breast cancer,TNBC)。Buchholz 等[21]通过临床组织样本分析,报道约74% TNBC 表达GnRH-R,从而提示GnRH-R 可能是TNBC 极具潜力的治疗靶点。本文通过大样本研究发现半数以上的乳腺癌组织高表达GnRH-R,显著高于癌旁组织,而且在激素受体阴性的肿瘤中GnRH-R 的表达率更高,这与文献的报道基本一致。Buchholz 等[21]同时通过细胞实验证实GnRHa 可显著抑制表达GnRH-R 的TNBC 细胞增殖,并促使处于细胞周期S 期的肿瘤细胞比例显著下降。Schubert 等[22]在动物实验中发现GnRHa可显著抑制裸鼠TNBC 移植瘤的生长,这种抑制肿瘤生长的作用呈现时间和剂量依赖性效应;而且GnRHa 通过作用于GnRH-R 能够显著抑制动物体内肺和骨转移灶的形成,但对于其中可能的机制未做深入探讨 。 Gründker 等[23]的研究进一步表明GnRHa可显著抑制wnt 通路中的生物标志物如S100A4 及 CYR61 的表达,从而抑制 TNBC 细胞的侵袭性及上皮间质转化。本研究观察到GnRH-R高表达的肿瘤中,腋窝淋巴结肿瘤负荷相对较低、LVI 阳性比例亦较低,提示乳腺癌GnRH-R 高表达的肿瘤细胞侵袭、迁徙能力可能受到抑制,值得进一步开展干预性实验及机制研究。
本文同时观察到,GnRH-R 高表达患者中Ki-67指数相对较高,这一点似乎与上述发现不符。Ki-67反映肿瘤的增殖活性,通常认为,Ki-67 高的肿瘤增殖较快,对于化疗也相对敏感。但是,Ki-67 的判读具有一定的主观性,也缺乏统一的标准。在最新的AJCC 乳腺癌分期中,预后分期纳入了一些生物学指标,如ER、PR、HER2、组织学分级,但没有纳入Ki-67,可能与Ki-67 判定标准不统一以至于预后意义不确切有关。此外,Ki-67 与乳腺癌淋巴结转移并无明确相关性。Thangarajah 等[24]指出,术前 Ki-67指数与淋巴结转移没有显著相关性(P=0.403)。至于GnRH-R 与Ki-67 的相关性,一方面需要进一步积累病例扩大样本量并采用更为客观的判读标准(如人工智能读取方法)加以分类,另一方面,有必要开展相关的基础实验以明确两者之间相关性的机制。
在乳腺癌的临床研究方面,尚缺乏对于肿瘤组织GnRH-R 检测的研究,而且也没有研究探讨GnRHa 的应用与肿瘤组织GnRH-R 表达的相关性。本文中,肿瘤组织GnRH-R 的表达状况对总体人群的预后没有显著影响,尤其是激素受体阳性的病例。这可能是由于激素受体阳性的肿瘤预后相对较好,复发时间通常较晚,而本文的随访时间相对较短,故难以观察到生存期的显著差异。另一方面,对于激素受体阳性的肿瘤,GnRHa 主要是通过竞争性结合腺垂体GnRH-R 发挥药物去势的作用,以加强绝经前中高危患者的内分泌治疗,从而提高生存率。因此,对于这部分肿瘤很难在脱离内分泌治疗的基础上来研究GnRHa 作用于肿瘤细胞GnRH-R 的效应。
对于激素受体阴性的乳腺癌,GnRHa 主要应用于化疗期间卵巢功能保护。在POEMS 临床试验中,应用 GnRHa 的患者 DFS 和 OS 有所改善[4]。韩国的一项回顾性研究也提示新辅助化疗联合GnRHa 较单用新辅助化疗显著提高激素受体阴性乳腺癌的 pCR 率[25]。结合 GnRH-R 在激素受体阴性肿瘤中有着较高的表达率,提示上述研究中体现的GnRHa 抗肿瘤效应可能与肿瘤细胞GnRH-R 的表达有关。本文ER 阴性乳腺癌亚组中,观察到GnRH-R 高表达的患者预后显著改善。尽管这可能与GnRH-R 高表达患者的腋窝淋巴结肿瘤负荷较低有关,但至少提示值得在激素受体阴性乳腺癌中探究GnRH-R 表达的意义以及潜在的抗肿瘤机制。
本文通过大样本的观察性研究,发现激素受体阴性乳腺癌中GnRH-R 高表达的比例较高,而且GnRH-R 高表达的患者预后较好。此外,GnRH-R高表达与患者腋窝淋巴结低肿瘤负荷以及LVI 阴性存在相关性。关于GnRH-R 的上游调控机制、GnRH-R 表达与肿瘤侵袭迁徙性抑制的内在机制、GnRHa 作用与肿瘤细胞GnRH-R 后产生的肿瘤表型改变以及可能涉及的信号通路等,都值得进一步开展实验研究。
