mTOR通路抑制剂雷帕霉素对真菌性角膜炎小鼠角膜瘢痕化的影响△
2020-06-15常鸣贺司宇岳娟刘素素王丽娅
常鸣 贺司宇 岳娟 刘素素 王丽娅
真菌性角膜炎是由真菌感染引起的一种严重致盲性眼病[1];若感染早期未能得到及时有效治疗,该病将导致严重并发症;菌丝向眼内穿透,可导致角膜穿孔、真菌性眼内炎甚至需要摘除眼球。研究表明,真菌性角膜炎患病率已上升到感染性角膜病的首位(51%~70%),而且仍有逐年上升的趋势[2]。
细胞自噬是真核生物普遍存在的一种自稳机制,在胚胎发育、细胞自我保护和生存等过程中发挥重要作用[3]。在应激情况下,细胞启动自噬通路,清除细胞内受损的蛋白质、细胞器或入侵的病原体[4];在此过程中,自噬小体LC-3Ⅱ作为自噬体的一种结构蛋白可附着于自噬体膜上。因此,通过检测LC-3Ⅱ的表达可以反映细胞自噬程度。近年来的研究显示,自噬可以有效抑制组织纤维化,减轻瘢痕化程度;自噬不仅广泛出现在正常的生理过程中,同时还参与多种疾病的病理过程[5-7]。本研究我们探讨mTOR通路抑制剂雷帕霉素对真菌性角膜炎角膜瘢痕化的影响,了解细胞自噬在真菌感染后的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组取96只8~12周龄SPF级C57BL/6J雄性小鼠,体质量为23~27 g,购于南京大学南京生物医药研究院。小鼠的使用和实验方案经河南省眼科研究所生命科学实验室管理和伦理审查委员会批准。将小鼠随机分为雷帕霉素组和对照组,每组各48只。雷帕霉素组模型制作前1 d按6.0 mg·kg-1雷帕霉素对小鼠进行腹腔注射预处理,之后按0.2 g·L-1浓度在结膜下注射 5 μL,持续3 d;对照组注射PBS溶液。根据参考文献[8-9]所描述的方法,两组小鼠同时建立真菌性角膜炎模型。
1.1.2 主要试剂及仪器腐皮镰刀菌(中国通用微生物菌种保藏中心),Anti-LC3B抗体(英国Abcam公司),雷帕霉素(北京索莱宝公司),PAGE凝胶快速制备试剂盒(上海雅酶生物科技有限公司),Total RNA Kit(美国Omega Bio-Tek公司),PrimeScript RT Reagent Kit、TB Green®Premix Ex TaqTMII (日本Tokyo公司),戊巴比妥钠(美国 Sigma公司),盐酸丁卡因滴眼液(日本参天制药有限公司),裂隙灯显微镜(重庆康华瑞明科技有限公司)。
1.2 方法
1.2.1 雷帕霉素注射液制备将雷帕霉素以20 g·L-1的浓度溶于无水乙醇中,储存于-20 ℃冰箱;注射之前,将其用无菌PBS溶液稀释至0.2 g·L-1,加入吐温20促进溶解[10],制好后备用。
1.2.2 造模后小鼠角膜临床评分于造模后24 h、48 h 、72 h、96 h、120 h、144 h、168 h、216 h、336 h在裂隙灯显微镜下观察两组小鼠角膜变化,并行眼前节照相,角膜临床评分参照先前的评分系统[11-12]。
1.2.3 Western blot检测于造模后72 h、144 h、216 h、336 h,每个时间点处死各组小鼠12只,摘取双眼眼球,取角膜,加入 100 μL蛋白酶抑制剂,剪碎角膜,4 ℃ 离心20 min后取上清,测定每个样本角膜内的蛋白浓度。然后按比例添加SDS样品缓冲液煮沸,使用PAGE快速制备试剂盒凝胶后,将总蛋白分离,并转移到PVDF膜上。室温下加脱脂奶在摇床上封闭2 h后,将膜切开并将相应条带分别加入GAPDH多克隆抗体(12000)、Anti-LC3B抗体(11000)、抗α-SMA单克隆抗体(11000),在4 ℃冰箱内孵育过夜后,将PVDF膜在含吐温20的PBS中洗涤,每次10 min,共洗3次,将膜与相应的过氧化物酶偶联的二抗(12000)在室温下孵育2 h。最后,通过化学发光系统观察印迹,并使用Image J软件测量蛋白相对表达量。
1.2.4 实时荧光定量PCR检测造模后72 h、144 h、216 h、336 h取两组小鼠的角膜,检测LC-3Ⅱ mRNA、α-SMA mRNA和 TGF-β1 mRNA水平。处死小鼠,显微镜下修剪角膜后,使用Total RNA Kit提取RNA,使用PrimeScript RT reagent Kit试剂盒,逆转录合成cDNA,并用焦碳酸二乙酯稀释至120。使用实时荧光定量RT-PCR进行扩增检测。管家基因GAPDH作为内部对照。引物序列如下:GAPDH:正向为:5’-GATTACTGCTCTGGCTCCTAGC-3’,反向为5’-GACTCATCGTA-CTCCTGCTTGC-3’;LC-3Ⅱ:正向为5’-GTCACCCAGGCGAGTTACC-3’,反向为5’-CCCTTGTAGCGCTCGATGAT-3’;α-SMA:正向为5’-ATGCTAACAACGTCCTGTCA-3’,反向为5’-AGAGTACTTGCGTTCTGGAG-3’;TGF-β1:正向为5’-CAATTCCTGGCGTTACCTTG-3’,反向为5’-GTTCATGTCATGGATGGTGC-3’。
1.3 统计学方法采用GraphPad Prism 7.0软件进行作图及分析,计量数据表示为均值±标准差。两组角膜病变临床评分不符合正态分布,采用秩和检验。各组Western blot、实时荧光定量PCR检测结果比较采用单因素方差分析。检验水准:α=0.05。
2 结果
2.1 两组小鼠造模后不同时间点角膜临床评分裂隙灯显微镜下两组小鼠造模后不同时间点角膜病变情况见图1;真菌性角膜炎造模后 24 h,两组小鼠角膜中央均出现灰白色浸润灶和不同程度的角膜水肿;雷帕霉素组小鼠角膜病灶范围及浸润程度均小于对照组。造模后96 h,两组小鼠角膜病灶浸润进一步加重,对照组角膜病灶致密,可见新生血管产生,角膜透明度降低,前房产生积脓;而雷帕霉素组未见前房积脓,病灶范围局限。造模后120 h,对照组小鼠角膜水肿减轻,出现后弹力层膨出,雷帕霉素组相较于对照组后弹力层膨出发生率低,病灶范围减小,未见新生血管。两组小鼠造模后不同时间点角膜临床评分结果见表1。造模后24 h、48 h、72 h、96 h、120 h、144 h、336 h,对照组小鼠角膜临床评分均明显高于雷帕霉素组,差异均有统计学意义(均为P<0.05) 。

图1 裂隙灯显微镜下两组小鼠造模后不同时间点角膜病变情况
表1 两组小鼠造模后不同时间点角膜临床评分
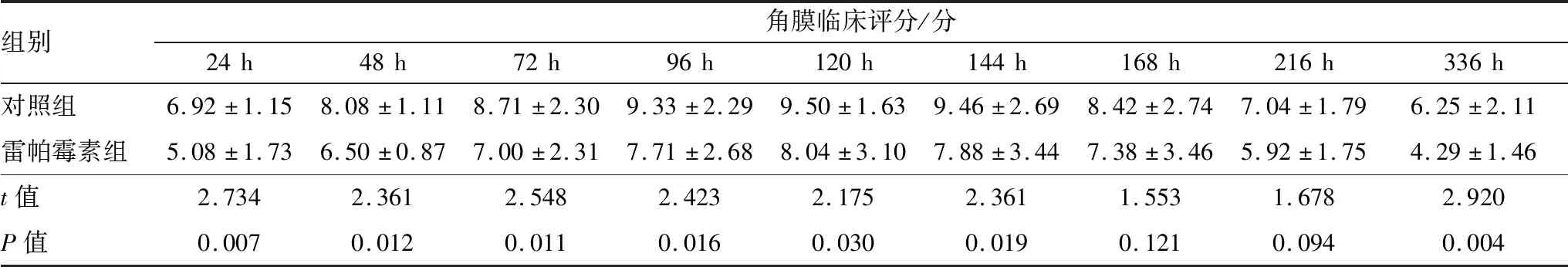
组别角膜临床评分/分24h48h72h96h120h144h168h216h336h对照组6.92±1.158.08±1.118.71±2.309.33±2.299.50±1.639.46±2.698.42±2.747.04±1.796.25±2.11雷帕霉素组5.08±1.736.50±0.877.00±2.317.71±2.688.04±3.107.88±3.447.38±3.465.92±1.754.29±1.46t值2.7342.3612.5482.4232.1752.3611.5531.6782.920P值0.0070.0120.0110.0160.0300.0190.1210.0940.004
2.2 造模后不同时间点两组小鼠角膜LC-3Ⅱ蛋白和mRNA相对表达量Western blot及实时荧光定量PCR检测结果显示:造模后144 h、216 h雷帕霉素组小鼠角膜LC-3Ⅱ表达上调,LC-3Ⅱ蛋白和mRNA相对表达量与对照组相比,差异均有统计学意义(均为P<0.05);而在造模后72 h及336 h两组LC-3Ⅱ蛋白和mRNA相对表达量差异均无统计学意义(均为P>0.05)。见图2、表2和表3。

图2 造模后不同时间点两组小鼠角膜LC-3Ⅱ蛋白表达情况
表2 造模后不同时间点两组小鼠角膜LC-3Ⅱ蛋白相对表达量
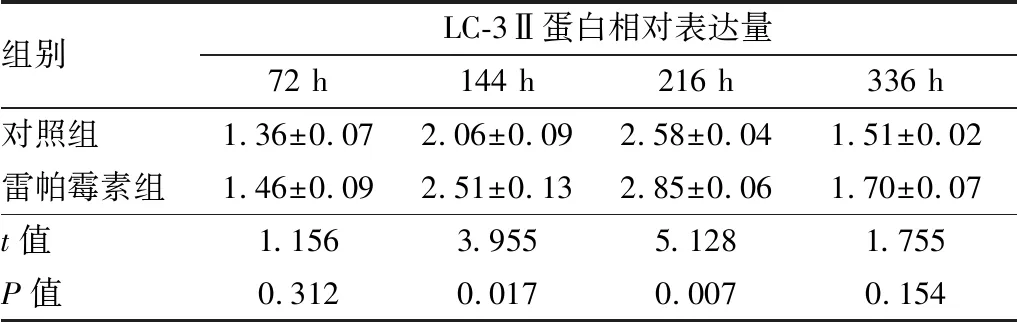
组别LC-3Ⅱ蛋白相对表达量72 h144 h216 h336 h对照组1.36±0.072.06±0.092.58±0.041.51±0.02雷帕霉素组1.46±0.092.51±0.132.85±0.061.70±0.07t值1.1563.9555.1281.755P值0.3120.0170.0070.154
表3 造模后不同时间点两组小鼠角膜LC-3ⅡmRNA相对表达量
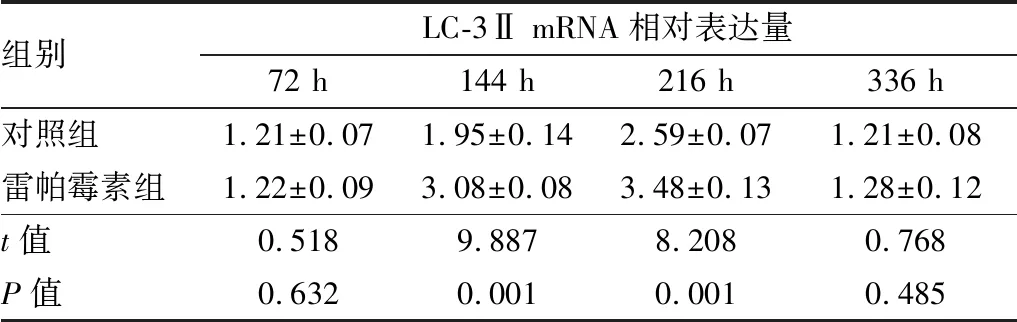
组别LC-3Ⅱ mRNA相对表达量72 h144 h216 h336 h对照组1.21±0.071.95±0.142.59±0.071.21±0.08雷帕霉素组1.22±0.093.08±0.083.48±0.131.28±0.12t值0.5189.8878.2080.768P值0.6320.0010.0010.485
2.3 造模后不同时间点两组小鼠角膜瘢痕化相关因子α-SMA及TGF-β1的表达与对照组相比,造模后144 h、216 h雷帕霉素组小鼠角膜α-SMA蛋白及 mRNA相对表达量下降,差异均有统计学意义(均为P<0.05),见图3、表4和表5。与对照组相比,造模后144 h、336 h雷帕霉素组TGF-β1 mRNA相对表达量亦下降,差异均有统计学意义(均为P<0.05),见表6。

图3 造模后不同时间点两组小鼠角膜α-SMA蛋白表达情况
表4 造模后不同时间点两组小鼠角膜α-SMA蛋白相对表达量
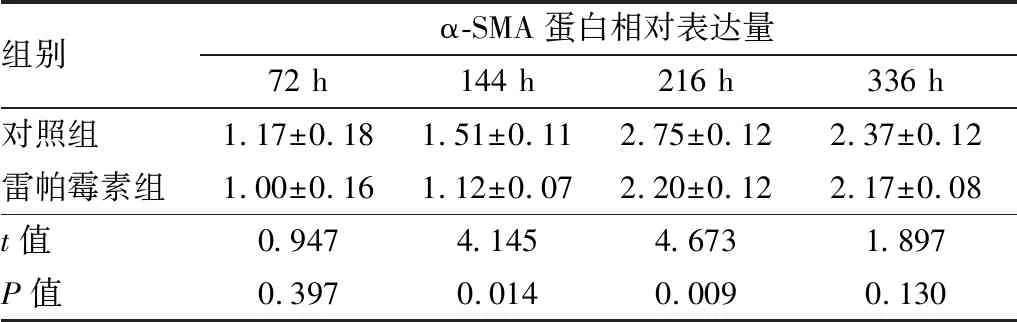
组别α-SMA蛋白相对表达量72 h144 h216 h336 h对照组1.17±0.181.51±0.112.75±0.122.37±0.12雷帕霉素组1.00±0.161.12±0.072.20±0.122.17±0.08t值0.9474.1454.6731.897P值0.3970.0140.0090.130
表5 造模后不同时间点两组小鼠角膜α-SMA mRNA相对表达量
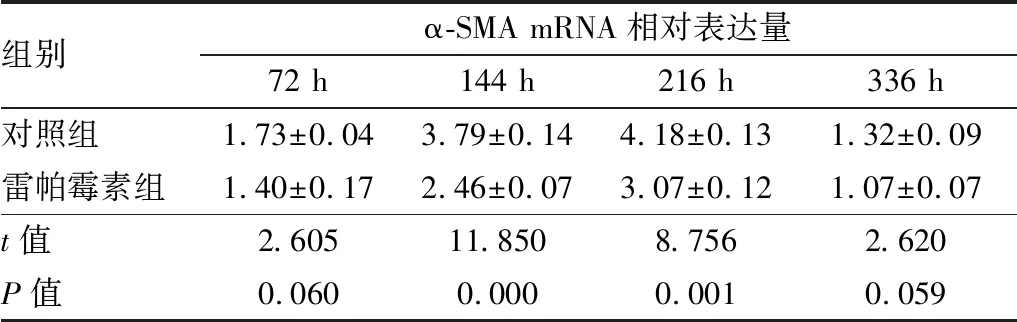
组别α-SMA mRNA相对表达量72 h144 h216 h336 h对照组1.73±0.043.79±0.144.18±0.131.32±0.09雷帕霉素组1.40±0.172.46±0.073.07±0.121.07±0.07t值2.60511.8508.7562.620P值0.0600.0000.0010.059
表6 造模后不同时间点两组小鼠角膜TGF-β1 mRNA相对表达量
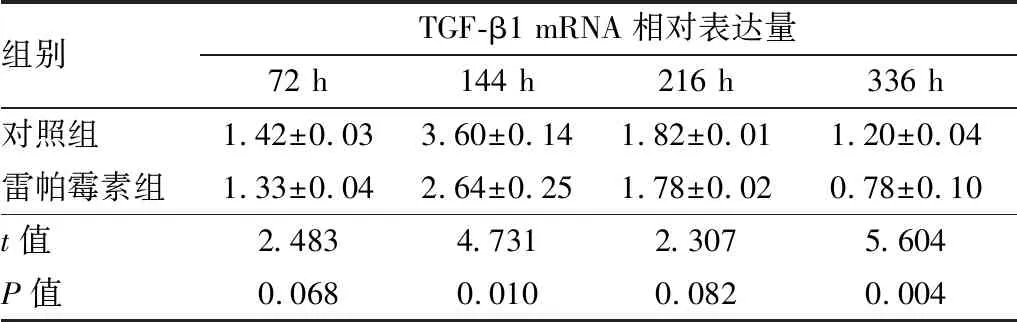
组别TGF-β1 mRNA相对表达量72 h144 h216 h336 h对照组1.42±0.033.60±0.141.82±0.011.20±0.04雷帕霉素组1.33±0.042.64±0.251.78±0.020.78±0.10t值2.4834.7312.3075.604P值0.0680.0100.0820.004
3 讨论
雷帕霉素作为一种mTOR通路抑制剂,可以调节PI3K/AKT/mTOR信号通路,通过抑制mTOR,促进自噬小体的表达,使自噬强度增加[13]。近年来由于激素、抗生素的广泛应用,以及角膜接触镜的普及,使真菌性角膜炎发病率逐年升高。目前的抗真菌药物对真菌性角膜炎的疗效不佳,有时会延误治疗,给患者带来极其严重的后果,可造成角膜溃疡或穿孔,甚至需要摘除眼球[14]。本研究旨在探讨自噬在真菌性角膜炎治疗中的作用,以期为临床用药提供指导。
从本研究结果中我们可以看出,造模后多个时间点雷帕霉素组角膜临床评分明显低于对照组。这表明自噬途径和/或自噬蛋白在抗真菌感染中具有重要作用。研究表明,在小鼠巨噬细胞和嗜中性粒细胞中敲除Atg5会增加单核细胞对李斯特菌感染的敏感性,而敲除神经元特异性Atg5会增加中枢神经系统对Sindbis病毒感染的敏感性[15]。 Chai 等[16]研究发现,在眼部感染时自噬对清除单纯疱疹病毒发挥重要作用。Yakoub等[17]研究发现,诱导细胞自噬可能成为一种新的抗病毒药物的作用点;在HSV感染时,诱导细胞自噬将会抑制感染。总之,自噬通过迅速诱导先天性免疫应答而发挥抗感染作用。
机体自噬作用增强,一方面可以发挥其抗感染能力;另一方面也能降低瘢痕化相关因子的表达。通过对本研究结果分析,我们发现雷帕霉素可以降低角膜瘢痕化相关因子α-SMA蛋白及mRNA、TGF-β1 mRNA的表达,有效减轻两组小鼠角膜临床评分。
总之,本研究结果显示,雷帕霉素通过促进自噬作用下调角膜瘢痕化相关因子的表达,减轻了真菌性角膜炎模型小鼠角膜瘢痕化程度;但其确切分子机制尚不明确,仍有待进一步深入研究。
