腹腔镜辅助下自体肾移植术治疗复杂肾肿瘤
2020-06-15朱凌峰王宽音陈小文谭建明
朱凌峰 王宽音 陈小文 谭建明
肾肿瘤是泌尿外科常见病与多发病。随着医疗水平的进步以及人们对肾肿瘤的认识深入,保留肾单位的肾肿瘤切除术逐渐应用于肾癌患者的早期治疗中并取得较好的临床效果,成为早期肾肿瘤首选手术方式[1-2]。近年来,随着微创技术的发展,腹腔镜与机器人辅助下肾部分切除术可有效提高患者的治疗效果并保证手术的安全性,逐步成为早肾癌患者的主要手术方式。研究证实,腹腔镜下保留肾单位的肾肿瘤切除术不但具有创伤小的特点,还能在最大程度上保留肾单位,提高病人的肾功能储备,呈现出取代开放手术的趋势[3]。泌尿外科医生在临床工作中经常会接触到一些特殊的肾肿瘤病例,如孤立肾肿瘤,伴静脉瘤栓的良性肾肿瘤等,这些病例既具有保留肾单位的绝对适应证,在原位切除肾肿瘤保留肾脏又极其困难。如何为这些特殊病例制定和实施治疗方案给临床医生造成极大压力与挑战。本院在腹腔镜活体供肾切取术和同种异体肾移植基础上,将这一技术应用到治疗复杂肾肿瘤病例中并取得良好疗效。自2018 年5 月起,本院应用此技术成功治愈3 例复杂肾肿瘤患者。现报告如下。
1 一般资料与方法
1.1 一般资料
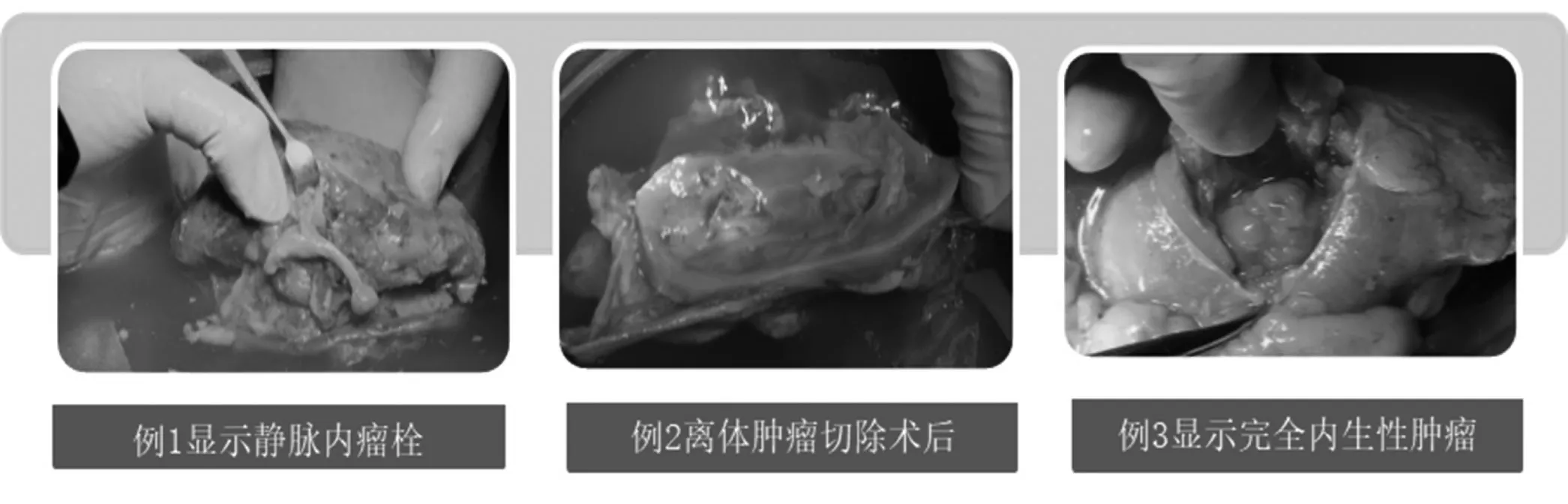
图1 三例患者工作台手术大体图片
病例1:女,52 岁,因“体检发现右肾占位”入院。入院行中腹部CTA 检查发现右肾中部不均质密度占位,含脂肪信号,直径5 cm。右肾静脉与下腔静脉内可见充盈缺损,内可见脂肪信号。诊断为“右肾血管平滑肌脂肪瘤伴下腔静脉II 级瘤栓”,手术采用气管内插管麻醉,患者取健侧卧位腹膜后入路,采用标准三孔法。沿肾周脂肪囊背侧向下腔静脉后方游离,分离并切断右侧第一组腰静脉,将肾动脉向近心端游离至下腔静脉左侧。分离右肾静脉汇入处远近端2 cm 下腔静脉以便阻断。预行右下腹Gibson 切口长约8 cm,切开肌肉全层至后腹腔,布巾钳夹闭切口。入骨盆平面切断输尿管,阻断肾血管前5分钟予速尿20 mg 及20%甘露醇250 mL。Hemo-lock 双重结扎肾动脉后离断,心耳钳阻断下腔静脉,剪开下腔静脉壁,显露瘤栓,连同部分腔静脉壁离断肾静脉。将肾脏从切口中取出后置于生理盐水冰水中降温冷却,以4℃器官保存液灌注动脉。
病例2:男,48 岁,因“左上腹疼痛”入院,入院检查发现左肾中部腹侧巨大实性占位,直径10 cm,腹膜后无明显肿大淋巴结,未发现明显转移,右肾萎缩,右侧肾脏GFR 为 0 mL/min,左侧肾脏GFR 为62 mL/min,诊断为“左功能性孤立肾肾癌”。手术采用气管内插管麻醉,患者取健侧70°卧位经腹腔入路,切开侧腹膜,离断脾结肠韧带,将结肠推向对侧,显露肾静脉后依次离断其三个分支,分离左肾动脉至其根部,完全游离左肾,于骨盆平面离断输尿管。行左下腹Gibson 切口长约12 cm 入腹,阻断肾血管前5分钟予速尿20 mg 及20%甘露醇250 mL。于肾动脉起始部和左肾静脉跨越腹主动脉右侧Hemo-lock 双重结扎血管并切断。将肾脏从切口中取出后置于生理盐水冰水中降温冷却,以4℃器官保存液灌注动脉。清扫腹膜后淋巴结送病理。
病例3:男,40 岁,因“体检发现左肾占位”入院,入院检查发现左肾中部完全内生性实性肿物,直径2.5 cm,右侧肾脏GFR 为 34 mL/min,左侧肾脏GFR 为38 mL/min。腹膜后无明显肿大淋巴结,未发现明显转移,诊断为“左肾癌”。手术采用气管内插管麻醉,患者取健侧卧位经腹膜后入路,离断左肾静脉的腰静脉分支后分离左肾动脉至其根部,显露肾静脉后依次离断生殖静脉与中央静脉,完全游离左肾,于骨盆平面离断输尿管。取左下腹Gibson 切口长约8 cm 进入后腹腔,阻断肾血管前5分钟予速尿20 mg 及20%甘露醇250 mL。于肾动脉起始部和左肾静脉跨越腹主动脉处Hemo-lock 双重结扎血管并切断。将肾脏从切口中取出后置于生理盐水冰水中降温冷却,以4℃器官保存液灌注动脉。
1.2 工作台手术
离体切除肿瘤,修整肾脏以备移植。于4℃器官保存液中翻转病例1患者肾静脉,可见瘤栓静脉内膜,小心剃除瘤栓,剜除瘤体送术中冰冻病理。5-0 血管缝线修补血管,2-0 倒刺线双层法连续缝合肾脏创面。术中病理为血管平滑肌脂肪瘤。病例2 患者紧贴肿瘤包膜切除肿瘤,见肿瘤包膜完整。将肿瘤与腹膜后淋巴结送术中病理。3-0 可吸收线8 字缝合肾创面血管断端,术中病理示腹膜后淋巴结阴性。病例3 患者在超声引导下确定肿瘤位置,于最浅表位置纵行切开肾实质至肿瘤表面,沿包膜外剜除肿瘤,3-0 可吸收线8 字缝合血管断端,2-0 倒刺线连续缝合肾创面。4℃UW 再次灌注肾脏,明确修补后的肾脏创面无明显渗漏后将其冷藏待用。见图1。
1.3 自体肾移植
患者改平卧位,向下延长取肾切口,游离髂外静脉与髂内动脉,5-0 血管缝合线将肾静脉与髂外静脉端侧吻合,6-0 血管缝合线肾动脉与髂内动脉端端吻合,开放血管后可见肾脏血流灌注良好,即刻开始泌尿。黏膜下隧道法吻合输尿管膀胱,输尿管内留置F 5 双J 管。见图2。

图2 自体肾移植术中大体图片
1.4 术后管理
术后第一天开始给予低分子肝素抗凝,常规给予营养支持与预防性抗感染、改善微循环及肺部下肢康复运动治疗,术后第2天常规床边彩超检查评估移植肾血流灌注情况,术后第4 天下床活动。监测尿量及血常规生化指标,保持内环境稳定。术后4 周拔除双J 管。
2 结果
3 例手术均获成功,手术情况见表1。病例1 患者静脉瘤栓起源于右肾静脉内膜,瘤栓蒂部纤细,距静脉开口约1.5 cm。袖套状翻转静脉后将瘤栓完整切除。孤立肾癌肿瘤包膜完整,界限清晰,肿瘤无肾周脂肪无粘连,未累及肾上腺,腹膜后淋巴结阴性,病理为透明细胞癌,Fuhrman 评分II 级。内生性肾肿瘤患者肿瘤包膜完整,术后病理为透明细胞癌,Fuhrman 评分II 级。三例患者,热缺血时间均少于1 min,冷缺血时间少于2 h,术中出血量少,血管开放后肾脏血流灌注好,缝合创面无明显出血,输尿管立即开始泌尿。患者围手术期无明显出血、漏尿、切口不愈合等严重并发症。随访期间彩超复查移植肾脏血流灌注良好,无血管吻合口狭窄及肾积水等并发症。术后3 个月复查GFR 提示患者功能良好。功能性孤立肾癌患者术后血清肌酐最高升至240μmol/L,出院前降至135 μmol/L,给予长期口服肠溶阿司匹林100 mg/天,目前血肌酐稳定于120μmol/L 左右。
3 讨论
肾肿瘤是泌尿系统中的常见肿瘤,在我国的发病率呈逐年上升趋势。我们在临床诊疗过程中发现需要采用保留肾单位手术的肾肿瘤患者也不断增多。对于瘤体直径<4cm 的T1a 期肾肿瘤,保留肾单位手术已成为标准治疗方式[4-5],而且随着手术技术的成熟和研究不断深入,关于切缘问题近年来逐渐倾向认为只要切除干净,切缘的多少与疾病的进展没有相关性[6-7],因此适应证逐渐扩大如T1b 期肾肿瘤或完全内生型肾肿瘤[8]。对于复杂性肾肿瘤需保留肾单位的患者如功能性孤立肾肿瘤、完全内生型肾肿瘤,多发性肾肿瘤患者,缩短术中肾脏热缺血时间,是保护肾功能最关键的因素[9]。目前所采用的保留肾单位手术方式,即在原位阻断肾动脉(或动静脉),在肾脏热缺血状态下快速切除肿瘤、止血,修补肾脏后重新恢复肾脏血流灌注。虽然随着技术进步、手术器械和新型材料的不断更新使手术操作简化,但存在不足:(1)肾脏热缺血时间延长,从而导致肾脏功能受损加重。(2)肿瘤切缘因创面出血而视野不清,或因手术时间仓促而导致切缘阳性率增高或切除过多正常肾组织。(3)复杂病例术后继发性出血、漏尿等手术并发症增高。(4)对于合并有肾静脉或下腔静脉瘤栓的病例若在原位取栓,有可能导致瘤栓脱落或瘤栓无法取尽而导致肺栓塞等严重手术后果。目前为止对于合并下腔静脉瘤栓的肾血管平滑肌脂肪瘤病例尚未有成功保肾的报道。
1963 年Hardy[10]报道自体肾移植术应用于长段输尿管狭窄患者,逐步应用于肾血管疾病如肾动脉狭窄、复杂肾肿瘤的保留肾单位治疗领域中。随着腹腔镜技术的与发展,腹腔镜辅助下供肾切除术由于其创伤小、恢复快、术野显露清晰等优势逐渐取代开放手术而成为主流。工作台手术切除肾肿瘤的优势在于(1)热缺血时间短,有效保护肾功能。本组三例患者热缺血时间均少于1分钟,最少低至20 秒,肾脏取出后立即进行低温灌注,降低肾脏中心温度对于肾功能的保护起到关键作用,明显减少的肾功能损失。(2)降低肿瘤切缘阳性率,可保留更多正常肾组织。在冷缺血情况下肾脏组织耐受缺血时间明显延长,因此可以在视野更清晰,时间更充裕的情况下沿肿瘤包膜外剜除肿瘤[11]。有助于发现并清除肿瘤周围的卫星灶并且避免切除过多的正常肾组织。(3)仔细修复肾脏,减少术后并发症。工作台手术中使用小针细线仔细缝合肾血管及血管断端,缝合集合系统,仔细缝合对合创面。修复完成后再次试灌注验证是否存在出血点。本组3 例患者肾脏修复难度很大,经过细致的缝合修复后均达到良好的止血效果,所有患者术后第一天都开始应用低分子肝素抗凝治疗。(4)切除的肿瘤送术中快速冰冻病理明确诊断后再决定是否回植。(5)肾脏切除离体后可以同时行腹膜后淋巴清扫以明确肿瘤分期并提高治疗效果。

表1 患者围手术期与随访基本资料
本院自1979 年开展肾移植手术,至今总移植例数超过3000 例,腹腔镜下供肾切除术也有十余年的经验,在肾移植与腹腔镜手术领域中积累丰富的经验[12]。我们认为在实施此类手术时应注意(1)因为移植肾种植位置通常位于同侧髂窝,因此需保留更长的肾血管。我们的经验是右肾切除时宜采用经腹膜后入路,切断肾动脉下方第一组腰静脉,可延长右肾动脉长度近1 cm,充分显露下腔静脉,带部分下腔静脉瓣切断肾静脉,并切除5 cm 左右生殖静脉用于静脉延长术。(2)左肾切除宜采用经腹入路,将结肠与空肠起始段向对侧分离充分显露左肾静脉,离断左肾静脉的三个分支以保留充分长的肾静脉。(3)取肾切口采用同侧下腹Gibson 切口,适当延长该切口便可进行肾移植手术,因此可能通过单切口完成取肾与自体肾移植手术,可减少手术创伤,利于患者尽早康复。
虽然采用腹腔镜辅助技术使治疗更加微创化,但该术式仍存在操作复杂、手术时间长等局限性。近年来国内外学者完全体腔内自体肾移植技术作了初步尝试[13],而机器人手术的发展突破了腔镜下血管缝合技术瓶颈。有理由相信如果体内肾脏灌洗及肾低温保存技术完善后,完全体内自体肾移植术将得以推广,机器人辅助下全体腔内自体肾移植可能是未来技术方向[14]。
总之,腹腔镜辅助下自体肾移植术治疗复杂肾肿瘤安全、有效,在成熟的技术保证前提下,可以最大限度的保留肾脏功能,避免丢失肾脏,从而提高患者生活质量。腹腔镜辅助肾切除、体外切除肿瘤后自体肾移植术在复杂肾肿瘤的治疗中具有广阔的应用前景。
