水热辅助溶胶-凝胶法制备纳米钛酸锌及其光催化性能
2020-06-15李俊生徐美艳关天宇夏至姜黎明谭冲左金龙
李俊生,徐美艳,关天宇,夏至,姜黎明,谭冲,左金龙
(哈尔滨商业大学 a.食品工程学院;b.药物工程技术研究中心,哈尔滨 150076)
罗丹明B染料是应用最多的染料之一。合成染料广泛应用于纺织、食品加工、印染制造业等先进技术领域[1]。印染废水产量大、色度高、难处理[2]。这种高度着色废水对植物的光合作用、水生生物、海洋生物以及人类都有毒性作用[3-4]。光催化技术利用光能进行物质转化,是光催化剂表面的光驱动化学过程,可以从水中产生氢气,将太阳能转化为电能,降解有机污染物,并将CO2还原成有机燃料[5]。太阳能是可持续的清洁能源,因此,光催化技术是解决环境污染和能源短缺的绿色技术之一。钛酸锌由于其在微波介质[6]、陶瓷[7]、光催化[8]、光致发光材料[9]、太阳能反射颜料[10]等方面具有潜在应用,近年来受到广泛关注[11]。中国钛资源含量丰富,为世界之首,这为研究钛酸盐光催化剂提供了有利条件[12]。钛酸锌体系共有3种结构,分别为正钛酸锌(Zn2TiO4)、六方偏钛酸锌(ZnTiO3)以及立方偏钛酸锌(Zn2Ti3O8)[13]。其中,ZnTiO3由于其良好的光催化性能,被认为是最有效的环境应用光催化剂之一[14]。笔者采用水热辅助的溶胶-凝胶法制备纳米ZnTiO3粉体,对其进行表征,运用动力学模型分析RhB初始浓度对降解效果的影响,并通过自由基捕获实验分析ZnTiO3降解机理。
1 材料与方法
1.1 试验材料
试验仪器:电子天平、台式高速离心机、电热鼓风干燥箱、紫外线杀菌消毒灯、箱式电阻炉、磁力搅拌器、pH计、扫描电子显微镜、X-射线衍射仪、X-射线光电子能谱仪、紫外可见分光光度计。
试验试剂:罗丹明B、柠檬酸、二水合乙酸锌、无水乙醇、钛酸丁酯、十六烷基三甲基溴化铵、硝酸、盐酸、异丙醇、乙二胺四乙酸二钠、对苯醌。
采用水热辅助的溶胶-凝胶法制备纳米ZnTiO3。首先,将3.704 4 g柠檬酸溶于20 mL无水乙醇中,将0.6 g CTAB加入到上述溶液中,磁力搅拌至表面活性剂完全溶解。在搅拌条件下缓慢加入3 mL钛酸四丁酯,得到溶液A。将1.934 7 g二水合乙酸锌溶于10 mL无水乙醇中,称为溶液B。在持续磁力搅拌中,将溶液B用分液漏斗滴加到溶液A中,控制滴入速率为5 s/滴,控制搅拌速率保证溶液不产生气泡,不飞溅液滴。约1 h后滴液完成,用HNO3调至溶液pH值为3,混合溶液继续搅拌3 h,得到透明凝胶。将凝胶转移至高压反应釜中,100 ℃下老化12 h。将得到的白色固体用去离子水洗涤干净,350 ℃下煅烧2 h后进行研磨,研磨后在一定温度下煅烧一定时间,得到纳米ZnTiO3粉体。
1.2 催化剂的表征与试验方法
通过Supra55型扫描电子显微镜(SEM)观察样品的形貌,EHT=15 kV。测试前将样品充分烘干,通过D8 ADVANCE型X-射线衍射仪表征样品晶型。广角衍射扫描2θ为3°~140°;小角衍射扫描2θ为0.6°~8°;扫描范围为20°~80°。通过ESCALAB 250型X-射线光电子能谱仪表征样品元素组成和价态信息。Alka射线1 486.6 eV,真空度优于5×10-10mbar。
以RhB为目标污染物,检测催化剂的光催化活性。在石英烧杯中加入100 mL一定浓度、pH值为3的RhB溶液和一定量的催化剂,在磁力搅拌条件下先避光反应30 min,达到吸附-解吸平衡,测量其吸光度值。然后,打开紫外灯光源(30 W),光源距离污染物15 cm,进行光催化降解试验,每隔30 min取8 mL悬浊液,以10 000 r/min的速率离心分离5 min,取上清液用紫外-可见分光光度计在554 nm处测定其吸光度值。
RhB溶液的降解率η可由式(1)计算。
η=[(A0-A)/A0]×100%
(1)
式中:A0为RhB的初始吸光度值;A为光照后RhB的吸光度值。
2 结果与讨论
2.1 催化剂的表征结果
2.1.1 SEM表征分析 图1为150倍下ZnTiO3的SEM图像。由图1可以看出,ZnTiO3为颗粒状,形貌为类似球形,有轻微团聚现象。ZnTiO3粒径分布均匀,为50 nm左右。纳米颗粒由于其具有表面势能而具有团聚效应,模板剂CTAB的加入降低了其团聚效应,使催化剂颗粒分散性更好[15]。
2.1.2 XRD表征分析 通过XRD分析ZnTiO3的晶相结构,ZnTiO3样品的XRD图谱如图2所示。

图1 ZnTiO3的SEM谱图Fig.1 SEM images of ZnTiO3

图2 ZnTiO3的X射线衍射图Fig.2 XRD spectrum of ZnTiO3
由图2可知,钛锌比1∶1的样品的衍射峰对应的衍射角为23.9°、32.8°、35.3°、40.5°、49.0°、53.5°、56.9°、61.8°、63.4°,与六方相ZnTiO3(标准卡PDF 26-1500)的晶面衍射强度一致,且衍射峰峰形尖锐,结晶度高,相应缺陷密度较低,载流子复合率低,有利于光催化活性的提高[16]。且钛锌比为1∶1的ZnTiO3样品没有杂峰,而锌源和钛源过多或过少都含有杂质,表明所得的钛锌比为1∶1的样品比较纯,为六方相ZnTiO3。
由Scherrer公式(2)计算颗粒平均粒径。
(2)
式中:D为粒径,nm;K为常数,取0.89;γ为入射波长,取0.154 nm;B为衍射峰半高宽;θ为衍射角。
根据Scherrer公式计算样品粒径为54.22 nm。与SEM结果50 nm左右相吻合。
2.1.3 XPS表征分析 通过XPS分析所制备ZnTiO3的元素及其价态信息。ZnTiO3样品的全谱图及Zn2p、Ti2p、O1s的高分辨谱图如图3所示。
由图3(a)可知,出现了Zn2p峰、O1s峰、Ti2p峰、C1s峰。其中,C1s峰的出现可能是由于检测或催化剂吸附所致,因此,ZnTiO3光催化剂中存在Zn、O、Ti三种元素。在图3(b)中,出现了两个对称程度较好的峰,其结合能为1 020.4、1 043.7 eV,分别对应 Zn2p3/2、Zn2p1/2电子,两个特征峰之间相差23.3 eV,说明样品中Zn以Zn2+形式存在。在图3(c)中,出现了两个独立的特征峰,其结合能为458.0、463.9 eV,分别对应于Ti2p3/2、Ti2p1/2电子,两个特征峰之间结合能相差 5.9 eV,说明样品中Ti以Ti4+形式存在。在图3(d)中,对O1s特征峰进行分峰拟合,表明O1s特征峰是由Ti-O(529.5 eV)、Zn-O(531.2 eV)、H-O(532.7 eV)组成,分别对应于ZnTiO3晶格的晶格氧、化学吸附氧和空位氧。ZnTiO3晶格中有化学吸附氧说明ZnTiO3表面有羟基基团,化学吸附氧和空位氧可以捕获电子和空穴,有利于抑制电子-空穴的复合,从而提高催化活性。

图3 ZnTiO3XPS谱图Fig.3 XPS spectra of ZnTiO3
2.1.4 UV-Vis DRS图谱分析 通过UV-Vis DRS计算所制备样品的禁带宽度。ZnTiO3样品的UV-Vis DRS光谱图及光学带隙图如图4所示。

图4 ZnTiO3的UV-Vis DRS光谱图及光学带隙图Fig.4 UV-Vis DRS spectra and Estimated band gap of ZnTiO3
由图4可知,钛酸锌材料的吸收峰仅限于紫外光波段,在约420 nm处具有吸收边缘,表明其仅有紫外光驱动的光催化活性。
ZnTiO3样品带隙的计算公式为
(αhv)1/n=A(hv-Eg)
(3)
式中:α为吸光指数;h为普朗克常数;ν为频率;A为常数;Eg为半导体禁带宽度。
由于ZnTiO3为直接带隙半导体,所以n=1/2。分别以hv、(αhv)2为横、纵坐标画图,外推线的截距就是带隙Eg。由图4可知,ZnTiO3的禁带宽度为3.55 eV。
2.2 光催化活性及动力学研究
2.2.1 动力学分析 RhB光催化反应过程可用Langmuir-Hinshelwood动力学方程来表示。Langmuir-Hinshelwood动力学方程的准一级反应动力学方程为
-ln(C/C0) =kt
(4)
式中:C为t时刻目标溶液浓度,mg/L;C0为目标溶液初始浓度,mg/L;k为光催化反应速率常数,min-1;t为反应时间,min。
主要考察RhB初始浓度对k值的影响,k值与影响因素之间的关系可表示为
k=f(C0)=αC0α
(5)
式中:k为速率常数,min-1;α为常数;C0为RhB初始浓度,mg/L。
配置初始质量浓度分别为5、10、15、20和25 mg/L的RhB溶液100 mL,在pH为3的条件下,使用1 g/L的ZnTiO3粉体在相同的条件下进行光催化反应150 min,研究RhB溶液初始浓度对ZnTiO3光催化反应的影响,降解率随溶液初始浓度的变化曲线如图5所示。
由图5可知,RhB的初始浓度对ZnTiO3光催化反应有很大影响。RhB的降解率随溶液初始浓度的增大而减小。对于有色溶液,溶液浓度逐渐增大,溶液颜色越来越深,透光率越来越低,对紫外光的吸收和折射越来越强,到达催化剂表面起光催化作用的光子数量越来越少,不利于催化剂吸收光子能量,且RhB初始浓度浓度越高,催化剂的活性位点相对越少[17],导致光催化效果降低。
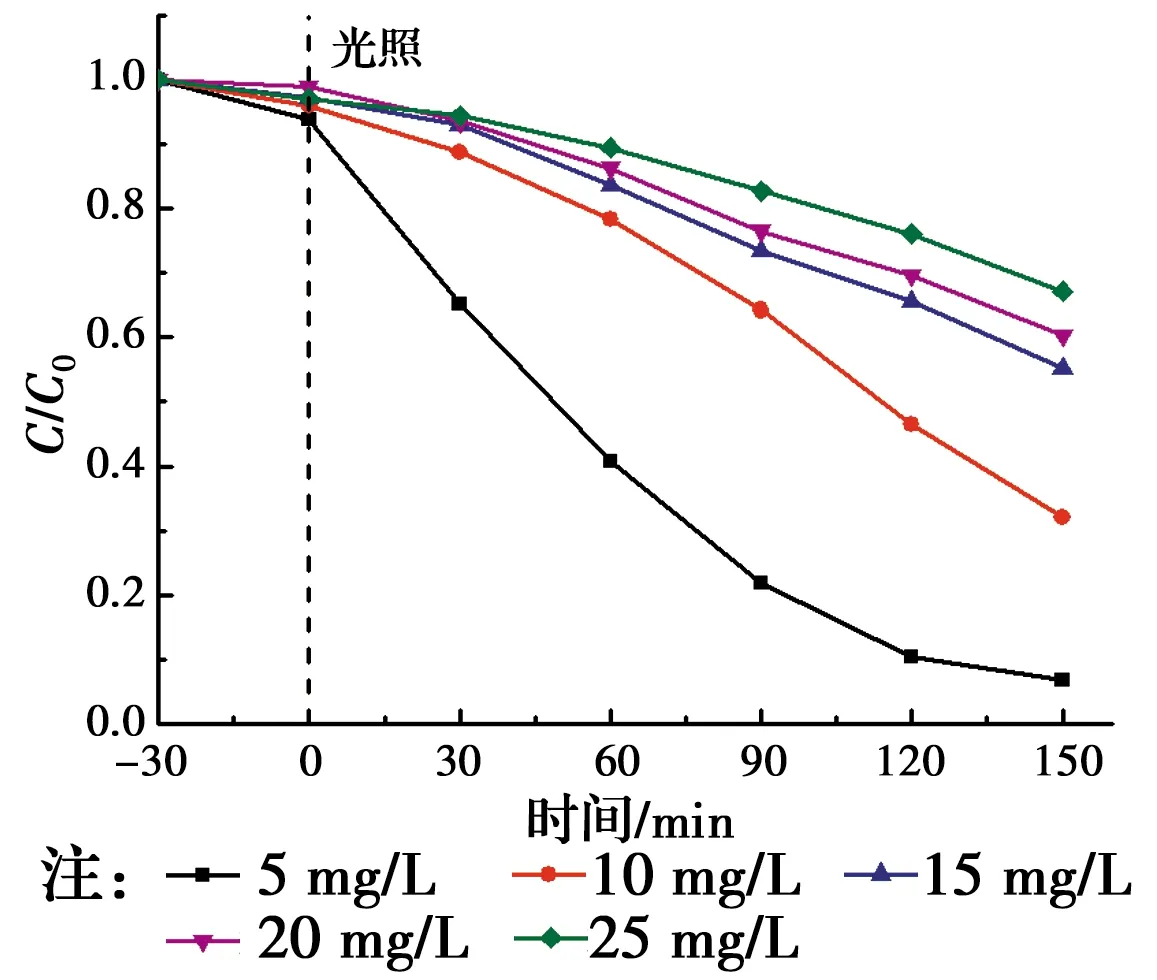
图5 降解率随RhB溶液初始浓度的变化曲线Fig.5 Variation of decolorization rate of RhB solution with initial dye concentration
由图6可知,k随RhB初始浓度的增加而减小,其原因是反应过程中ZnTiO3产生强氧化性的·OH和h+,将吸附至催化剂表面的RhB分子矿化,实现降解。在其他条件不变的情况下,催化剂产生的·OH是一定的,溶液初始浓度增大会降低RhB分子与·OH的接触率,导致速率常数降低。
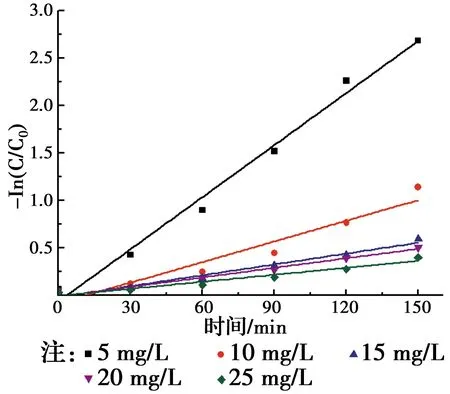
图6 RhB初始浓度对RhB光催化降解速率的影响Fig.6 Effect of RhB initial concentration on degradation kinetics
不同浓度下的-ln(C/C0)与反应时间之间基本呈线性关系,其降解过程复合准一级动力学方程。不同RhB初始浓度条件下,k与R2数据如表1所示。假设RhB初始浓度C0与k之间符合式(6)所示关系式。
k=k1C0β
(6)
式中:k1和β均为常数。

表1 RhB初始浓度对RhB光催化降解动力学参数的影响Table 1 Effect of RhB initial concentration on degradation kinetics
根据表1中C0和k的数据进行趋势拟合,如图7所示,k与C0之间的关系为
k= 0.132C0-1.253
(7)

图7 RhB初始浓度与速率常数的关系曲线图Fig.7 Relationship between initial RhB concentration and rate constant
因此,ZnTiO3光催化降解RhB的动力学方程可表示为
-ln(C/C0)=0.132C0-1.253t
(8)
为检验式(8)的正确性,在最佳降解条件下进行验证。在RhB初始pH值为3、初始浓度为5 mg/L、ZnTiO3投加量为1 g/L的条件下,将试验值与理论计算值进行比较,结果如图8所示。

图8 在确定试验条件下实验值与计算值的比较Fig.8 A comparison of the theoretical data with the experimental data
由图8可知,ZnTiO3光催化降解RhB理论值与实验值较为接近,说明得出的准一级动力学模型对ZnTiO3对RhB的光催化降解过程有较好的拟合性和预测性。
2.2.2 光催化降解罗丹明B正交试验结果 在ZnTiO3最优制备条件下,以RhB溶液pH值、RhB初始浓度、ZnTiO3投加量为考察因素,以正交实验探究罗丹明B最佳降解条件。因素水平表如表2所示。

表2 罗丹明B降解条件优化因素水平表Table 2 Orthogonal factor level table of photocatalytic degradation of Rhodamine B with ZnTiO3
使用正交设计助手2 v3.1软件安排试验和处理结果,如表3所示。

表3 ZnTiO3粉体光催化降解罗丹明B正交试验安排*Table 3 Orthogonal design arrangement of photocatalytic degradation of Rhodamine B with ZnTiO3*
注:*平均试验次数为3次
由表3可知,溶液pH值为5、罗丹明B初始浓度为5 mg/L、催化剂投加量为0.2 g时,罗丹明B降解率达92.66%。此外,由极差大小可知各因素对罗丹明B降解率的影响程度为B>C>A,即罗丹明B初始浓度对降解率的影响较大。
按优选的制备条件制备3组钛酸锌样品,在同样条件下进行光催化试验。最终罗丹明B降解率为94.78%,RDS为1.43%,表明优选的钛酸锌制备条件稳定可行。
2.3 光催化机制的研究
在光催化氧化反应过程中,有三大活性物种,分别为空穴(h+)、超氧自由基(·O2-)和羟基自由基(·OH)[18]。为了探究哪种活性物质在ZnTiO3光催化反应中起作用,以Na2EDTA、C6H4O2、(CH3)2CHOH分别作为h+、·O2-、·OH的捕获剂。试验结果如图9所示。
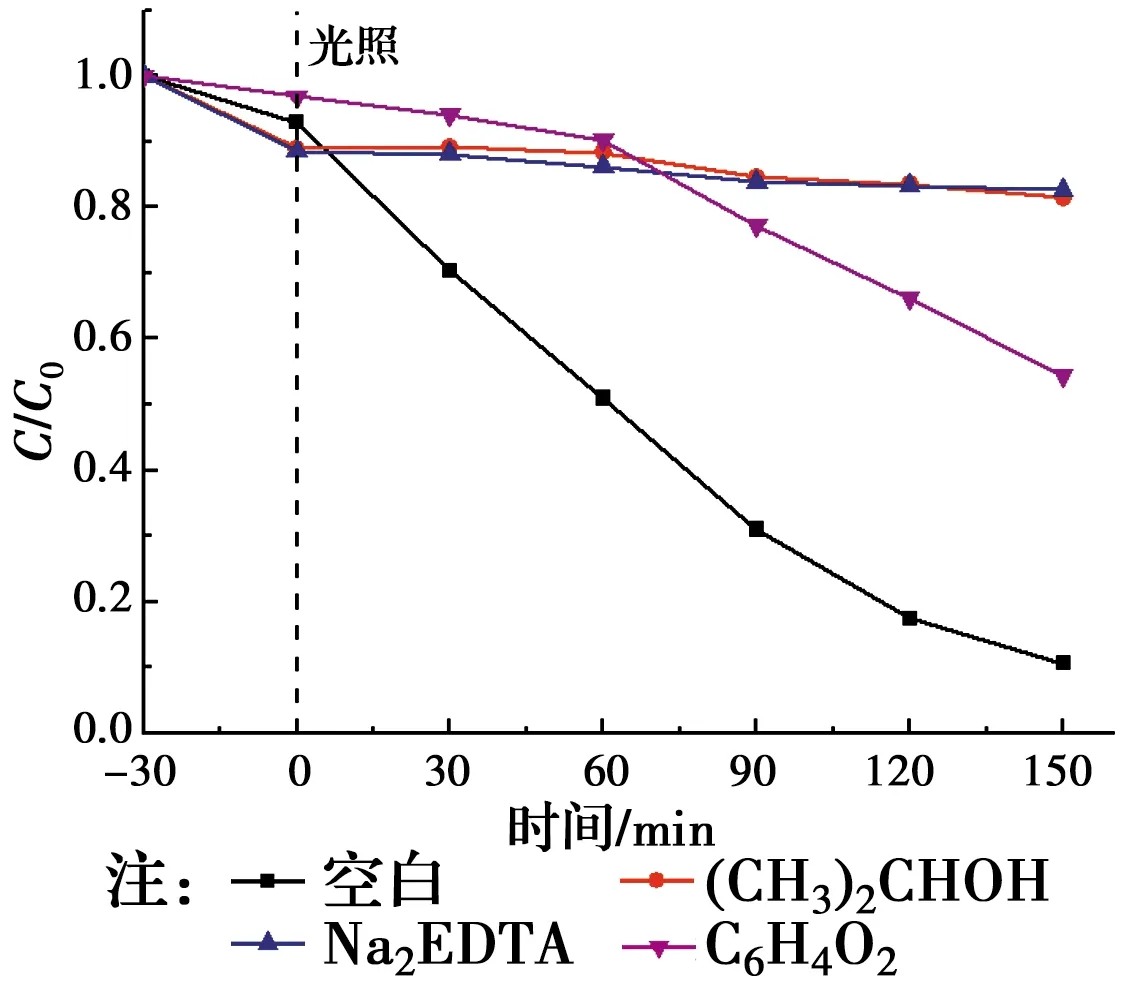
图9 自由基捕获剂对RhB降解效率的影响Fig.9 Effect of the scavengers on the degradation rate of RhB
由图9可知,没有向反应溶液中加入捕获剂时,反应150 min后,RhB的降解率为89.3%。在反应溶液中加入·OH捕获剂异丙醇后,RhB降解率为18.5%。加入h+捕获剂乙二胺四乙酸二钠后,RhB降解率为17.2%。在反应溶液中加入·O2-捕获剂对苯醌后,RhB降解率为45.6%。由图10可以看出,异丙醇、乙二胺四乙酸二钠、对苯醌掩蔽的降解率分别为79.3%、80.7%、48.9%。说明ZnTiO3光催化剂在催化反应过程中·OH、h+、·O2-在反应过程中都起作用,且·OH、h+的产生的量相近,比·O2-量多,·OH、h+在催化反应中起主要作用。
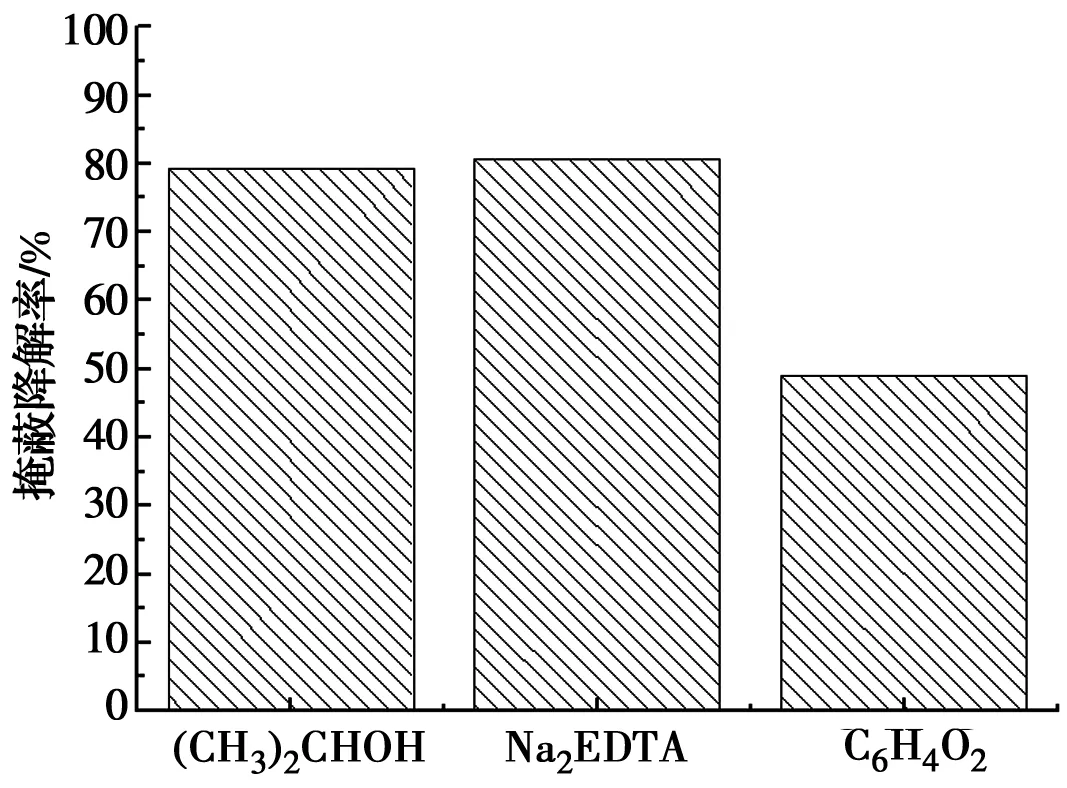
图10 自由基降解掩蔽率Fig.10 Free radical degradation masking rate
ZnTiO3对RhB降解的可能机制可以用Butler和Ginley模型计算的ZnTiO3的价带(VB)和导带(CB)能量来解释[19]。
EVB=χ-Ee+0.5Eg
(9)
ECB=EVB-Eg
(10)
式中:χ为半导体的绝对电负性;Ee为氢标度上的自由电子能量,4.5 eV;Eg为半导体的带隙能量。
由公式计算可得,ZnTiO3的CB为-0.475 eV,VB为3.075 eV。在紫外光照射下,当光照强度大于或等于ZnTiO3带隙(3.55 eV)时,电子-空穴发生分离,电子跃迁到CB,ZnTiO3的CB电位达到了O2/·O2-(-0.33 eV)的氧化电位,电子与水中溶解氧反应生成·O2-,ZnTiO3的VB电位比-OH/·OH(+2.38 eV)和H2O/·OH(+2.72 eV)的还原电位更高,因此,价带中的空穴会与OH-和H2O反应产生·OH。强氧化性的·OH和·O2-能将吸附至催化剂表面的罗丹明B分子直接矿化并完全降解染料。由于ZnTiO3的VB与-OH/·OH(+2.38 eV)和H2O/·OH(+ 2.72 eV)的还原电位的电势差大于ZnTiO3的CB与O2/·O2-(-0.33 eV)的氧化电位之间的电势差,因此,·OH、h+的产生量高于·O2-的产生量,与自由基清除实验显示的结果相符。其光催化反应机理图如图11所示。

图11 光催化机理图Fig.11 Photocatalytic mechanism diagram
3 结论
采用水热辅助的溶胶-凝胶法,以CTAB为模板剂合成纳米ZnTiO3,结论如下:
1)ZnTiO3样品为纯六方相,形貌为类球形,粒径50 nm左右。带隙为3.55 eV。ZnTiO3晶格中的化学吸附氧和空位氧可以捕获电子和空穴,有利于抑制电子-空穴的复合,从而提高催化活性。
2)当催化剂用量为1 g/L、RhB初始浓度为5 mg/L、pH值为3时,光催化降解RhB效果最好,反应150 min后,RhB降解率为93.2%。
3)ZnTiO3光催化剂在降解RhB过程是由·OH、h+、·O2-共同作用而产生的,·OH、h+的产生量高于·O2-的产生量,说明·OH、h+在催化反应中起主要作用。
