马来酸酐-丙烯酰胺非硅稳定剂的制备及应用
2020-06-15孙健鹏徐耀威
王 建, 孙健鹏, 刘 敏, 徐耀威
(陕西科技大学 轻工科学与工程学院 轻化工程国家级实验教学示范中心 陕西省造纸技术及特种纸品开发重点实验室, 陕西 西安 710021)
0 引言
随着漂白过程的污染控制要求不断提高,绿色化的H2O2漂白得到蓬勃发展[1].为了防止高温和重金属离子对H2O2的无效分解,硅酸钠常常被作为H2O2漂白过程中的缓冲剂和稳定剂.实践证实,H2O2漂白过程中,适量的硅酸钠能够显著提高漂白效率,增加漂后浆白度[2].然而,连续化的生产实践显示,H2O2漂白过程中,特别是在高温下Na2SiO3会与钙、镁等离子生成不溶性的硅酸盐,在设备上沉积出坚硬的硅垢进而导致管道堵塞、设备效率降低等问题[3,4],显著影响了H2O2漂白生产的正常进行.
为了防止H2O2漂白过程Na2SiO3的使用所带来的结垢问题,国内外学者在非硅H2O2稳定剂方面进行了大量的研究.Dasom等[5]对49种可能的化合物进行筛选试验,旨在寻找合适的化合物来稳定过氧化氢,结果发现anilino乙醇对过氧化氢的稳定性起到了至关重要的作用,且在环境上不会造成大面积磷污染,成为首要的研究目标.Alexander等[6]研究了芳基烷基酮稳定过氧化氢的稳定机理,并进一步对该稳定剂是否可以量产进行评估.徐长绘[7]研究了非硅型纳米双氧水稳定剂以及不同温度下该稳定剂对Ca2+、Mg2+金属离子的吸附效果及其阻垢性,并测定在不同碱用量、过氧化氢用量、温度、时间等条件下漂后棉织物的白度、断裂强度、毛效及失重率等指标,分析漂白效果,确定该稳定剂抑制过氧化氢分解的效果.
国内外研究学者对非硅稳定剂进行的大量研究已经推动了过氧化氢非硅稳定剂的发展.然而,这些研究大都处于实验室研究,尚未广泛应用,因此研发多功能高效非硅稳定剂一直是过氧化氢相关研究的热点.为了推动过氧化氢非硅稳定剂的发展,本研究以马来酸酐和丙烯酰胺为单体,合成马来酸酐与丙烯酰胺聚合物,通过对产物分子结构中的羧基与胺基进行有效调控,实现其对过氧化氢的稳定作用,以期为低成本、高性能过氧化氢非硅稳定剂的发展提供方向.
1 实验部分
1.1 实验原料及仪器
(1)主要原料
未漂化学热磨机械制浆,来自山东华泰纸业有限公司;分析纯丙烯酰胺、马来酸酐和硫酸镁,购自于天津市科密欧化学试剂有限公司;分析纯过硫酸铵、过氧化氢、氢氧化钠和硫酸铁铵,购自于天津市大茂化学试剂厂;分析纯氯化镁、氯化钙、磺基水杨酸和硅酸纳,购自于天津市天力化学试剂有限公司;工业乙醇、分析纯钙指示剂,购自于西安市科洛化玻仪器有限公司.
(2)主要仪器
精密定时电动搅拌器,JJ1型,金坛市华峰仪器有限公司;PH计,FE28型,梅特勒-托利多仪器(上海)有限公司;循环水式真空泵,SHZ-D111型,巩义市予华仪器有限公司;电子天平,JM-A6002型,余姚纪铭称重校验设备有限公司;色度百度计,温州仪器仪表有限公司;傅里叶变换红外光谱仪,VEC-TOR-22型,成都四洋科技有限公司;电热恒温鼓风干燥箱,DHG-9053A型,上海-恒科学仪器有限公司;电热恒温鼓风干燥箱,HH-2型,北京科伟仪器有限公司.
1.2 马来酸酐-丙烯酰胺聚合物的制备
向三口烧瓶中加入一定量的马来酸酐,再加入适量的蒸馏水,常温搅拌使其完全溶解.然后升温至80 ℃左右,持续搅拌,在60 min内先后缓慢滴加定量的丙烯酰胺和定量的引发剂过硫酸铵水溶液,滴加完后,恒温反应1~4 h,关闭搅拌器,冷却至室温,加水稀释至固含量为20%,用氢氧化钠溶液调节pH值至6~7.
1.3 金属离子螯合吸附试验
(1)Mg2+的螯合吸附试验
称取2 g稳定剂并分散于100 mL蒸馏水中,接着加入适量0.1 mol/L的MgCl2溶液,搅拌30 min,然后准确移取10 mL混合液于锥形瓶中,分别加入10 mL NH3-NH4+缓冲液和10 mL蒸馏水,再滴加几滴铬黑T指示剂;用EDTA标准溶液(0.02 mol/L)标定.至溶液由紫红色变成纯蓝色.计算如下[8]:
(1)
式(1)中:VMg2+为消耗镁离子的体积,mL;CEDTA为标准EDTA的浓度,mol/L;VEDTA为消耗的EDTA体积,mL.
(2)Ca2+的螯合吸附试验
称取2 g稳定剂并分散于100 mL蒸馏水中,加入0.1 mol/L的CaCl2溶液,搅拌30 min,准确移取10 mL混合液于锥形瓶中,分别加入20 mL蒸馏水和适量的氢氧化钠溶液,调节溶液成碱性,再加入少许钙指示剂,振荡使其溶解,用EDTA标准溶液(0.02 mol/L)标定至红色转变成淡蓝色.计算公式如下[8]:
(2)
式(2)中:VCa2+为消耗钙离子的体积,mL;CEDTA为标准EDTA的浓度,mol/L;VEDTA为消耗的EDTA体积,mL.
(3)Fe3+的螯合吸附实验
移取样品5 g,加去离子水分散,移至500 mL容量瓶中定容.移取5 mL混合液于250 mL锥形瓶中,移入10 mL 0.1 mol/L的硫酸铁铵溶液,加45 mL去离子水,再加入5滴左右的2%的磺基水杨酸,用0.05 mol/L EDTA标准溶液进行标定至溶液由紫红色变成黄色为终点,同时做空白实验.根据EDTA所消耗的体积,计算Fe3+浓度,公式如下[9]:
(3)
式(3)中:V1为空白实验消耗的EDTA的体积,mL;V为样品消耗的EDTA体积,mL;C为EDTA的标准浓度,mol/L;m为样品质量.
1.4 漂白实验
称取未漂绝干浆10 g于自封口塑料袋中,按照如下工艺进行漂白实验研究;浆浓20%,H2O24%,NaOH 3%,硫酸镁0.5%,一定量的稳定剂(2.5%硅酸钠,0.5%的自制非硅稳定剂,0.75%的自制非硅稳定剂).完全密封后于90 ℃水浴锅中进行漂白.漂白结束后,将纸浆抄成片进行纸张白度测试.
1.5 过氧化氢残余量的测定
漂白实验进行50 min后,准确移取漂白后残液25 mL于250 mL锥形瓶中,分别加入10 mL 20%的硫酸溶液和5 mL 100 g/L碘化钾溶液,再滴加3滴左右的新配制的硫酸铵饱和溶液.用0.1 mol/L Na2S2O3标准液滴定至淡黄色后,加入现配的淀粉指示剂,继续用Na2S2O3标准溶液滴定至蓝色刚好消失.计算公式如下[10]:
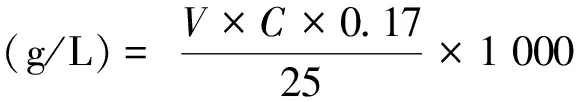
(4)
式(4)中:V为滴定所耗用Na2S2O3标准溶液的体积,mL;C为Na2S2O3标准溶液的浓度,mol/L;0.017为与1 mmol Na2S2O3相当的过氧化氢的量,g.
1.6 FT-IR分析
将制备好的液体加入乙醇经过离心机高速分离,随后放入真空干燥箱进行干燥得到固体产物.将所得物采用KBr压片法制备试样,扫描参数为:扫描范围4 000~4 00 cm-1,仪器分辨率为4 cm-1,扫描次数为32次.
2 结果与讨论
2.1 反应物配比对共聚物螯合性能的影响
在反应温度80 ℃,反应时间2 h,引发剂用量为7%的条件下,通过改变丙烯酰胺与马来酸酐的摩尔配比,研究其对Ca2+、Mg2+、Fe3+的螯合能力,其结果如图1所示.
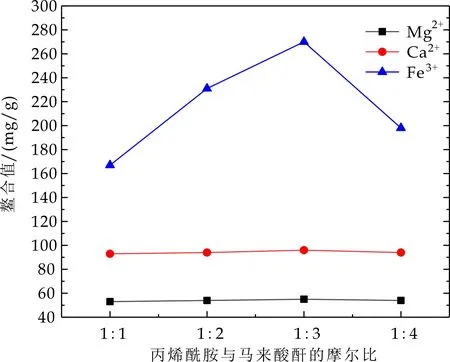
图1 丙烯酰胺/马来酸酐用量对螯合值的影响
作为过氧化氢良好的稳定剂,需要对重金属离子具有良好的螯合能力,然而,不同的金属离子对过氧化氢的无效分解具有不同的效率.一般而言,铁离子对过氧化氢的分解具有强烈的催化作用;而钙镁离子,尤其是镁离子却有利于稳定过氧化氢[11].因此,良好的稳定剂需要对铁离子具有高的螯合作用,而对钙镁离子具有较低的螯合值.
由图1可知,随着丙烯酰胺与马来酸酐配比的增加,聚合物对Ca2+、Mg2+、Fe3+的螯合吸附性能均呈现先增大再减小的趋势,并且在配比为1∶3时,螯合值达到最大.这是因为当两者摩尔比较小时,随着马来酸酐含量的不断增加,聚合物结构中引入的羧基含量不断增大,增加了它与金属离子的螯合几率,因此提高了聚合物的螯合性能.然而当配比超过1∶3时,对金属离子的螯合能力却下降,这是由于马来酸酐的聚合活性低于丙烯酰胺的聚合活性,随着马来酸酐的不断加入,活性较高的丙烯酰胺已经完成了聚合反应,使得过量的马来酸酐不能与之聚合,因此导致螯合能力下降[12].
2.2 反应温度对共聚物螯合性能的影响
丙烯酰胺与马来酸酐的摩尔比为1∶3,反应时间2 h,引发剂用量为7%的条件下,通过改变反应温度,研究其对Ca2+、Mg2+、Fe3+的螯合能力,其结果如图2所示.

图2 反应温度对螯合值的影响
由图2可知,随着反应温度的提高,所得聚合物对Fe3+的螯合能力先增加后降低,但对Ca2+和Mg2+的螯合能力影响不大.这可能是由于随着温度的提高,反应较为剧烈,所合成的聚合物分子量较大,分子内部结构存在空间位阻,使得羧基分布不均匀,呈乱序状态,使得其可以更好的与体积较大的分子结合,增加了螯合几率,但与体积较小的分子结合受到了限制[13].因此对体积较小的Ca2+和Mg2+的螯合能力影响较小,而体积相对较大的Fe3+的螯合能力却受到较为明显的影响.
2.3 反应时间对共聚物螯合性能的影响
丙烯酰胺与马来酸酐的摩尔比为1∶3,反应温度80 ℃,引发剂用量为7%的条件下,通过改变反应时间,研究其对Ca2+、Mg2+、Fe3+的螯合能力,其结果如图3所示.

图3 反应时间对螯合值的影响
由图3可知,随着反应时间的延长,聚合物对Fe3+、Ca2+、Mg2+的螯合能力均呈现先增大后减少的趋势,并且对Fe3+的螯合能力远远高于其它两种离子.这是由于随着反应时间的延长,马来酸酐和丙烯酰胺聚合反应程度越高,所合成产物的羧基含量也逐渐增加,从而使得螯合能力上升.但随着产物分子量的增大,羧基在聚合物分子内部的分布呈乱序状态,使得其可以更好地与体积较大的分子结合,增加了螯合几率,但与体积较小的分子结合受到了限制.因此体积相对较大的Fe3+与聚合物的螯合能力明显增大.
2.4 引发剂用量对共聚物螯合性能的影响
丙烯酰胺与马来酸酐的摩尔比为1∶3,反应时间2 h,反应温度80 ℃的条件下,通过改变引发剂用量,研究其对Ca2+、Mg2+、Fe3+的螯合能力,其结果如图4所示.

图4 引发剂用量对螯合值的影响
由图4可知,随着引发剂用量的增加,所得聚合物对Ca2+、Mg2+、Fe3+三种金属的螯合吸附性能均呈现先增大再减小的趋势,并且在引发剂用量为7%时,螯合能力达到最大.这可能是由于聚合反应过程中,引发剂用量的增加使得反应物活性增大,促进聚合反应的完成,而当引发剂浓度过高时,会使得丙烯酰胺的自聚增大,从而抑制了反应的正常进行[14],所以控制引发剂用量为7%.
综上所述,非硅稳定剂较佳制备工艺为丙烯酰胺与马来酸酐的摩尔比为1∶3,反应温度为80 ℃,反应时间为2 h,引发剂用量为7%时,所制备的非硅稳定剂Mg2+、Ca2+、Fe3+的螯合性能如表1所示.

表1 两种不同稳定剂对金属离子的螯合值
由表1可知,与硅酸钠稳定剂相比,自制非硅稳定剂具有更高的金属离子螯合能力,因此,其可以更好地稳定过氧化氢,从而控制其无效分解.同时,如同硅酸钠稳定剂一样,自制非硅稳定剂具有相对较低的钙镁离子螯合值,可适当保留漂白过程加入的硫酸镁所引入的镁离子,更好地防止过氧化氢的无效分解.
2.5 FT-IR分析
图5为马来酸酐-丙烯酰胺非硅稳定剂的红外光谱图.从图5可知,在3 520 cm-1和3 412 cm-1处出现了-NH2的对称和反对称的伸缩振动吸收特征峰[15];在3 345 cm-1处出现了-OH的吸收特征峰;在1 704 cm-1和1 566 cm-1处出现了COO-的对称和反对称伸缩振动吸收特征峰[16];1 368 cm-1处出现C-H的弯曲振动特征峰[17];而在1 620~1 640 cm-1附近未见C=C双键的伸缩振动吸收特征峰,这证明成功制备了马来酸酐-丙烯酰胺非硅稳定剂.

图5 来酸酐-丙烯酰胺非硅稳定剂红外光谱图
2.6 不同稳定剂漂白效果以及过氧化氢残余
将非硅稳定剂应用于浆料漂白,测试过氧化氢残留及漂后浆白度,并与硅酸钠稳定剂进行对比,结果如表2所示.
表2 不同稳定剂过氧化氢稳定性及漂后浆白度的影响
从表2可以看出,与硅酸钠稳定剂相比,自制非硅稳定剂作为稳定剂,当其用量为0.75%时,漂后过氧化氢的残余量从硅酸钠稳定剂的0.23 g/L增加至0.34 g/L.说明了自制非硅稳定剂对过氧化氢具有更高的稳定性能.这是由于自制非硅稳定剂表面电荷的中和特性,使其易与带正电荷的金属离子形成准离子键,同时,多个羧基与多价金属离子的配位离子键形成络合作用,将固化重金属离子,防止其对过氧化氢的无效分解.
对造纸工业植物纤维的漂白而言,漂后浆的白度是一个重要的指标.然而,从漂白浆后的白度来看,当非硅稳定剂用量为0.75%时,漂白浆后的白度略低于硅酸钠作稳定剂漂后浆白度,实验结果不利于非硅稳定剂的推广应用.为了探讨这一问题,研究工作对漂后过氧化氢的残余量与漂后浆白度进行综合分析,认为,漂白作用需要过氧化氢发生缓慢分解产生自由基,当使用自制非硅稳定剂时,有效抑制了过氧化氢的无效分解(快速分解),显著提高了过氧化氢的稳定性,导致漂后的残余过氧化氢含量增加.然而,这种稳定性的增加带来了分解过氧化氢的减少,从而使能够作用于发色基团、具有漂白作用的自由基减少,因此漂后浆白度略低于硅酸钠作为稳定剂的漂白浆白度.
按照这一思路,实验降低非硅稳定剂用量至0.5%,调控漂白过程中过氧化氢的分解,结果显示,漂白后过氧化氢的残余量从0.34 g/L降低至0.21 g/L,略低于硅酸钠稳定剂漂后过氧化氢的残余量;但漂白纸浆白度从61.49%增加至62.62%,略高于硅酸钠稳定剂漂后浆白度,显示了对硅酸钠良好的替代效果.
3 结论
(1)马来酸酐与丙烯酰胺的摩尔比为1∶3,反应温度为80 ℃,反应时间为2 h,引发剂用量为7%时,可以制备对过氧化氢具有良好稳定作用的非硅稳定剂.其对铁离子、钙离子和镁离子的螯合值分别为270 mg/g、96 mg/g和55 mg/g.
(2)非硅稳定剂在过氧化氢的漂白中具有良好的应用性能.当其作为过氧化氢稳定剂用于过氧化氢漂白时,0.5%的非硅稳定剂可达到2.5%的硅酸钠稳定剂应用性能.
