用双三唑吡啶-硝酸溶液从TODGA-HDEHP混合有机相中反萃取241Am和152Eu试验研究
2020-06-10吴芳芳贾红伟吕洪彬谢书宝叶国安
吴芳芳,贾红伟,吕洪彬,苏 哲,谢书宝,何 辉,叶国安
(中国原子能科学研究院,北京 102413)
核电站卸出的高放射性废物、乏燃料中含有次锕系元素(Np、Am和Cm)和长寿命裂变产物,虽然产额很小,但却贡献了绝大部分的放射性毒性。这些核素要衰变十几万年才能降到天然铀矿石的水平[1]。分离-嬗变是将次锕系元素单独分离出来,经过中子轰击使其嬗变为短寿命或稳定核素,从根本上解决高放废物长期放射毒性之难题[2]。用于次锕系元素和镧系元素分离的配体和流程有多种[3-8],其中流程之一是ALSP流程(Actinide Lanthanide Separation Process)[9-10]。流程中的有机相为中性TODGA和酸性HDEHP的混合物,水相配合剂为DTPA。该流程要求的pH范围较窄,需要加入缓冲剂[10],且二次废物产出较多。为避免这种情况,需要选择性能更优的水相配合剂,使在较宽酸度范围内起作用,并且不需要加入缓冲剂。目前,选择性较好的水相配合剂主要有SO3-Ph-BTP[11]、TS-BTPhen[12]和TS-BTBP[13]。这几种配合剂对次锕系元素均有良好的选择性,但分子结构中含有S,会导致二次废物增多。此外,这类分子结构复杂,合成成本较高。
水溶性2,6-二[1-(羟丙基)-1H-1,2,3-三嗪-4-基]吡啶(简称PTD)对Am有较高的选择性[14]。PTD的化学组成符合CHON规则,结构相对简单。试验研究用PTD-硝酸溶液从TODGA-HDEHP负载有机相中反萃取241Am和152Eu,以期为锕/镧分离流程设计提供参考依据。
1 试验部分
1.1 试剂与仪器
TODGA购于青岛百特沃德有机合成有限公司,纯度99.5%;HDEHP购于国药集团化学试剂有限公司;241Am和152Eu由中国原子能科学研究院提供;正十二烷和硝酸购于国药集团化学试剂有限公司,均为分析纯。PTD按文献[14]方法合成并纯化,经ESI-MS和NMR表征纯度大于99.5%后使用。
ME204E型精密天平(梅特勒-托利多集团),Milli-Q超纯水机(美国Millipore公司),MODEL 747型HPGe-γ探测器(Canberra公司),LPD2500型多管漩涡混合仪(莱普特(Leopard)科学仪器(北京)有限公司),TGL20MC型台式高速离心机(长沙湘仪离心机仪器有限公司)。
负载有机相:用0.05 mol/L TODGA-0.75 mol/L HDEHP-正十二烷与等体积含有示踪量241Am和152Eu的硝酸溶液混合振荡30 min后离心分相得到。
水相:含PTD的硝酸溶液,硝酸浓度0.1~3.0 mol/L,PTD浓度0.01~0.10 mol/L。
除特殊说明外,试验温度均为25 ℃。
1.2 试验方法
用一定浓度PTD-硝酸溶液(硝酸浓度0.1~3.0 mol/L),在相比1/1、恒温条件下从负载有机相中反萃取241Am和152Eu。用水浴加热,用磁子恒温搅拌30 min,反应完毕后离心分相,此时水相和有机相中都含有241Am和152Eu 2种金属元素。用γ探测器分别测定两相中241Am和152Eu的γ计数率,分别计算241Am和152Eu反萃取率。
反萃取率为进入水相的金属离子的总量与有机相中金属离子总量之比。金属离子浓度均用单位体积γ计数率表示,计算公式为
(1)
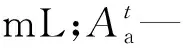
(2)
式中,反萃取分配比
(3)
式中:Ao—有机相中241Am和152Eu单位体积γ计数率,c·s-1·mL-1;Aa—水相中241Am和152Eu的单位体积γ计数率,c·s-1·mL-1。
2 试验结果与讨论
2.1 两相混合时间的确定
水相组成0.1 mol/L PTD-0.1 mol/L HNO3溶液,两相混合时间对PTD反萃取241Am和152Eu的影响试验结果如图1所示。
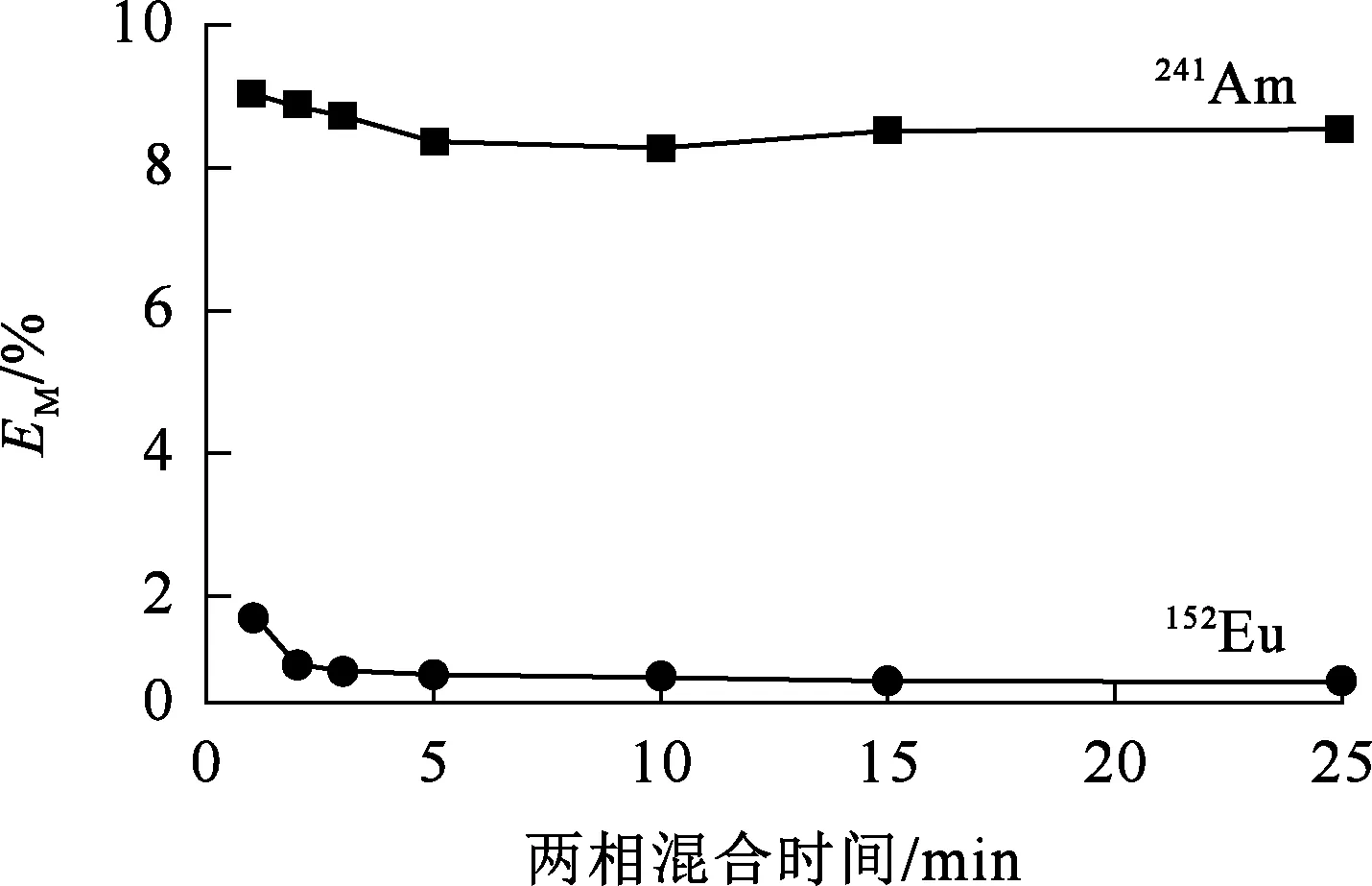
图1 两相混合时间对PTD反萃取241Am和152Eu的影响
由图1看出,两相混合时间超过5 min,反萃取反应趋于平衡。与PTD结构类似的水溶性SO3-Ph-BTP的平衡时间为10 min[9],PTD的反萃取平衡时间更短,这对于三价锕系元素与镧系元素的分离更有利。为了确保达到反萃取平衡,后续试验均振荡20 min。
2.2 水相硝酸浓度对PTD反萃取241Am和152Eu的影响
241Am和152Eu的反萃取分配比和分离系数(f(152Eu/241Am))随水相初始酸度的变化试验结果如图2所示。可以看出,D(241Am)和D(152Eu)均先降低后升高。
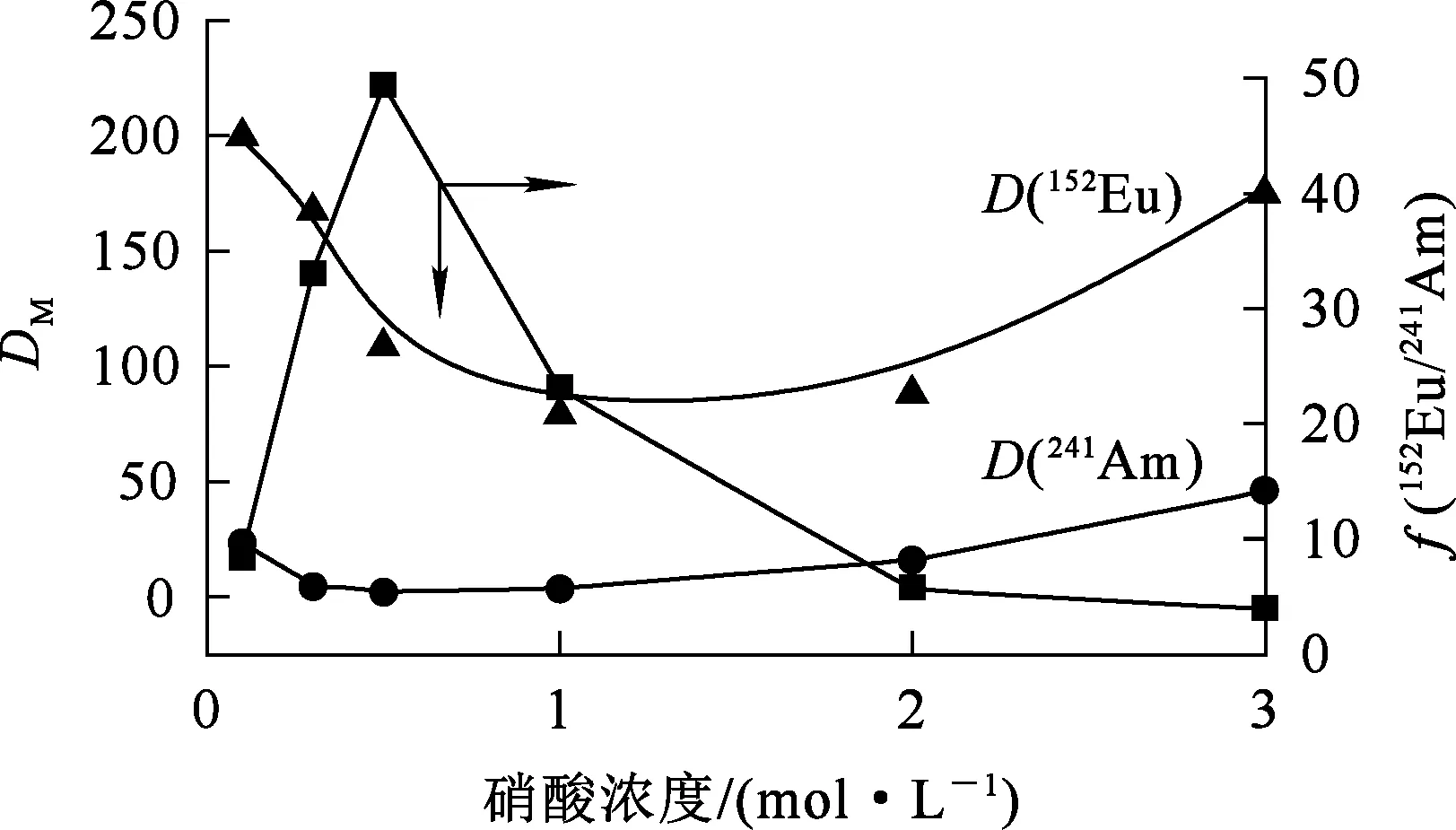
图2 241Am和152Eu的反萃取分配比和分离系数随水相初始酸度的变化
由文献[15]可知:在硝酸浓度较低(<0.5 mol/L)条件下,TODGA-HDEHP混合有机相萃取241Am和152Eu的反应为
(4)
在硝酸浓度较高(>0.5 mol/L)条件下,TODGA-HDEHP混合有机相萃取241Am和152Eu的反应为
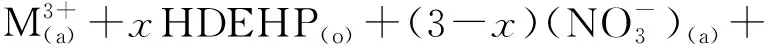
(5)
式中:x、y随硝酸根浓度增大而减小;当硝酸浓度为3.0 mol/L时,x=0.1,y=3.0。
PTD从HDEHP-TODGA中反萃取241Am和152Eu时,硝酸浓度由0.1 mol/L升高至0.5 mol/L,241Am和152Eu分配比随H+浓度升高而降低;硝酸浓度继续升高,萃取分配比受硝酸根浓度和TODGA浓度影响更显著,而体系中TODGA浓度不变,因此241Am和152Eu分配比随硝酸浓度升高而升高;另外,随水相中硝酸浓度升高,PTD发生质子化,见反应式(6),水相中的PTD逐渐与H+结合,丧失与金属离子配合能力,更多的金属离子存留在有机相中,分配比升高。因此,随硝酸浓度升高,D(241Am)和D(152Eu)均逐渐升高。

(6)
在所考察硝酸浓度范围内,分离系数先升高后降低,硝酸浓度为0.5 mol/L时,152Eu和241Am分离系数最大,为50。
2.3 PTD浓度对241Am和152Eu反萃取的影响
PTD从TODGA-HDEHP混合有机相中反萃取241Am和152Eu的反应为
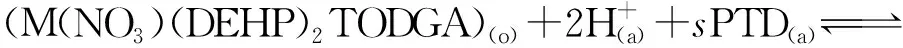
(7)
反应平衡常数K为
(8)
分配比D为
(9)
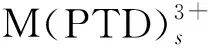
(10)
将式(10)带入式(8)后取对数得
lgDM=lgK-slg[PTD]-2lg[H+]+
2lg[HDEHP]。
(11)
保持水相硝酸浓度、有机相组成及温度恒定,水相组成为0.01~0.1 mol/L PTD-0.1 mol/L HNO3,改变水相中PTD浓度,以lgDM对lgPTD作图得斜率为-s的直线,如图3所示,s即为参与配位的PTD分子数。
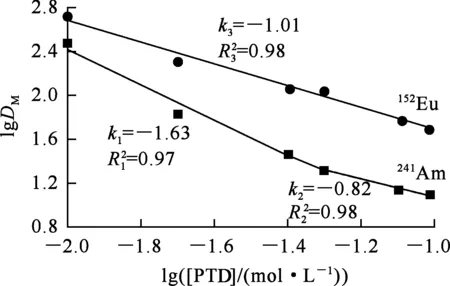
图3 PTD浓度对反萃取241Am和152Eu的影响
图3中,241Am的直线有2条:1条斜率为-1.63,说明体系中形成了1∶2配合物;随PTD浓度升高,斜率由-1.63变为-0.82,表明参与配位的PTD分子数减少,此时仅形成1∶1配合物。体系中存在PTD质子化反应(反应式(6)),当PTD浓度升高时,PTD质子化反应逐渐加强,反应向右移动,D(241Am)增大,因此直线斜率有减小趋势。PTD反萃取241Am的反应可表示为
(Am(NO3)(DEHP)2TODGA)(o)+
(12)
由图3看出:152Eu的直线斜率为-1.01,说明体系中仅形成1∶1配合物。PTD反萃取152Eu的反应式可表示为
(13)
2.4 温度对PTD反萃取241Am和152Eu的影响
水相组成为0.08 mol/L PTD -0.1 mol/L HNO3,在HNO3和PTD浓度不变条件下,温度对PTD反萃取241Am和152Eu的影响试验结果如图4所示。
图4 PTD反萃取241Am和152Eu的分配比和分离系数随温度的变化
由图4看出:随温度升高,241Am和152Eu的反萃取分配比逐渐降低,表明PTD反萃取241Am和152Eu的反应均为吸热反应;241Am和152Eu分离系数随温度升高而增大,表明升高温度对241Am和152Eu的分离有利。温度为60 ℃和70 ℃时,241Am的分配比分别为1.09和0.57,相应的单级反萃取率为48%和64%;而此时152Eu的分配比分别为96.31和121.40,相应的反萃率仅为1.03%和0.82%。通过升高温度,可以实现241Am和152Eu的分离。
3 结论
TODGA和HDEHP对三价镧系元素的亲和力均比对三价锕系元素的亲和力强。用加入了对三价锕系元素亲合力更强的配合剂PTD的硝酸溶液可以从TODGA-HDEHP混合有机相中反萃取镧系和锕系元素,利用推-拉效应,实现三价锕系元素与镧系元素的分离。
用HNO3-PTD溶液从TODGA-HDEHP-正十二烷有机相中反萃取241Am和152Eu,反萃取过程在5 min即达平衡;随水相HNO3浓度升高,241Am和152Eu反萃取分配比先降低后升高,二者分离系数在0.3 mol/L HNO3浓度下达到最大,约为50。
PTD-硝酸溶液反萃取241Am和152Eu反应为吸热反应,温度升高对反萃取有利,但对241Am反萃取影响更大,随温度升高二者分离系数升高;温度为70 ℃时,241Am和152Eu单级反萃取率分别为64%和0.82%。控制反应温度,可以实现241Am和152Eu的萃取分离。
