羧基化石墨烯/半胱胺修饰金电极对多巴胺的电化学行为研究
2020-06-09高先娟汲霞王清路杜青青王凤丹王怀生
高先娟, 汲霞, 王清路, 杜青青, 王凤丹, 王怀生
1.齐鲁医药学院药学院, 山东省高校生物医学工程技术重点实验室, 山东 淄博 255300;2.聊城大学化学化工学院, 山东 聊城 255000
多巴胺(dopamine,DA)是一种较为重要的儿茶酚胺类神经递质,它是一类与肾上腺素能受体兴奋时有相似作用的拟肾上腺素药物,可用于治疗各种类型的休克,临床上可用作抗休克药、平喘药等[1]。盐酸多巴胺注射液作为一种多巴胺受体激动剂可用于治疗肾功能衰竭、充血性心力衰竭等引起的休克综合症,因此建立一种灵敏、可靠、快速的检测方法对盐酸多巴胺含量进行检测具有重要的意义[2]。目前测定DA的方法主要有化学发光法[3-5]、分光光度法[6-8]、荧光光度法[9-10]、高效液相色谱法[11-13]以及电化学传感器法[14-16]等。电化学传感器法检测药物具有分析速度快、操作简单、响应时间短、成本低、灵敏度高等优势,一直在科研和生产中占据着重要的地位[17]。然而,DA在裸金电极的过电位偏高,易吸附于金电极表面,影响了其检测的灵敏度,修饰电极可有效降低过电位并提高分析的选择性和灵敏度[18]。自组装膜单分子膜(self-assembled monolayers,SAMs)是近几年来发展起来的,巯基在金电极表面发生化学吸附作用,单分子自组装膜基于硫原子与金电极之间的强相互作用,具有高稳定性和有序性、制备方法简单、成膜容易,受到应用技术及基础研究等方面的广泛重视。
半胱胺(cysteamine,CS)又称为β-巯基乙胺,是动物体内的生物活性物质,具有重要的生理意义[19]。半胱胺中巯基与Au自组装膜修饰电极,对DA具有催化作用[20]。石墨烯是一种新型的二维碳纳米材料,它独特的物理结构赋予了其诸多优异的性能,尤其是石墨烯较大的比表面积、较高的电化学催化活性和电子传输能力使其在电化学检测领域得到了广泛关注。石墨烯表面成惰性状态,难分散于极性及非极性的溶剂中,而且极易引起不可逆的团聚现象,因此需要对石墨烯加以改良,从而提高石墨烯的稳定性、分散性以及对其他材料的相容性。石墨烯引入特定的化学基团,可以赋予石墨烯更为独特的新性质[21]。有研究表明,利用三维纳米金/石墨烯复合膜修饰传感器可以对神经递质类物质多巴胺进行测定[22]。基于此,本研究将预处理后的裸金电极用含有巯基的半胱胺与金电极通过Au-S键形成自组装膜,再使用1-乙基-[3-二甲基氨基丙基]碳酰二亚胺盐酸化物/N-羟基琥珀酰亚胺(EDC/NHS)交联剂将羧基化的石墨烯(carboxylated graphene,CG)修饰到自组装后的电极表面制备多巴胺电化学传感器,以期该传感器可以应用于检测多巴胺注射液中的多巴胺含量。
1 材料与方法
1.1 试剂与仪器
1.1.1 实验试剂 铁氰化钾和氯化钾(天津市福晨化学试剂厂);磷酸氢二钠和磷酸二氢钠(莱阳经济技术开发区精细化工厂);β-巯基乙胺(罗恩试剂有限公司);羧基化石墨烯(西亚试剂有限公司);多巴胺标准品(阿拉丁试剂有限公司);盐酸多巴胺注射液(亚邦医药股份有限公司);亚硫酸氢钠(阿拉丁试剂有限公司);EDC和NHS(上海源叶生物科技有限公司)。
交联剂的配制:精密称取EDC 0.958 0 g、NHS 0.057 8 g同时置于50 mL的烧杯中,加入0.20 mol·L-1磷酸盐缓冲溶液(phosphate buffer solution,PBS)(pH 6.00)并用玻璃棒搅拌使其溶解,再转移至容量瓶中定容摇匀,制备出EDC/NHS交联剂,置于4 ℃保存备用。
1.1.2 实验仪器 电化学工作站(CHI660E,上海辰华仪器有限公司);酸度计(PHS-3C,杭州奥利龙仪器有限公司)。
1.2 实验原理
金电极与半胱胺结构中巯基通过自组装形成稳定的Au-S键,使其电极稳定性加强。再利用羧基化石墨烯较大的比表面积和较高的电化学催化活性的优点,使用交联剂EDC/NHS固定羧基化石墨烯于自组装金电极表面,具体如图1所示。
1.3 多巴胺电化学传感器的制备及电极表征
1.3.1 多巴胺电化学传感器的制备 金电极用砂纸打磨后再用直径为0.05 mm的Al2O3抛光至镜面,蒸馏水洗涤,超声波清洗15 min,自然晾干,无水乙醇超声清洗10 min,蒸馏水淋洗裸金电极,晾干备用。再将裸金电极于4 ℃悬浮浸泡在0.05 mol·L-1半胱胺溶液中24 h,取出后用0.20 mol·L-1PBS(pH 6.00)冲洗,自然晾干,即得到半胱胺修饰金电极(CS-Au)。再将CS-Au用0.20 mol·L-1PBS(pH 6.00)淋洗晾干,用吸量管移取EDC/NHS交联剂1.00 mL、羧基化石墨烯溶液1.00 mL,将2种试剂混合均匀,用微量移液枪滴涂6 mL 0.50 mg·mL-1羧基化石墨烯混合溶液到自组装电极表面,在室温下晾干后,置于4 ℃ 24 h后取出,用0.20 mol·L-1PBS(pH 6.00)冲洗,自然晾干,得到羧基化石墨烯-半胱胺修饰金电极(CG-CS-Au),即多巴胺电化学传感器。
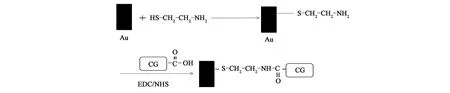
图1 金电极修饰流程Fig.1 Gold electrode modification process
1.3.2 修饰电极的表征 为了检验修饰电极的灵敏度,采用三电极体系,分别以裸金电极、半胱胺修饰金电极和多巴胺电化学传感器(即羧基化石墨烯-半胱胺修饰金电极)为工作电极,以饱和甘汞电极为参比电极,以铂电极为辅助电极,放置于2.5×10-3mol·L-1的铁氰化钾溶液(含0.10 mol·L-1氯化钾)中,用电化学工作站在-0.2~0.6 V电位之间进行循环伏安扫描。
1.4 多巴胺溶液的测定
1.4.1 多巴胺溶液测定的基本流程 用PBS和多巴胺标准品配制多巴胺溶液。然后采用三电极体系,以多巴胺电化学传感器(即羧基化石墨烯-半胱胺修饰金电极)为工作电极、饱和甘汞电极为参比电极、铂电极为辅助电极,将三电极置于1.0×10-3mol·L-1多巴胺溶液中,用电化学工作站在-0.2~0.6 V电位之间进行循环伏安扫描,根据测定的电流大小定量分析多巴胺。
1.4.2 多巴胺测定条件的优化 分别考察PBS的浓度(0.15、0.20、0.25、0.30和0.35 mol·L-1)、PBS的pH(5.70、6.00、6.50、7.00、7.30)和扫描速率(50、100、150、200和250 mV·s-1)3个因素对多巴胺测定的影响,以电流值为考察指标。研究某一单因素影响效果时,其他条件为固定值,分别为:PBS浓度为0.30 mol·L-1,PBS的pH为6.00,扫描速率为50 mV·s-1。每个处理3次重复。
1.4.3 标准曲线的绘制 为了考察DA的氧化峰电流与浓度间的关系,在最佳检测条件下利用制备的多巴胺电化学传感器检测1.0×10-3、1.5×10-3、2.0×10-3、2.5×10-3、3.0×10-3和3.5×10-3mol·L-1的多巴胺标准溶液。以多巴胺浓度为横坐标,多巴胺电化学传感器电流为纵坐标,绘制标准曲线。每个处理3次重复。
1.5 多巴胺电化学传感器性能检测
1.5.1 精密度的测定 将制得的多巴胺电化学传感器置于2.5×10-3mol·L-1的多巴胺标准溶液中,在最佳检测条件下使用同一支多巴胺电化学传感器平行测定6次。根据所得数据计算出相对标准偏差(relative standard deviation,RSD),以判断该电化学传感器的精密度。
1.5.2 稳定性的测定 将制得的多巴胺电化学传感器,置于冰箱1、4、8、12、24、36 h后,在最佳检测条件下,测定浓度为2.5×10-3mol·L-1的多巴胺标准溶液的电流值。根据所得数据计算出RSD,以判断该电化学传感器的稳定性。
1.5.3 抗干扰性的测定 在检测盐酸多巴胺注射液中多巴胺的含量时,抗氧剂亚硫酸氢钠可能会对多巴胺含量的检测产生干扰,所以选择亚硫酸氢钠作为干扰剂。根据盐酸多巴胺注射液制备处方量的干扰剂加入量比例为1∶(0.15~0.25),精密称取亚硫酸氢钠0.002 1 g与多巴胺标准品0.011 7 g,用0.30 mol·L-1PBS(pH 6.00)溶于50 mL的烧杯中,用玻璃棒搅拌使其溶解,并转移到25 mL的棕色容量瓶中充分摇匀定容,于冰箱保存备用。
量取10 mL加入干扰剂的多巴胺溶液,在最佳检测条件下,利用制备的多巴胺电化学传感器进行5次检测。根据所得数据计算出RSD,以判断该电化学传感器的抗干扰性。
1.5.4 准确度的测定(回收试验) 在含量测定方法建立过程中,以回收率估计分析方法的误差和操作过程的损失,来评价方法的准确度。取盐酸多巴胺注射液(亚邦医药股份有限公司)(20 mg·2 mL-1)10支,将药液混匀,量取盐酸多巴胺注射液1.02 mL,置于50 mL容量瓶,用0.30 mol·L-1PBS(pH 6.00)稀释定容摇匀,作为空白溶液。在最佳检测条件下,利用多巴胺电化学传感器进行测定,根据测得的电流值带入标准曲线线性方程,求出对应的DA浓度,进而计算出DA质量(m1)。
精密量取已知含量(20 mg·2 mL-1)的盐酸多巴胺注射液1.02 mL,置于50 mL容量瓶,平行6份,为供试品;分别精密量取多巴胺储备液相当于标准品0.008 0 g、0.009 9 g、0.012 0 g各2份(相当于含量测定的80%、100%、120%),溶于放置供试品的容量瓶中,用0.30 mol·L-1PBS(pH 6.00)稀释定容于50 mL容量瓶。在最佳检测条件下,利用多巴胺电化学传感器进行测定,根据测得的电流值带入标准曲线线性方程,求出对应的DA浓度,进而计算溶液中DA质量(m3)。
1.6 样品分析
利用制得的多巴胺电化学传感器,在最佳检测条件下,检测盐酸多巴胺注射液。取盐酸多巴胺注射液(亚邦医药股份有限公司)(20 mg·2 mL-1)10支,将药液混匀,移取1.20 mL(质量为0.012 0 g)该药液置于25 mL容量瓶中,先将样品用0.30 mol·L-1磷酸氢二钠溶液调至最佳pH(即6.00),再用0.30 mol·L-1PBS(pH 6.00)定容,制成一定浓度的盐酸多巴胺溶液,该浓度溶液在标准曲线范围内。
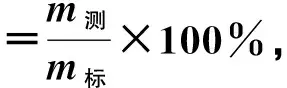
2 结果与分析
2.1 修饰电极的表征
为了表征修饰电极的修饰情况,以修饰电极为工作电极、饱和甘汞电极为参比电极、铂电极为辅助电极,在-0.2~0.6 V电位之间,依次将裸金电极、CS-Au电极、多巴胺电化学传感器(即CG-CS-Au电极)浸泡于2.5×10-3mol·L-1的铁氰化钾溶液(含0.10 mol·L-1氯化钾)中,利用循环伏安法进行表征。从图2可以看出,b峰比a峰电流大,说明裸金电极经半胱胺自组装后,电流增强,表明半胱胺(CS)已成功修饰至金电极表面,修饰半胱胺后促进了电子转移。曲线c与b相比较,可看出c峰电流响应明显增大,说明羧基化石墨烯-半胱胺修饰金电极可以促进电子转移,催化反应进行,提高了金电极灵敏度。
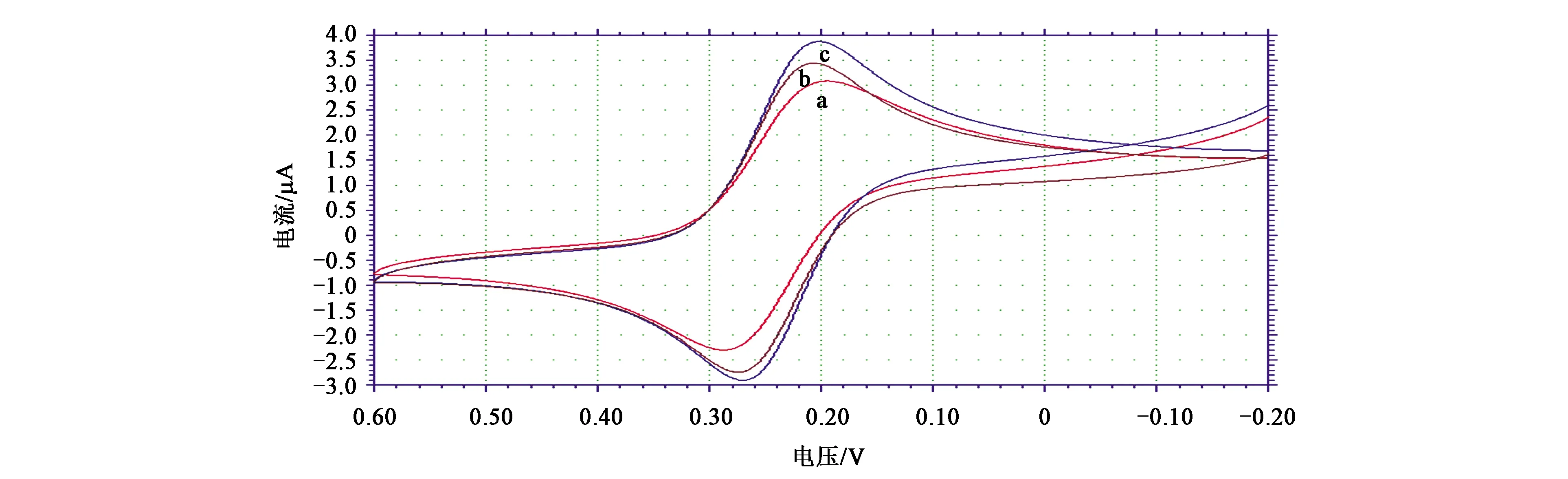
注:a—裸金电极; b—CS-Au电极; c—多巴胺电化学传感器(即CG-CS-Au电极)。图2 修饰电极在铁氰化钾溶液(含0.10 mol·L-1氯化钾)的循环伏安图Fig.2 Cyclic voltammetry of modified electrode in potassium ferricyanide solution(containing 0.10 mol·L-1 potassium chloride)
2.2 实验条件的优化
2.2.1 PBS浓度的选择 为了探究磷酸盐缓冲溶液浓度对多巴胺检测的影响,分别利用pH为6.00不同浓度的PBS配制1.0×10-3mol·L-1多巴胺溶液,在-0.2~0.6 V电位之间,在50 mV·s-1的扫描速率下进行循环伏安扫描。根据图3可知,在0.15~0.35 mol·L-1PBS(pH 6.00)范围内,随着PBS浓度的增加,多巴胺电化学传感器的电流响应变大,电极的灵敏度增高,在0.30 mol·L-1PBS(pH 6.00)中峰电流响应值最大,随着PBS浓度的继续增加,电极灵敏度变小。因此,本实验中选择0.30 mol·L-1的PBS作为多巴胺电化学传感器的最佳支持电解质。

图3 不同浓度PBS下的循环伏安图Fig.3 Cyclic voltammograms of PBS with different >concentrations
2.2.2 PBS pH的选择 为了探究磷酸盐缓冲溶液pH对多巴胺检测的影响,以0.30 mol·L-1的PBS为基础,调节为不同pH,然后分别用于配制DA浓度为1.0×10-3mol·L-1的溶液,在-0.2~0.6 V电位之间、扫描速率为50 mV·s-1的条件下进行循环伏安扫描。由图4可知,CG-CS修饰电极在pH 5.70~7.30范围内,pH 6.00对应的电流值最大。因此,本实验中选择pH 6.00的PBS作为多巴胺电化学传感器的最佳支持电解质。
2.2.3 扫描速率的选择 为了探究扫描速率对多巴胺检测的影响,利用0.30 mol·L-1PBS(pH 6.00)配制1.0×10-3mol·L-1的DA溶液,在-0.2~0.6 V电位之间,在不同扫描速率下,进行循环伏安扫描。根据图5所示,扫描速率在50~200 mV·s-1范围时,扫描速率越高,对应的峰电流响应值越大,灵敏度越高;当扫描速率继续增加至250 mV·s-1时,对应的峰电流响应值变小,灵敏度变低。因此,选择扫描速率200 mV·s-1作为最佳扫描速率。
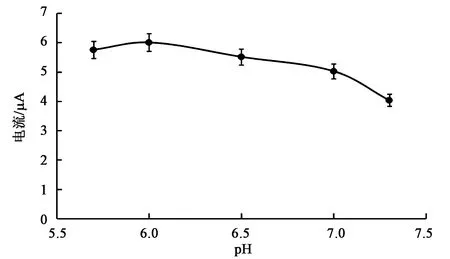
图4 不同pH下的循环伏安图Fig.4 Cyclic voltammograms at different pH
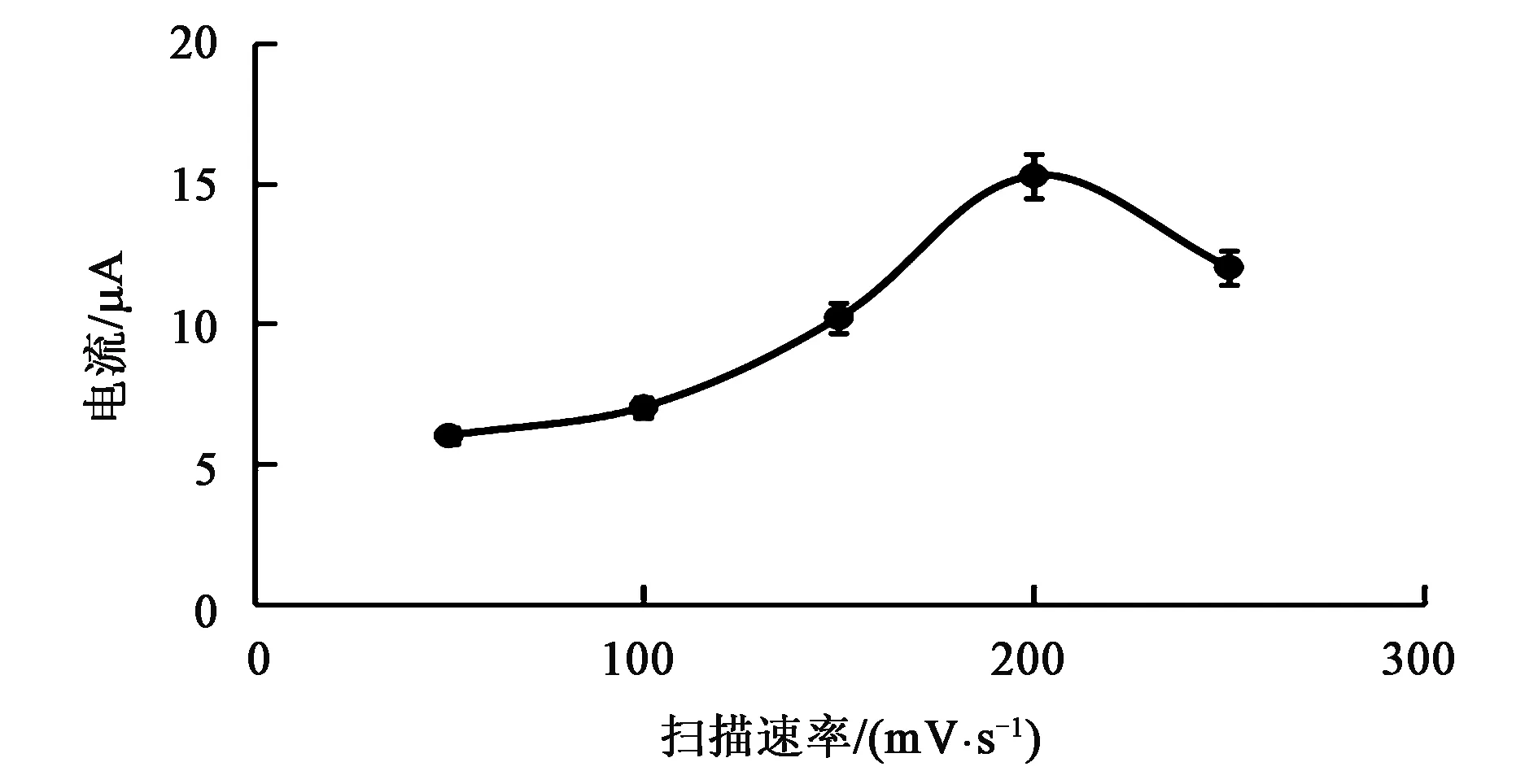
图5 不同扫描速率下的循环伏安图Fig.5 Cyclic voltammograms at different scanning rates
2.3 标准曲线的绘制
为了考察DA的氧化峰电流与浓度间的关系,利用0.30 mol·L-1PBS(pH 6.00)配制0.1 mol·L-1的多巴胺储备溶液,再用0.30 mol·L-1PBS(pH 6.00)稀释配制浓度为1.0×10-3、1.5×10-3、2.0×10-3、2.5×10-3、3.0×10-3和3.5×10-3mol·L-1的多巴胺标准溶液。在扫描速率为200 mV·s-1时,利用制备的多巴胺电化学传感器检测以上浓度的多巴胺标准溶液,依次测得电流大小为15.27、19.19、23.19、27.01、31.57和35.50 μA。以多巴胺浓度为横坐标、多巴胺电化学传感器电流为纵坐标,绘制标准曲线。根据标准曲线图6可知,多巴胺电化学传感器的电流随着多巴胺标准溶液浓度的增大而增大,线性方程为I=8.120 6C+7.017,相关系数R2为0.999 5,该多巴胺电化学传感器在多巴胺浓度为1.0×10-3~3.5×10-3mol·L-1范围内具有良好的线性关系,以3倍的信噪比计算检测下限为3.7×10-5mol·L-1。
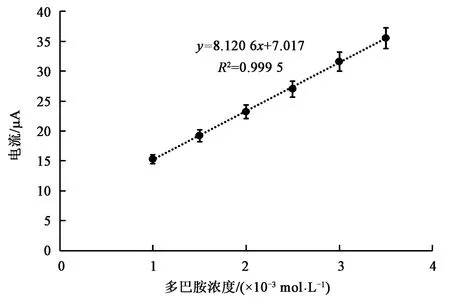
图6 多巴胺电化学传感器的标准曲线Fig.6 Standard curve of dopamine electrochemical sensor
2.4 多巴胺电化学传感器性能检测
2.4.1 精密度的测定 为了检测制备的多巴胺电化学传感器的精密度,将该多巴胺电化学传感器置于在2.5×10-3mol·L-1的多巴胺标准溶液中,在最佳检测条件(利用pH 6.00的0.30 mol·L-1PBS配制多巴胺溶液,扫描速率设定为200 mV·s-1)下,使用同一支多巴胺电化学传感器平行测定6次。测定电流结果分别为26.89、26.65、27.07、26.58、26.49和26.55 μA,平均值为26.70 μA,由以上数据计算RSD为0.85%。说明该多巴胺电化学传感器的精密度良好。
2.4.2 稳定性的测定 为了检测制备的多巴胺电化学传感器的稳定性,利用该多巴胺电化学传感器,在最佳检测条件下,分别于1、4、8、12、24、36 h时,测定浓度为2.5×10-3mol·L-1的多巴胺标准溶液的电流值。测得其电流值结果分别为26.09、25.67、25.74、26.18、25.49和25.39 μA,平均值为25.76 μA,根据所得的结果计算出RSD为1.4%。说明该多巴胺电化学传感器在36 h内稳定性良好。
2.4.3 抗干扰性检测 为了检测制备的多巴胺电化学传感器的抗干扰性,在最佳检测条件下,利用该多巴胺电化学传感器检测加入干扰剂的多巴胺溶液,5次检测结果分别为26.31、26.29、26.32、26.30和26.28 μA,平均值为26.30 μA,与未加入亚硫酸氢钠的检测电流25.93 μA相比较,结果较为相近,计算得到RSD为1.0%。因此判定该多巴胺传感器具有一定的抗干扰性。
2.4.4 准确度的测定 为了检测制备的多巴胺电化学传感器的准确度,进行了回收试验。计算回收率具体见表1。由表1可知,6份测定结果平均值为96.4%,符合回收率应该在95%~105%的要求,说明该多巴胺传感器的准确度较高。
2.5 样品分析
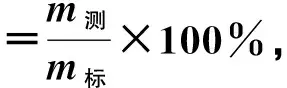
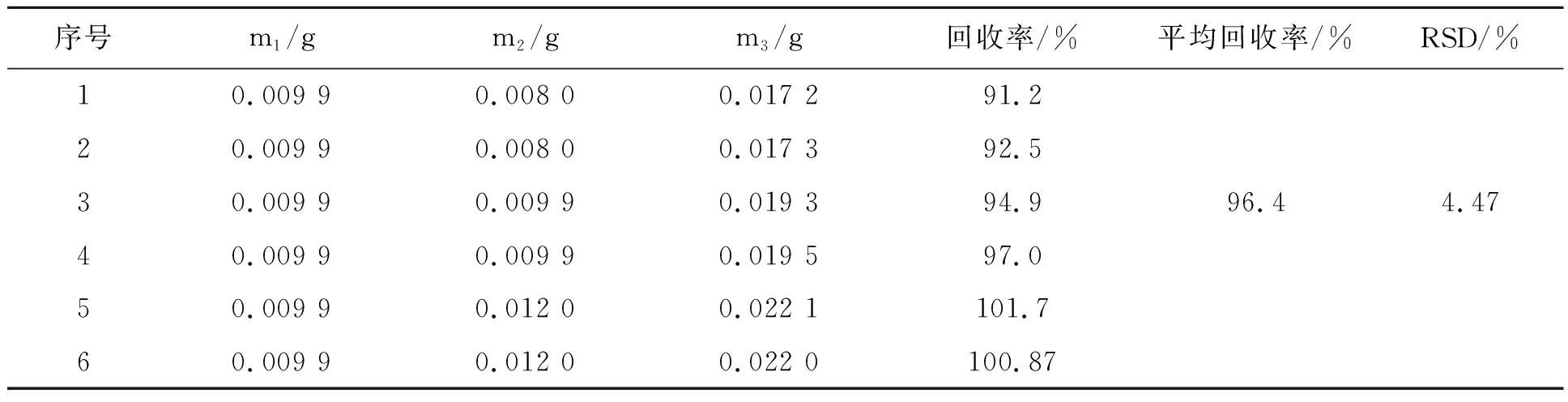
表1 加样回收实验结果Table 1 Experimental results of sample adding and recovery
3 讨论
目前,测定DA浓度的方法较多,但各自存在不足,使应用受到限制。如陈亚红等[8]利用酶催化动力学光度法测定盐酸多巴胺相比较,液体酶易失活,使得检测方法受限制。而电化学传感器法检测药物具有分析速度快、操作简单、响应时间短、成本低、灵敏度高等优势。因此,本研究利用自组装技术和化学键合法制成羧基化石墨烯/半胱胺修饰金电极的多巴胺电化学传感器。经单因素实验得到最佳检测条件,具体为:利用pH 6.00的0.30 mol·L-1磷酸盐缓冲溶液(PBS)配制多巴胺溶液,扫描速率设定为200 mV·s-1。在多巴胺浓度为1.0×10-3~3.5×10-3mol·L-1范围内,多巴胺电化学传感器在电流与多巴胺浓度呈现良好的线性关系。且该传感器精密度高,稳定性良好,具有一定的抗干扰能力。
该多巴胺电化学传感器成本低廉、操作简单、化学污染少,总体来说其具有一定的应用前景。但需要注意的是,该传感器用到的半胱胺因分子中含有巯基,在空气中易氧化而被破坏,因此需要在干燥、阴凉处存放使用,那么如何提高该传感器在不同环境下的稳定性仍是扩大其应用范围亟需解决的问题。后续可进一步改变修饰金电极的物质,如石墨烯或其他纳米材料,以提高多巴胺生物传感器的性能指标。
