ApoE-/-小鼠动脉粥样硬化斑块中NHE1与Netrin-1表达上调
2020-06-09莫显刚张诗悦
杨 卉,莫显刚,王 兰,张诗悦
(1.贵州医科大学 临床医学系; 2.贵州医科大学附属医院 综合病房, 贵州 贵阳 550004)
中国冠心病患者达1 100万,心血管病死亡率占居民全部死因的比例为 40%以上[1]。心血管疾病病理基础是动脉粥样硬化(atherosclerosis,AS)。缺氧与AS斑块形成、发展关系密切[2-3]。神经轴突导向因子-1(netrin-1)在巨噬细胞/泡沫细胞滞留动脉粥样斑块起重要作用[4],影响AS的发生发展[5-6]。钠氢交换体1( NHE1)是重要细胞膜通道蛋白,小鼠内皮细胞缺氧条件下NHE1 mRNA及蛋白水平表达增加[7-8],而阿米洛利(amiloride)通过阻断NHE1活性抑制内皮细胞凋亡,减轻脂多糖(lipopolysaccharide,LPS)诱导的AS斑块形成[9],表明NHE1激活可能是AS发生的重要事件。NHE1在netrin-1诱导神经轴突早期形态发生及神经轴突生长过程中有一定作用[10],那在AS发生发展过程中,NHE1与netrin-1是否也存在类似相关性呢?本研究旨在探讨AS斑块病理组织水平及缺氧巨噬细胞系RAW264.7中NHE1、netrin-1表达及共定位情况,研究调控NHE1表达是否会对netrin-1表达产生影响。
1 资料与方法
1.1 材料
1.1.1 动物:ApoE-/-小鼠,SPF级,6~8周龄,雄性,体质量20 g左右[北京维通利华公司,scxk(京)2016-0006]。
1.1.2 细胞:小鼠单核细胞白血病细胞系RAW264.7(中国科学院上海生命科学研究院细胞资源中心)。
1.1.3 试剂:DMEM高糖培养基、胎牛血清、青霉素链霉素溶液、Trizol、cDNA反转录试剂盒和Opti-MEM(Thermo Fisher Scientific公司);PMSF、BCA蛋白浓度测定试剂盒、SDS-PAGE、Western blot封闭液、Western blot一抗稀释液、Western blot二抗稀释液和ECL发光试剂(Beyotime公司);Anti-NHE1抗体(兔源)、anti-netrin-1抗体(山羊源)和驴抗山羊荧光二抗(Abcam公司);山羊抗兔荧光二抗和蛋白Marker(CST公司);0.25%胰蛋白酶(HyClone公司);RIPA(Solarbio公司);30%丙烯酰胺(百奥莱博公司);PVDF膜(Mihipore公司);Lipofectamine®RNAiMAX(Invitroge Life Technologies公司)。
1.2 方法
1.2.1 小鼠分组及处理:随机将ApoE-/-小鼠分成标准饮食组和高脂饮组,喂养至12周时,麻醉处死小鼠,游离固定主动脉弓,石蜡包埋切片(西方高脂饮食原料:酪蛋白、蛋氨酸、蔗糖、玉米淀粉、糊精等,热量4.5千卡/g,其中脂肪42%、蛋白质15%、碳水化合物43%、胆固醇0.2%)。
1.2.2 组织切片处理:小鼠主动脉石蜡切片行苏木精-伊红染色(HE染色),用免疫荧光染色检测小鼠主动脉NHE1、netrin-1蛋白表达及定位情况,显微共聚焦观察摄像并采图。
1.2.3 细胞的培养及分组处理:1)设计两条NHE1 siRNA序列,联系相关公司生产,产品为减压离心干燥品,低速离心10 min,使样品沉积于管底,加入DEPC水,离心,-20 ℃保存。设计的两组NHE1基因干扰序列:NHE1 siRNA1:正义链 5′-CCUGCUA CUCGUUGGUGCCUAUAAA-3′,反义链5′-UUUAUA GGCACCAACGAGUAGCAGG-3′;NHE1 siRNA2:正义链5′-GAGUGCAGAUUUCUAGCCCAUUUCA-3′,反义链5′-UGAAAUGGGCUAGAAAUCUGCACUC-3′;阴性对照乱码短RNA序列:正义链5′-UUCUCCG AACGUGUCACGUAA-3′;反义连5′-ACGUGACACG UUCGGAGAUU-3′。2)NHE1 siRNA转染细胞:将生长至对数期的RAW264.7细胞,汇合度≥70%时,进行瞬时转染。50 μL的Opti-MEM稀释20 pmol siRNA,50 μL Opti-MEM稀释1 μL lipofectamine®RNAiMAX试剂,将稀释好的siRNA和lipofectamine®RNAi MAX试剂混合,转染RAW264.7细胞,6 h后去除混合液,换成无抗生素高糖DMEM培养液(10% FBS),继续培养24 h。3)干扰效率检测:待siRNA转染细胞24 h后实时荧光定量PCR(RT-qPCR)及Western blot检测转染后细胞NHE1 mRNA及蛋白表达水平:实验分为空白对照组、阴性对照组、转染NHE1 siRNA1组及NHE1 siRNA2组。①抽提各组细胞总RNA: PBS冲洗后加Trizol使细胞裂解后加入氯仿,混匀,使水相和有机相充分接触,离心,管内液体分为3层,将上层RNA移至新的RNase free管内。加入等体积异丙醇,混匀,室温沉淀,离心,收集RNA沉淀,弃上清,加入75%乙醇,离心,加入DEPC水,充分溶解沉淀。标记,-80 ℃冰箱保存备用;②总RNA纯度及完整性鉴定:ddH2O水稀释NHE1 RNA样品后,核酸定量仪上测定吸光度值。取NHE1 RNA样品,1%琼脂糖凝胶电泳,EB染色,凝胶成像系统观察总RNA的5s rRNA,18s rRNA和28s rRNA 3条条带是否清晰可见,如均完整的话即可证明总RNA抽提比较完整;③反转录合成cDNA:1 μg 总RNA,引物1 μL,DEPC水补足至总体积12 μL,将上述溶液混匀加入RNase free的PCR管中,离心。上机:70 ℃ 5 min,4 ℃ 10 min,随后依次加样成反应体系(5×反应缓冲液4 μL,RNA酶抑制剂1 μL,10 mmol/L dNTP Mix 2 μL,反转录酶1 μL,RNase free PCR管中液体12 μL)。上机:50 ℃ 40 min,80 ℃ 5 min,4 ℃ 10 min,得到的cDNA并标记,-20 ℃冰箱保存。NHE1引物序列:上游引物5′-CTGCCTGCTGATCG TAGTGG-3′,下游引物5′-CCCAGGAAGAACGCATT CCA-3′;GAPDH引物序列:上游引物5′-GGAGAGT GTTTCCTCGTCCC-3′,下游引物5′-ACTGTGCCGTT GAATTTGCC-3′;④PCR反应:8连管每孔依次加入PCR反应体系(SYBR-Green/ROX qPCR Master Mix 10 μL,上游引物1 μL,下游引物 1 μL,DNA Template 1 μL,Nuclease-free ddH2O 7 μL),离心数秒,上机:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,35个循环。荧光定量PCR扩增仪读取所有样本GAPDH和NHE1的Ct值,采用2-△△Ct法计算NHE1相对表达量。
1.2.4 Western blot检测Ox-LDL干预小鼠RAW264.7细胞后NHE1及netrin-1蛋白表达:待细胞贴壁汇合度≥70%时,以不同浓度Ox-LDL梯度作用于RAW264.7细胞,设未加刺激的细胞为对照组;按试剂盒提取各组细胞总蛋白, BCA法测定蛋白浓度,样品终浓度=测得样品浓度(g/L)×稀释倍数。制备SDS-PAGE凝胶(下层为10%分离胶,上层5%浓缩胶);等量蛋白与上样缓冲液混匀后煮沸5 min使蛋白变性后加至浓缩胶的梳齿孔中,边缘一孔加入预染蛋白Maker 3 μL,电泳,待溴酚蓝达到分离胶底部边缘1 cm时,停止电泳,将蛋白转移至PVDF膜上,封闭2 h后,使用一抗稀释液稀释一抗(兔抗NHE1多克隆抗体1∶1 000、山羊抗netrin-1多克隆抗体1∶1 000、兔抗GAPDH单克隆抗体1∶1 000),4 ℃孵育过夜;根据一抗来源选择合适的二抗(山羊抗兔IgG 1∶2 000,驴抗山羊IgG 1∶2 000),温和振荡孵育60 min;将PVDF膜取出发在保鲜膜上,将适量ECL滴于PVDF膜上,避光孵育1 min,紫外凝胶成像仪中进行曝光,摄像。取最佳Ox-LDL作用浓度作用于RAW264.7细胞,分别孵育0 h(对照组)、6、12 和24 h,按时收集细胞,提取细胞总蛋白,Western blot测定各实验组NHE1及netrin-1蛋白表达情况。
1.2.5 Western blot检测敲降NHE1后Ox-LDL对netrin-1表达的影响:在成功筛选出一条能有效抑制NHE1表达的siRNA后,继续进行后续实验。实验分为空白对照组、siRNA干扰组、Ox-LDL干扰组和siRNA+Ox-LDL干扰组。按照分组,将各干预因素分别加入细胞继续培至24 h。Western blot检测各实验组细胞NHE1及netrin-1表达情况。
1.3 统计学分析
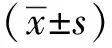
2 结果
2.1 动脉粥样斑块形成
高脂饮食ApoE-/-小鼠主动脉管腔血管内皮连续性破坏,管壁局部明显突出于管腔内,内膜下可见泡沫细胞和脂质斑块,动脉外膜变薄,动脉粥样斑块模型构建成功(图1)。
2.2 动脉粥样斑块中NHE1表达升高
高脂饮食组ApoE-/-小鼠动脉粥样斑块中NHE1阳性表达(绿色荧光),DAPI核染也呈阳性反应(蓝色颗粒),高脂饮食组小鼠动脉粥样斑块中NHE1表达升高(图2)。
2.3 NHE1与netrin-1在斑块中存在共表达
高脂饮食组ApoE-/-小鼠动脉粥样斑块中NHE1及netrin-1均可在粥样斑块中表达(分别为绿色颗粒和红色颗粒),斑块深部黄色区域,提示两者存在部分共定位(图3)。
2.4 Ox-LDL上调RAW264.7细胞NHE1、netrin-1 mRNA和蛋白表达
NHE1及netrin-1蛋白表达随Ox-LDL浓度的增加、培养时间的延长而上调(P<0.05)(图4)。
2.5 转染NHE1 siRNA后RAW264.7细胞NHE1表达下降
NHE1 siRNA1及siRNA2两个转染组的NHE1mRNA表达均低于对照组及阴性对照组, 其中siRNA2组较siRNA1组对NHE1的干扰效率更显著(P<0.05)(图5A)。与空白对照组、阴性对照组相比,两组siRNA转染细胞NHE1蛋白表达水平均明显降低(P<0.05)(图5B)。

图1 小鼠主动脉组织HE染色Fig 1 Hematoxylin-eosin staining of mice aorta

图2 小鼠动脉粥样斑块免疫荧光染色Fig 2 Immunofluorescence staining of atherosclerotic plaque in mice(×40)

图3 小鼠动脉粥样斑块共聚焦显微成像Fig 3 Confocal microscopic imaging of atherosclerotic plaque in mice(×40)
2.6 敲降NHE1抑制Ox-LDL诱导RAW264.7细胞netrin-1表达
与空白对照组相比,Ox-LDL组NHE1及netrin-1蛋白表达水平均上调(P<0.05);与空白对照组相比, siRNA2组NHE1及netrin-1蛋白表达均下调(P<0.05);Ox-LDL+NHE1 siRNA组与Ox-LDL组相比较,升高的NHE1及netrin-1蛋白表达水平下调(P<0.05)(图6)。

A.different concentrations; B.different times;*P<0.05 compared with control group;#P<0.05 compared with control group, 50 μg/mL, 150 μg/mL group;△P<0.05 compared with control, 6 hours, 12 hours group
图4 不同浓度、时间Ox-LDL对细胞NHE1及netrin-1蛋白表达的影响


A.RT-qPCR; B.Western blot; *P<0.05 compared with control and negative control; △P<0.05 compared with siRNA1图5 siRNA转染对RAW264.7细胞NHE1表达的影响Fig 5 Effect of siRNA on NHE1 expression in RAW264.7

*P<0.05 compared with control; △P<0.05 compared with Ox-LDL图6 各组RWA264.7细胞NHE1及netrin-1蛋白表达水平Fig 6 Expression of NHE1 and netrin-1 in RAW264.7 cells of different
3 讨论
巨噬细胞/泡沫细胞迁出斑块可促进斑块消退,单核细胞/巨噬细胞出入斑块的动态平衡在AS斑块形成、发展及斑块不稳定中发挥重要作用[11]。缺氧及HIF-1α升高可促使巨噬细胞脂质合成增强、ATP 耗竭、乳酸堆积、增加蛋白降解和血管新生等,通过多途径抑制胆固醇逆转运,促进泡沫细胞形成,并滞留于斑块,参与AS形成与发展[12]。本研究主要探讨在ApoE-/-小鼠动脉粥样硬化过程中,粥样硬化斑块病理组织水平及细胞水平下,HIF-1α靶基因产物NHE1、netrin-1表达情况及相互关系。
本研究在构建AS斑块模型成功基础上,进行免疫荧光染色,结果发现高脂饮食组小鼠动脉粥样斑块中NHE1阳性表达,DAPI核染也呈阳性反应,说明高脂饮食组小鼠动脉粥样斑块中NHE1表达升高。这一结果与报道的[13]相类似。但是与低氧和TME(1%低氧、低血清、葡萄糖、pH和高乳酸)均能降低NHE1 mRNA表达水平的结果存在一定差异[14]。这可能是在严重缺氧模型中, 细胞酸性产物明显增加, 产生H+速度超过NHE1排出H+速度,长时间严重缺氧导致升高的NHE1蛋白分子功能被抑制[15]。
新近研究发现netrin-1在人和小鼠AS斑块的缺氧区域表达显著上调,同时体外实验研究表明Ox-LDL、缺氧或模拟缺氧以HIF-1α依赖方式上调netrin-1表达,巨噬细胞过表达具有活性HIF-1α亦上调netrin-1及受体UNC5b表达[5]。在此基础上,为了进一步研究netrin-1抑制巨噬细胞迁徙的具体机制,猜测NHE1是否参与netrin-1抑制巨噬细胞迁徙途径,从而促进AS斑块的发生发展?本实验结果显示NHE1及netrin-1均可在粥样斑块中表达,且两者存在部分共定位情况。为进一步探讨在AS细胞水平两者是否存在一定的相互影响关系。本研究以小鼠巨噬细胞RAW264.7细胞为实验对象,给予Ox-LDL干预,可见NHE1及netrin-1蛋白表达随Ox-LDL浓度的增加而上调,且在100 g/mLOx-LDL的作用下RAW264.7细胞NHE1及netrin-1蛋白表达水平最高。而在NHE1基因敲降后,可逆转Ox-LDL作用下NHE1及netrin-1蛋白表达水平的上调。
由此可见,斑块中缺氧巨噬细胞可同时上调netrin-1及NHE1表达,netrin-1抑制巨噬细胞迁徙,推测NHE1极可能通过某种特定机制参与或调节netrin-1这一效应。目前,国内外针对netrin-1及NHE1共表达及定位的研究较少,本研究会进一步定位NHE1与netrin-1,探讨两者的表达分布特点及规律,以期揭示NHE1分子的重要功能位点在netrin-1介导巨噬细胞潴留中的作用及机制,丰富和发展AS斑块缺氧生物学理论依据。
