人参皂苷Rb1对脂多糖诱导的BV2小胶质细胞激活的抑制作用
2020-06-09马振滨孙宪昌
王 倩 马振滨 刘 琪 孙宪昌
1.滨州医学院附属医院健康体检中心,山东 滨州 256600;2.山东第一医科大学(山东省医学科学院)基础医学院,山东 泰安 271000
神经系统退行性疾病(neurodegenerative diseases,NDDs)是一类以特定脑区神经元退化和不可逆性丢失为特征伴有脑功能不可逆损伤的病变,包括帕金森病(Parkinson's disease,PD)、阿尔茨海默病(Alzheimer's disease,AD)、亨廷顿病(Huntington's disease, HD)和肌萎缩性侧索硬化症(amyotrophic lateral sclerosis,ALS)。目前,约有3 000万人受NDDs的影响,严重威胁人类的健康[1]。因为NDDs的确切发病机制仍不清楚,所以临床上缺乏有效的治疗方法。近年来的研究显示以小胶质细胞激活为特征的神经炎症反应在NDDs的发生和发展过程中起着决定性作用[1]。小胶质细胞是中枢神经系统固有的免疫监视细胞,受到炎性刺激后可以迅速激活,是脑内炎症反应的重要标志。小胶质细胞过度激活可释放大量的具有损伤作用的炎症介质,导致神经元进行性、不可逆的损伤,这与PD、AD等NDDs密切相关[2-3]。因此抑制小胶质细胞的激活,减少致炎介质的释放成为了筛选治疗或延缓NDDs药物的重要靶点。
我国具有丰富的中药资源,其中许多中药或中药单体都具有一定的抗炎作用。从中筛选出有效而且副作用小的抗炎药物已成为目前研究的热点。人参皂苷Rb1是我国传统补虚要药人参的主要有效成分,具有丰富的生理学活性和药理学作用。既往研究显示Rb1具有抗氧化、清除体内自由基及对抗细胞凋亡的作用,对神经系统具有营养和保护作用[4]。而近年来的研究则表明Rb1具有较好的抗炎活性,对神经炎症导致的各种神经退行性疾病可能具有一定的治疗作用[5];但是相关方面的研究较少。本研究选用BV2小胶质细胞系,利用脂多糖将其激活;观察Rb1对炎症因子释放的影响并探讨其可能的机制,为进一步了解Rb1的抗炎作用及机制、寻找NDDs的治疗药物提供实验依据。
1 材料与方法
1.1 药品与试剂
人参皂苷Rb1购自上海同田生物技术有限公司,纯度为99%;BV2小胶质细胞购自北京协和细胞资源中心;LPS购自美国Sigma公司;噻唑蓝MTT购自美国Amresco公司;反转录试剂盒购自Roche公司;SYBRGreen试剂盒购自美国QIAGEN公司;PCR引物由宝生物工程(大连)有限公司设计并合成;BCA试剂盒及RIPA裂解液购自碧云天公司;兔抗COX-2抗体及iNOS抗体购自英国Abcam公司;兔抗-磷酸化IkB抗体、兔抗-IκB抗体购自美国Cell signaling公司。
1.2 主要仪器
倒置显微镜,日本奥林巴斯公司;多功能酶标分析仪,深圳雷社生命科学股份有限公司;CO2培养箱,美国Thermo Electron Corporation公司;PCR仪,BioRad公司;实时荧光定量PCR仪,Eppendorf公司;UVP Biospectrum,美国UVP公司。
1.3 细胞培养
将BV2小胶质细胞置于含有体积分数0.10胎牛血清、100 KU/L青霉素和100 mg/L链霉素的DMEM高糖培养液中,在37℃,5% CO2培养箱中常规培养。待细胞融合至80%~90%时应用于后续实验。
1.4 实验方法
1.4.1MTT法检测细胞存活率
取对数生长期的BV2细胞,以5×107/L的密度接种于96孔板,每孔100 μL。将细胞分为对照组、LPS组(用1 μg/mL的LPS处理细胞24 h)、Rb1组(50 μM的Rb1处理细胞24 h)、Rb1+LPS组(应用1 μg/mL的LPS和不同浓度的Rb1同时处理细胞24 h,Rb1的浓度分别是10、20、50 μM)。处理完成后,每孔加入0.5% MTT溶液20 μL,37℃孵育4 h;吸去孔内培养液,每孔加入150 μL DMSO溶液,低速振荡10 min后用酶标仪检测波长570 nm处的吸光度(A)值,计算细胞存活率。细胞存活率=实验组OD值/对照组OD值。
1.4.2实时反转录聚合酶反应(real time RT-PCR)检测TNF-α和IL-1β mRNA水平变化
取对数生长期的BV2小胶质细胞,以每孔2×105个/mL的密度接种于6孔板,每孔3 mL,细胞的分组及处理同前“2.1”项。细胞处理完毕后,采用Trizol法提取总RNA,然后取2 μg总RNA进行逆转录获得cDNA,继而应用设计好的目的基因的引物进行扩增,采用SYBRGreen染料法检测TNF-α、IL-1β及管家基因GAPDH的表达。以上操作均严格按照试剂盒说明书进行。最终,根据反应CT值,应用2-ΔΔCT法计算待测样品中目的基因的相对数量。
本实验所应用的目的基因引物为TNF-α, F 5′-TAT GGC CCA GAC CCT CAC A-3′,R 5′-GGA GTA GAC AAG GTA CAA CCC ATC-3′;IL-1β,F 5′-ACC TGG GCT GTC CTG ATG AGA GG-30-3′,R 5′-TGT TGA TGT GCT GCT GCG AGA T30-3′;GAPDH,F 5′-TGT GTC CGT CGT GGA TCT GA-3′,R 5′-TTGCTG TTG AAG TCG CAG GAG-3′。
1.4.3免疫印迹法(Western blot)检测iNOS、COX-2、IKK、phospho-IKK、IκB及phospho-IκB蛋白水平的变化
取对数生长期的细胞,以每孔2×105个/mL的密度接种于6孔板,每孔3 mL,细胞的分组及处理同MTT实验。细胞经药物处理后弃掉培养液,用冰冷的无菌0.01 M PBS洗涤1次,用含1 mM蛋白酶抑制剂PMSF的RIPA溶液100 μL裂解细胞提取蛋白。应用BCA法检测蛋白浓度,各组取等量蛋白(20 μg)进行聚丙烯酰胺凝胶(10%)电泳,然后将凝胶中分离的蛋白转到硝酸纤维素薄膜上(PVDF膜),PVDF膜用5% 脱脂牛奶封闭后一抗COX-2 (1∶1 000),iNOS (1∶2 000), IκB (1∶1 000), phospho-IκB (1∶1 000), IKK and phospho-IKK (1∶1 000) ,β-actin (1∶5 000) 4℃孵育过夜。再将膜转移至二抗工作液(1∶10 000)中室温摇床孵育1 h,然后用ECL化学发光底物液(临用前将酶底物与加强发光剂按1∶1体积比混匀)进行显色,应用美国UVP Biospectrum 810全自动化学发光成像分析系统对Western blot结果显影并进行积分光密度(integrated optical density, IOD)测定。测量结果以目的蛋白与β-actin的比值进行统计学分析。
1.4.4统计学处理
2 结 果
2.1 LPS及Rb1对BV2小胶质细胞活性的影响
细胞分别经LPS(1 μg/mL)、Rb1(50 μM)、LPS+Rb1(10、20、50 μM)处理24 h,应用MTT法检测其对BV2小胶质细胞存活的影响。结果显示,各组细胞之间均无明显差异(图1),说明LPS及Rb1对BV2小胶质细胞的存活均没有影响,既不促进其增殖,也不会引起细胞毒性。
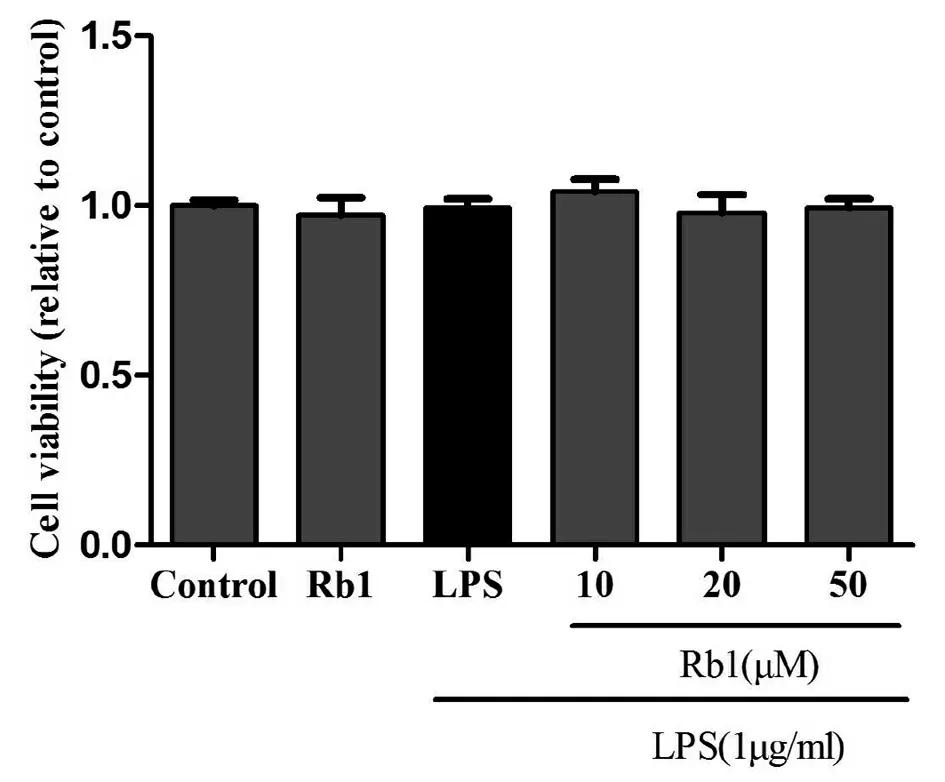
图1 人参皂苷Rb1对BV2小胶质细胞存活率的影响(n=3)
2.2 Rb1对LPS诱导BV2小胶质细胞TNF-α和IL-1β mRNA表达的影响
为了评估Rb1对LPS诱导的炎症反应的抑制作用,我们应用RT-PCR方法检测了LPS诱导的小胶质细胞TNF-α和IL-1β mRNA的表达变化及Rb1处理对其产生的影响。结果如图2所示,应用LPS处理BV2小胶质细胞24 h后,炎症因子TNF-α和IL-1β mRNA的表达量较对照组均明显升高;而应用不同浓度的Rb1共处理后,TNF-α和IL-1β mRNA的表达量均有不同程度的下降,其中20 μM与50 μM人参皂苷Rb1对LPS的抑制作用较为明显,具有统计学意义;而20 μM与50 μM组相比较并无明显差异(表1)。
2.3 Rb1对LPS诱导BV2小胶质细胞内iNOS及COX-2蛋白表达的影响
为了评估Rb1对LPS诱导的炎症反应的抑制作用,应用Western blot检测了小胶质细胞内促炎酶iNOS及COX-2蛋白表达的变化。结果如图3所示,LPS处理BV2小胶质细胞后可使iNOS及COX-2的表达量明显增加,应用Rb1处理后,iNOS及COX-2的表达量均有不同降低,其中20 μM和50 μM组与LPS组相比较明显降低,而20 μM与50 μM组相比并无明显差异(表2)。以上结果说明Rb1可通过抑制小胶质细胞内促炎酶的表达减轻炎症反应。
2.4 Rb1对LPS诱导的促炎信号通路NF-κB的抑制作用
为了进一步了解Rb1抑制LPS诱导的炎症反应的作用机制,我们应用Western-blot方法检测了炎症信号通路NF-κB中IκB、IKK及其磷酸化水平的变化。结果如图4显示,与对照组相比,应用LPS处理BV2小胶质细胞24 h后,IκB、IKK的磷酸化水平明显升高;而同时应用Rb1处理后,磷酸化IκB、IKK的水平明显降低(表3)。提示Rb1抑制炎症反应的机制可能与其抑制NF-κB信号通路有关。
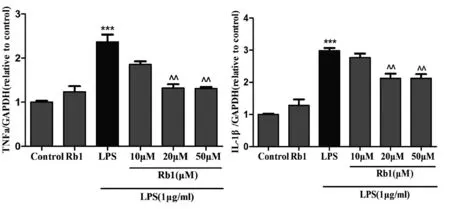
***P<0.001,vs.对照组;^P<0.05,^^P<0.001,vs.LPS组。

表1 人参皂苷Rb1对LPS诱导的BV2小胶质细胞TNF-α和IL-1β mRNA表达的影响(n=3)
注:与对照组比较,***P<0.001;与LPS组比较,^^P<0.01。

**P<0.01,***P<0.001,vs.对照组;^P<0.05,vs.LPS组。

表2 人参皂苷Rb1对BV2小胶质细胞iNOS及COX-2蛋白表达的影响(n=3)
注:与对照组比较,**P<0.01,***P<0.001;与LPS组比较,^P<0.01。
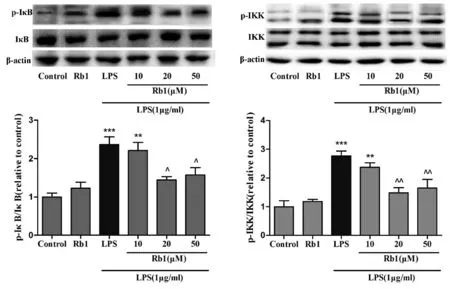
**P<0.01,***P<0.001,vs.对照组;^P<0.05,^^P<0.01,vs.LPS组。

表3 人参皂苷Rb1对BV2细胞内I(B及IKK蛋白磷酸化水平的影响(n=3)
注:与对照组比较,***P<0.001;与LPS组比较,^P<0.01,^^P<0.001。
3 讨 论
越来越多的证据表明以小胶质细胞激活为特征的神经炎症在NDDs的发病过程中起着关键性的作用。小胶质细胞是中枢神经系统固有的免疫监视细胞,约占脑内细胞总数的12%,生理情况下呈分枝状的静止状态,对周围环境变化十分敏感,当受到炎性刺激后可以迅速激活并伴随着细胞形态、抗原表型及功能的改变,是脑内炎症反应的重要标志[3,6-7]。小胶质细胞的适度激活对于组织损伤后的修复及维持脑内微环境的稳态具有重要作用;但是炎症刺激持续存在会导致小胶质细胞的长期过渡激活并释放大量的促炎因子(IL-1β、IL-6、TNF-α、ROS、NO),造成神经元的损伤[8-10]。因此,抑制小胶质细胞的过度激活成为治疗或延缓NDDs的新策略。本实验在细胞水平上观察了人参皂苷Rbl对LPS诱导的小胶质细胞的抑制作用,并初步探讨了其可能的机制。
LPS是革兰氏阴性细菌细胞壁的主要成分,与可溶性LPS结合蛋白(LPS binding protein, LBP)及CD14形成复合物后,作用于小胶质细胞膜表面的Toll样受体4(Toll-like receptor 4,TLR4),从而导致细胞内信号通路蛋白激酶的激活,多种促炎因子、自由基合成酶基因转录的上调,促进小胶质细胞的炎症反应,是一种强有力的炎症诱导剂[11-12]。本实验中发现应用LPS处理后的小胶质细胞炎症因子(IL-1β、TNF-α)及炎症介质(iNOS、COX-2)的表达量明显升高,说明应用1 μg/mL的LPS能明显激活BV2小胶质细胞,能够模拟炎症反应中小胶质细胞的变化过程及作用。在此基础上,我们应用人参皂苷Rb1进行干预,观察Rb1抑制小胶质细胞炎症反应的效果,结果显示Rb1能够剂量依赖性的抑制促炎介质IL-1β、TNF-α、iNOS及COX-2的表达,进一步证实了Rb1具有一定的抗炎作用,能抑制炎症反应中小胶质细胞的过渡活化及其带来的损伤,其神经保护作用可能与此作用有关。
人参皂苷(ginsenosides)是人参的主要活性成份,它是由30个碳原子组成的三萜达玛烷环类衍生物。目前已经从不同人参中分离提取出80余种单体,根据化学结构分为人参二醇(Rb1, Rb2, Rb3, Rc, Rd, Rg3, Rh2, Rs1 )、人参三醇(Re,Rf, Rg1, Rg2, Rh1)和齐墩果酸型3种皂苷。其中Rb1是人参皂苷中含量最为丰富的单体成分,近年来研究已证实人参皂苷Rb1是人参作用于中枢神经系统的主要成分之一,具有神经营养和神经保护作用[4,13-14]。虽然关于人参皂苷Rb1作用的研究很多,但其相应的机制并未完全清楚,多数研究主要关注其抗氧化、抗凋亡、保护血脑屏障方面的作用,关于其抗炎作用及其机制的研究相对较少[5,15-16]。本研究为了进一步揭示人参皂苷Rb1的抗炎作用机制,在实验中观察了炎症相关的NF-κB信号通路的相关变化。NF-κB是一种与炎症密切相关的转录调节因子,静息状态下,存在于胞浆中,与抑制性蛋白(IκB)结合,当细胞被激活时,特异性激酶可将IκB磷酸化,使其快速被蛋白小体降解,NF-κB与IκB解离并释出,进入细胞核,与靶基因启动子区特定结合序列结合,增加相关基因转录速度,促进了多种炎症介质的表达[17]。NF-κB激活主要受到 IκB和蛋白激酶(IKK)的调节,活化的IKK能够诱导 IκB磷酸化,继而激活NF-κB,因此抑制IκB和IKK活性,进而阻断 NF-κB通路,抑制小胶质细胞的激活,已成为筛选抗神经炎症的天然产物的重要靶点[18-19]。已有研究发现人参皂苷可通过抑制NF-κB通路减轻RAW264.7巨噬细胞内炎症因子的释放[20]。本研究观察了人参皂苷Rb1对该通路的影响,发现应用人参皂苷Rb1可明显抑制BV2小胶质细胞内 IκB和IKK的磷酸化水平,进一步证实Rb1的抗炎及神经保护作用可能与其抑制NF-κB信号通路激活密切相关。
我国药用植物丰富、种类繁多、药用历史悠久,对天然产物特别是中药的活性成分进行抗神经炎症的筛选,已成为治疗神经退行性疾病的新亮点。本研究应用BV2小胶质细胞,观察了人参皂苷Rb1的抗炎作用,证实了Rb1可通过抑制炎症信号通路NF-κB减少炎症介质的释放,在中枢神经系统可发挥抗炎及神经保护作用;这为寻找神经退行性疾病新的治疗靶点提供了重要参考。当然,Rb1的抗炎作用机制及在动物体内的抗炎效果还需要进一步的研究证实。
