硅渣与石灰对含硅碱液的协同脱硅作用
2020-06-08徐颖鹏李军旗陈朝轶
徐颖鹏 李军旗 陈朝轶
摘 要:碱浸脱硅处理高硅铝土矿时,会产生大量的含硅碱液,要实现其循环利用,需对含硅碱液进行脱硅。本文分别以初始硅渣、焙烧硅渣、硅渣与石灰混合为脱硅剂,对比考查含硅碱液的脱硅效果,并分析脱硅机理。结果表明,当添加25 g/L的初始硅渣时,脱硅率仅为47.96%;将硅渣在600 ℃焙烧后,脱硅率提升至66.67%。焙烧后的硅渣明显提升了脱硅活性,当混合添加25 g/L焙燒硅渣和钙硅比为1的CaO,脱硅率达到93%,主要是硅渣作为异相成核的晶核 ,在脱硅过程中的晶体生长以及CaO的协同脱硅作用,混合添加焙烧渣和CaO的高脱硅能力为氧化铝工业生产提供了再循环脱硅剂,并为含硅碱液的循环利用提供了可能性。
关键词:高硅铝土矿;脱硅剂;焙烧;氧化钙;硅渣
中图分类号:TF09
文献标识码: A
在利用拜耳法对低品位一水硬铝石型铝土矿进行溶出前,通常会采用进行焙烧-碱浸法[1-2]对高硅铝土矿石进行脱硅处理,在利用苛碱溶液对矿石进行碱浸脱硅的过程中,产生了大量的含硅碱液,这些含硅碱液中含有大量的硅和碱,同时含有极少量的氧化铝,合理回收利用该含碱硅酸盐溶液,成为当前亟待解决的问题[1-3]。
采用石灰对含硅碱液进行脱硅[3],此过程会产生一定量的脱硅渣,即本文所指的硅渣,直接排放不利于环境保护,由于硅渣含有结晶度较低的硅酸钙化合物[4-7],且附聚作用比较明显,颗粒内部含有未反应的氧化钙[7-10],将其进行焙烧并球磨,可以作为脱硅剂[10-15],同时起到晶核的作用,相关研究鲜有报道。因此,本文重点围绕硅渣与石灰的协同脱硅效应,对含硅碱液进行脱硅,考查单一添加硅渣、硅渣与石灰混合作为脱硅剂,对含硅碱液脱硅的影响,并确定较佳脱硅条件,为含硅碱液及硅渣的循环利用奠定基础。
1 试验原料与方法
1.1 原料
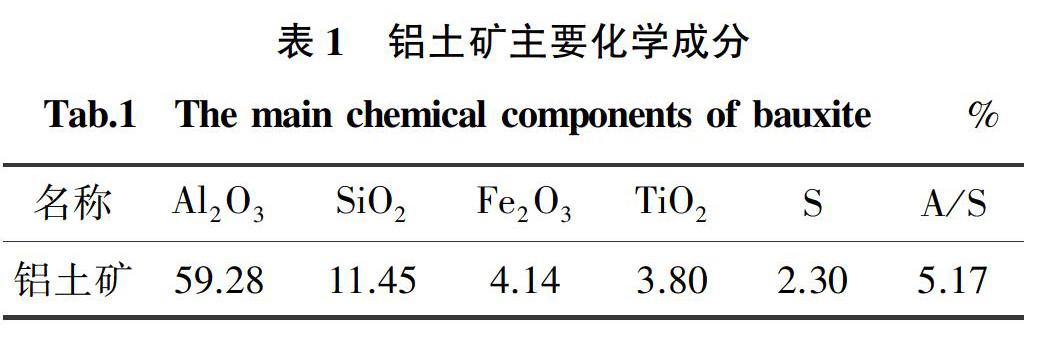
氢氧化钠(上海,国药集团化学试剂有限公司,分析纯,96.0%)与比电导率为0.1 μS/cm-1的去离子水用于配制碱液;铝土矿、石灰石均取自贵州某氧化铝厂,铝土矿的主要化学成分如表1所示,石灰有效钙(CaO)含量为80%,将石灰研磨至粒径小于74 μm备用。
1.2 分析仪器
通过硅钼蓝分光光度法测定碱浸脱硅液中的二氧化硅浓度;通过能量色散X射线荧光光谱(EDX-LE,津岛,日本)测量硅渣的成分。通过X射线衍射(Xpert Proder 帕纳科,荷兰)获得活性种子的XRD图案。
1.3 试验方法
在恒温磁力搅拌器中,按10∶1的液固比,在95 ℃下持续搅拌30 min对焙烧后的铝土矿进行碱浸脱硅。并将所制得的含硅碱液在常温下储存在聚乙烯瓶中,在2 d内使用。脱硅溶液中SiO2浓度为7~9 g/L左右,苛性碱(Na2Ok)浓度约90~110 g/L。
添加适量脱硅剂,其中石灰添加量以Ca/Si摩尔比计算而得(Ca为石灰中有效钙含量,Si为含硅碱液中硅含量),采用恒温电磁加热搅拌油浴反应器,在温度为95 ℃、搅拌强度为300 r/min条件下对含硅碱液进行脱硅,真空抽滤,收集硅渣,干燥后称重,将其研磨至74 μm,备用。
脱硅试验均在常压下进行,通过化学滴定法分析溶液中硅酸盐离子的浓度,使用XRF检测其固体样品成分,使用TG-DTA结合XRD进行固体样品的物相分析。
CaO添加量和含碱硅酸盐脱硅率的计算方法如下:
2 试验结果与讨论
21 硅渣成分与物相分析
固定试验条件:含硅碱液浓度为106 g/L;初始SiO2浓度为8 g/L; Ca/Si摩尔比为1.2;反应温度368 K;反应时间2 h;搅拌速度为300 r/min。
硅渣制备:以石灰为脱硅剂,选取两种钙硅比(C/S=1、1.2)下产生的硅渣[3],其成分如表2所示。
由表2可知,钙硅比为1.2时产生的硅渣钙含量较高,对两种硅渣进行XRD分析,其结果如图1所示。
由图1可知,两种钙硅比下产生的硅渣都检测到Ca(OH)2,这表明在脱硅过程中Ca(OH)2并未完全反应完,且95 ℃时下的硅渣产物含硅物相主要为CaO·SiO2·H2O(I)和Ca5Si5Al(OH)O17·5H2O,但硅渣产物结晶度较差[6-12]。
两种硅渣产物的差热-热重分析结果如图2所示。由图2可知,硅渣的差热曲线在50 ℃左右出现的吸热峰为硅渣脱去了自由水,140 ℃时出现的吸热峰,主要为结晶水的脱除,CaO·SiO2·H2O(I)和Ca5Si5Al(OH)O17·5H2O中的结晶水被脱除。440 ℃左右出现的吸热峰主要是由于CO2-3的受热分解,600~700 ℃之间比较宽的吸热峰为Ca(OH)2转变为CaO,并有一定的物相转变发生。这是由于SiOAl
链的分解,并伴有SiOH链的裂解和发生了脱羟基的变化[6-7,12,16]。
2.2 添加单一初始硅渣的效果
为了解焙烧条件对脱硅效率的影响,收集氧化钙处理含硅碱液所得到的硅渣产物,将其作为脱硅剂。根据已有的报道[3],控制最佳试验条件:取200 ml的含硅碱液,反应时间2 h;磁力搅拌器的转速300 r/min;反应温度为95 ℃,控制未焙烧硅渣(C/S=1和C/S=1.2)的添加量为5、10、15、20、25 g/L,硅渣添加量对含硅碱液脱硅的影响结果如图3所示。
图3结果表明在比较未焙烧硅渣(C/S=1和C/S=1.2)进行溶液脱硅时,CaO按钙硅比为1.2脱硅产生的硅渣进行溶液脱硅时,脱硅效果更佳,添加25 g/L未焙烧硅渣(C/S=1.2)脱硅率可达4796%。由于CaO按钙硅比为1.2脱硅产生的硅渣含有的CaO较多,在溶液中进行反应时渣与溶液的接触面积更多,反应更彻底,脫硅效果则较好[3]。所以相比CaO按钙硅比为1脱硅产生的硅渣能增加2%以上的脱硅率。综上所述,CaO按钙硅比为1.2脱硅产生的硅渣更有利于溶液的脱硅,并控制硅渣添加量为25 g/L。
结合图3和差热-热重分析结果,由于硅渣的结晶度对脱硅可能产生一定的影响[15],为了提高结晶度,从而考察其脱硅效果,将两种钙硅比(C/S=1和C/S=1.2)锐硅后所产生的硅渣产物在100、300、600、900 ℃下煅烧30 min,然后将焙烧产物作为脱硅剂进行脱硅。
2.3 添加单一焙烧硅渣的效果
通过比较加入焙烧硅渣(C/S=1和C/S=1.2)进行溶液脱硅,了解不同温度焙烧下的硅渣对脱硅效率的影响。硅渣焙烧温度为0、100、300、600、900 ℃。
溶液脱硅的试验条件为:取200 mL含硅碱液,在95 ℃下反应2 h; 转速300 r/min;焙烧硅渣(C/S=1.2和C/S=1)加入量25 g/L对含硅碱液进行脱硅,焙烧渣对溶液脱硅的影响结果如图4所示。
由图4可知,通过探究硅渣经过不同温度焙烧后对碱液脱硅效果的影响,随着焙烧温度的升高,脱硅率升高,焙烧温度在600 ℃时脱硅效果达到最高点;而焙烧温度超过600 ℃时,脱硅率反而下降。添加C/S=1产生的焙烧渣作为脱硅剂,溶液脱硅率为6209%,而添加C/S=1.2产生的焙烧渣,溶液脱硅率可以达到6667%。因此,焙烧温度较高时,用焙烧渣进行实验时脱硅效果更好,最佳焙烧温度为600 ℃。
2.4 添加焙烧硅渣和CaO的效果
如果添加高硅钙比(C/S> 1)的石灰,则无疑要增加CaO的添加量,这将大大增加脱硅的成本,因此降低脱硅成本的前提是加入的CaO尽可能少。通过单独添加焙烧硅渣,发现其具有一定的脱硅效果,为实现对该固废的有效回收利用,考虑将CaO同时混合添加适当数量的硅渣作为脱硅剂,这符合氧化铝生产的经济利益和冶金清洁生产的要求[3,18-20]。
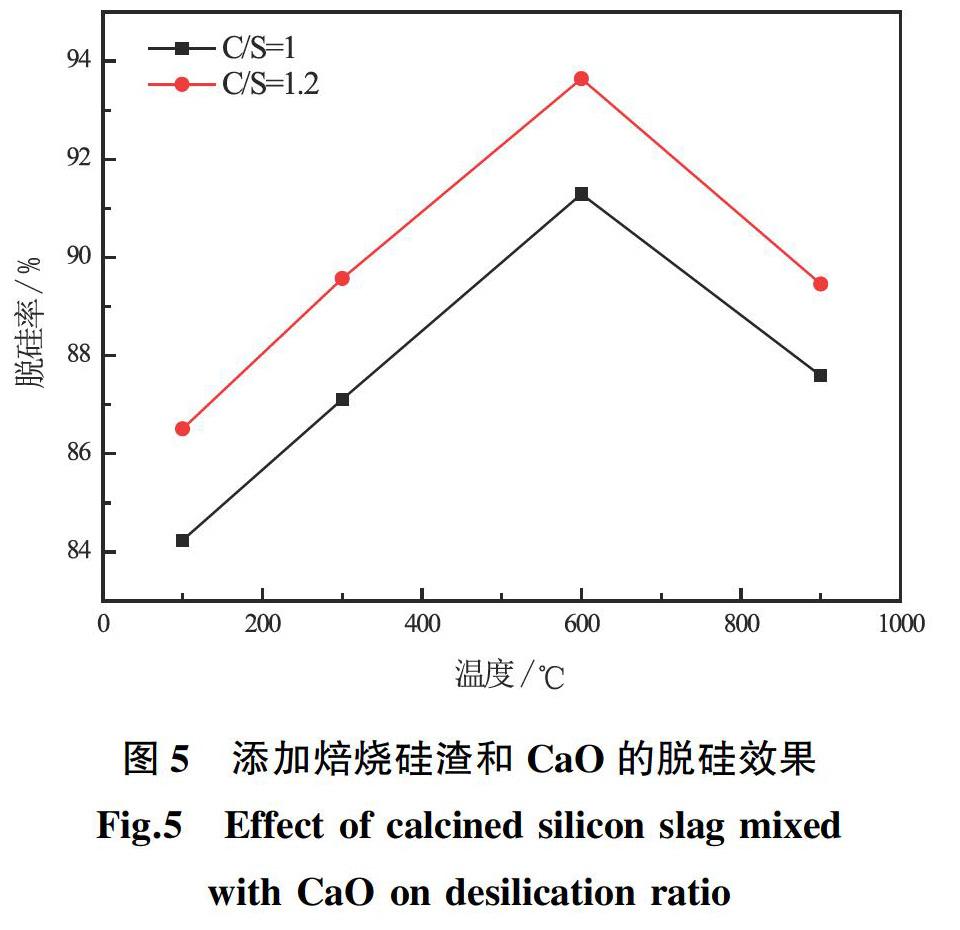
根据上述实验,控制25 g/L的焙烧硅渣(C/S=1和C/S=1.2)和CaO (C/S=1)的添加条件:取200 mL脱硅液,反应时间2 h;反应温度95 ℃;搅拌速度300 r/min。选取焙烧温度梯度在100、300、600、900 ℃所产生的焙烧渣,从而探究焙烧渣与石灰混合作为脱硅剂时,不同焙烧温度对溶液脱硅的影响,脱硅效果如图5所示。
试验结果表明,焙烧硅渣与石灰混合作为脱硅剂时,脱硅率随着焙烧温度的升高而升高,由于二者的协同效应,总体脱硅率比单加焙烧硅渣效果要好。而600 ℃的焙烧硅渣(25 g/L)与石灰(C/S=1)混合的脱硅效果最好,脱硅率可以达到93%。而焙烧温度继续升高到900 ℃时,加入石灰脱硅效率反而下降,这与单加焙烧渣所得到的规律一致。
结合图4和图5结果可知,硅渣的焙烧温度并不是越高越好。相比单加煅烧硅渣的脱硅效果,用焙烧硅渣(C/S=1.2)和CaO(C/S=1)混加进行脱硅试验中,脱硅率增加了20%~25%左右,
适量石灰的加入大大减少了溶液中的硅含量,显著提高了脱硅效率。分析得出硅渣的焙烧硅渣温度在600 ℃为宜,焙烧硅渣与石灰混合添加时,由于协同脱硅效应,从而可以达到深度脱硅的效果,这对接下来碱液的回收,以及进一步进行碱液的循环脱硅有很大影响[1-3]。
2.5 机理分析
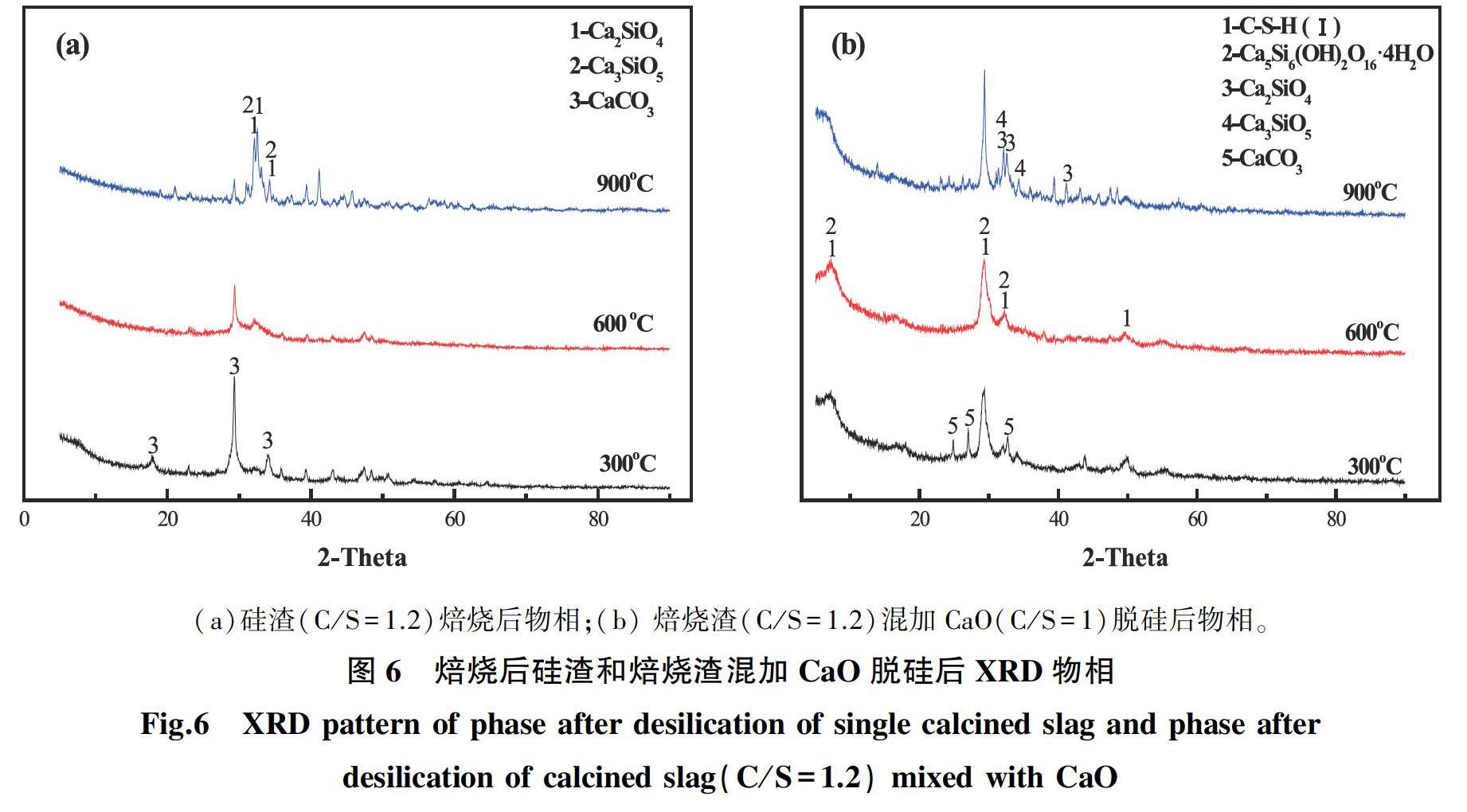
由上述确定的最佳脱硅实验条件,即焙烧硅渣(C/S=1.2)和CaO(C/S=1)混合添加进行脱硅所产生的脱硅产物进行XRD物相分析,以揭示其脱硅机理,其结果如图6所示。
对比图1和图6(a)可知,600 ℃和900 ℃的焙烧渣几乎不存在CaCO3,且焙烧温度较高时,从600 ℃开始,出现微弱的Ca2SiO4和Ca3SiO5的衍射峰[14-17],说明在600 ℃左右开始发生相变,且到600~900 ℃左右衍射峰开始变强,结晶度开始变好,这与图2的热重分析结果一致。如图6(b)所示,在将焙烧渣和CaO混合添加进行脱硅时,600 ℃焙烧渣的XRD图谱中,其杂峰最少,衍射峰较为平滑,硅酸二钙与硅酸三钙作为晶核时[18-19],由于异形相核作用溶液脱硅过程中会率先生成这两种物相而硅渣中C-S-H(I)和Ca5Si5Al(OH)O17·5H2O的出现,则是由于发生反应(1)和反应(2):
通过同构取代作用,托贝莫来石中的硅被溶液中的铝取代[16-17],从而产生Ca5Si5Al(OH)O17·5H2O
,这与前期的研究结果一致[3]。但此时并没有出现结晶度较好的Ca(OH)2的物相,说明Ca(OH)2基本全部反应,这也证实了图4和图5的试验结果,也就是说,焙烧渣混加CaO具有协同脱硅的效果。
3 结论
(1)硅渣是溶液中的亚稳化合物,得到利用活性CaO进行碱浸脱硅液脱硅的最佳脱硅条件,按C/S=1添加活性CaO,同时混加25 g/L焙烧硅渣(C/S=1.2产生),含碱硅酸盐溶液脱硅率可达到93%;而且石灰混加晶核对比单加晶核的脱硅效果并结合XRD结果,可以推断活性CaO混加晶核进行脱硅时,存在一定的协同作用。
(2)使用焙燒硅渣混加CaO进行脱硅时,硅渣中硅酸二钙与硅酸三钙作为晶核,与溶液中的硅酸根离子反应,在产物中率先生成硅酸二钙和硅酸三钙,同时由于同构取代,含碱硅酸盐溶液中的铝取代托贝莫来石中的硅,形成了铝托贝莫来石,并与结晶度较低的水合硅酸钙附聚作用,大大提高了脱硅效率。这将为氧化铝工业生产中,固废(硅渣)的回收提供一定的理论指导。
参考文献:
[1]SMITH P. The processing of high silica bauxites-review of existing and potential processes[J]. Hydrometallurgy, 2009, 98 (1): 162-176.
[2]RAYZMAN V L, ATURIN A V, PEVZNER I Z, et al. Extracting silica and alumina from low-grade bauxite[J]. JOM, 2003, 55(8): 47-50.
[3]XU Y P, LI J Q, CHEN C Y, et al. Desilication and recycling of alkali-silicate solution for low-grade high-silica bauxite utilization[J/OL]. JOM, 2019, [2019-12-17].DOI: 10.1007/s11837-019-03934-6.
[4]LI X B, LI C Y, ZHOU Q S, et al. Interaction of sodium sulfide with silica-containing minerals in sodium aluminate solution[J]. International Journal of Mineral Processing, 2015, 137:9-14.
[5]PENG H, VAUGHAN J. Aluminate effect on desilication product phase transformation[J]. Journal of Crystal Growth, 2018, 492:84-91.
[6]王仲明, 彭志宏, 齐天贵,等. 从含碱硅酸钠溶液中水热合成硅灰石[J]. 硅酸盐通报, 2017, 36(10):3446-3451.
[7]郭晓潞, 孟凡杰. 水热合成粉煤灰基铝掺杂托贝莫来石的微观结构[J]. 材料研究学报, 2018, 32(7):513-517.
[8]LI X B, ZHAO Z, LIU G H, et al. Behavior of calcium silicate hydrate in aluminate solution[J]. Transactions of Nonferrous Metals Society of China, 2005, 15(5):1145-1149.
[9]CHEN J J, THOMAS J J, TAYLOR H F W, et al. Solubility and structure of calcium silicate hydrate[J]. Cement & Concrete Research, 2004, 34(9):1499-1519.
[10]CHEN F F, ZHANG Y F, JIANG X D, et al. Structure transformation of sodium aluminosilicates as desilication agents in the desilication of highly alkaline sodium aluminate solution containing silica[J]. Microporous and Mesoporous Materials, 2016, 235:224-232.
[11]LIU G H, ZHANG W, QI T G, et al. Influence of silicate anions structure on desilication in silicate-bearing sodium aluminate solution[J]. Journal of Central South University, 2016, 23(7):1569-1575.
[12]TAYLOR H F W. Proposed structure for calcium silicate hydrate gel[J]. Journal of the American Ceramic Society, 1986, 69(6):464-467.
[13]JIANG T, PAN X L, WU Y, et al. Mineral transition of desilication products precipitated in synthetic sodium aluminate solution under atmospheric pressure[J]. Transactions of Nonferrous Metals Society of China, 2018, 28(2):367-375.
[14]LIU G H, HE Q, LI X B, et al. Synthesis and reaction behavior of calcium silicate hydrate in basic system[J]. Transactions of Nonferrous Metals Society of China, 2004, 14(6):1204-1209.
[15]YUAN J, ZHANG Y. Desiliconization reaction in sodium aluminate solution by adding tricalcium hydroaluminate[J]. Hydrometallurgy, 2009, 95(1):166-169.
[16]THOMAS J J, JENNINGS H M, ALLEN A J. Relationships between composition and density of tobermorite, jennite, and nanos-cale CaO-SiO2-H2O[J]. The Journal of Physical Chemistry, 2010, 114(17):7594-7601.
[17]KWAN S, JUDY L R T, GRUTZECK M W. Structures and phase relations of aluminum-substituted calcium silicate hydrate[J]. Journal of the American Ceramic Society, 1996, 79(4):967-971.
[18]RUAN S, SHI L, LI J, et al. Desilication of hematite, goethite and iron powder seeded low alumina to caustic liquors[J]. Hydrometallurgy, 2017, 169:297-305.
[19]SHI L,RUAN S, LI J, et al. Desilication of low alumina to caustic liquor seeded with sodalite or cancrinite[J]. Hydrometallurgy, 2017, 170:5-15.
[20]HONG T, ZHANG Y, LIU M, et al. Desilication of concentrated alkali solution by novel desilication reagent calcium hydroferrocarbonate: Part I. Synthesis of desilication reagent[J]. Hydrometallurgy, 2018, 182:21-26.
(責任编辑:于慧梅)
