外周血SAA、NLR及BNP对COPD合并肺部感染患者预后的评估价值*
2020-06-08王月平袁开芬王应琼孙龙赵国厚尹飞飞
王月平, 袁开芬, 王应琼, 孙龙, 赵国厚, 尹飞飞
(1.海南医学院第一附属医院 感染性疾病科, 海南 海口 570102; 2.昆明医科大学第二附属医院 呼吸内科, 云南 昆明 650101; 3.海南医学院第二附属医院 呼吸内科, 海南 海口 570100; 4.海南医学院 香港大学热带传染病联合实验室, 海南 海口 570100)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为病理特点的呼吸道疾病,以咳嗽、胸闷、呼吸困难、哮喘、嗜睡及意识障碍等为主要的临床表现[1]。COPD具有较高的致残率及死亡率,目前位居全球死亡原因的第4位[2]。肺部感染是COPD常见并发症之一,可使患者病情迁徙难愈,可引发呼吸衰竭及心力衰竭,严重时发生死亡[3]。目前临床治疗COPD合并肺部感染多以平喘、祛痰、吸氧、抗感染为主,虽可一定程度缓解临床症状体征,但其住院死亡率仍可达15%[4],因此早期有效评估COPD合并肺部感染患者的预后、进而给予早期干预,对降低患者死亡率尤为重要。血清淀粉样物质A(serum amyloid A,SAA)是一种急性时相蛋白,由肝细胞产生并释放,能够反映患者机体的炎症程度[5];脑钠肽(brain natriuretic peptide,BNP)是一种由32个氨基酸残基组成的多肽,由心室肌细胞合成并分泌,具有调节肺动脉压、扩张肺血管、排钠利尿的作用[6〗;中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)是一种新兴的炎性标记物,能够反映中性粒细胞和淋巴细胞水平,可用于评估患者炎症反应的程度[7]。既往虽有血清NLR、BNP、SAA与COPD合并肺部感染发生及病情关系的研究报道[8-10],但其与COPD合并肺部感染患者预后的相关性尚不清楚。本研究就血清NLR、BNP、SAA水平对COPD合并肺部感染患者预后的评估价值进行探讨,以期能为临床医生早期评估COPD合并肺部感染预后提供参考,报告如下。
1 资料与方法
1.1 一般资料
经医院医学伦理委员会批准,随机选择2017年10月-2019年10月收治的99例COPD合并肺部感染患者作为合并感染组,103例COPD患者为COPD组,选取同期的50例体检健康者作为对照组。合并感染组男70例、女29例;年龄18~80岁、平均(65.32 ±5.38)岁。COPD组男71例、女32例,年龄20~78岁、平均(65.49 ±5.91)岁。对照组男35例、女15例,年龄19~79岁、平均(64.95±5.22)岁。3组受试者一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)COPD参考《慢性阻塞性肺疾病基层诊疗指南(实践版·2018)》[1]确诊,(2)心、肝、肾功能正常,(3)入院前半个月未应用免疫抑制剂。排除标准:(1)合并凝血系统疾病、恶性肿瘤、喘息性支气管肺炎、间质性肺炎、活动期肺结核、支气管哮喘、精神性疾病、自身免疫性疾病、先天性心脏病、甲状腺疾病,(2)病历资料不完整,(3)住院期间由于其他原因死亡者,(4)哺乳期或妊娠期女性。所有研究对象或家属对本研究知情同意。
1.2 方法
采集受试者清晨空腹静脉血脉血5 mL,静置30 min,采用3-18型德国sigma高速离心机3 000 r/min离心15 min分离血清,采用胶乳免疫比浊法检测血清SAA水平(仪器为贝克曼AU5800全自动生化分析仪,试剂为上海晶抗生物工程有限公司的SAA检测试剂盒),采用化学发光法检测血清BNP水平(仪器为雅培I2000化学发光免疫分析仪,试剂为上海一研生物科技有限公司的BNP检测试剂盒),采用希森美康XN9000全自动血细胞分析仪检测淋巴细胞计数、中性粒细胞计数,计算NLR。
1.3 观察指标
比较3组受试者入院时或体检时的血清NLR、BNP及SAA水平;将COPD合并肺部感染患者根据住院期间预后再分为死亡组(n=12)与存活组(n=87),比较2组入院时血清NLR、BNP及SAA水平,采用Spearman法分析血清NLR、BNP、SAA水平与COPD合并肺部感染患者住院期间死亡的相关性,采用受试者工作特征曲线 (receiver operating characteristic curve,ROC)线下面积(AUC)评估血清NLR、BNP、SAA水平对COPD合并肺部感染患者住院期间死亡的预测价值。
1.4 统计学方法

2 结果
2.1 血清NLR、BNP及SAA水平
结果显示,合并感染组血清NLR、BNP、SAA水平显著高于COPD组和对照组,差异具有统计学意义(P<0.05);COPD组血清NLR、BNP及SAA水平显著高于对照组,差异具有统计学意义(P<0.05)。见表1。

表1 3组受试者血清NLR、BNP及SAA水平Tab.1 Comparison of serum NLR, BNP and SAA levels among the three
注:(1)与合并感染组比较,P<0.05;(2)与COPD组比较,P<0.05。
2.2 COPD合并肺部感染的死亡组与存活组患者血清NLR、BNP及SAA水平
结果显示,死亡组患者血清NLR、BNP及SAA水平显著高于存活组,差异具有统计学意义(P<0.05)。见表2。

表2 COPD合并肺部感染死亡或存活组患者血清NLR、BNP及SAA水平Tab.2 Comparison of serum NLR, BNP and SAA levels between the death or survival COPD patients with pulmonary
2.3 Spearman相关分析
血清NLR、BNP、SAA水平与COPD合并肺部感染患者住院期间死亡的相关性结果显示,血清NLR、BNP、SAA水平与COPD合并肺部感染患者住院期间死亡呈正相关关系(P<0.05)。见表3。

表3 血清NLR、BNP、SAA水平与COPD合并肺部感染患者住院期间死亡的相关性Tab.3 Correlation between serum NLR,BNP and SAA levels with death of COPD patients with pulmonary infection
2.4 血清NLR、BNP、SAA对COPD合并肺部感染患者住院期间死亡的预测价值
ROC曲线结果显示,血清SAA对COPD合并肺部感染患者住院期间死亡的预测价值明显优于血清BNP(P<0.05),血清NLR对COPD合并肺部感染患者住院期间死亡的预测价值明显优于血清SAA(P<0.05),血清NLR、BNP、SAA联合检测对COPD合并肺部感染患者住院期间死亡的预测价值明显优于各指标单独检测(P<0.05)。见表4、图1。
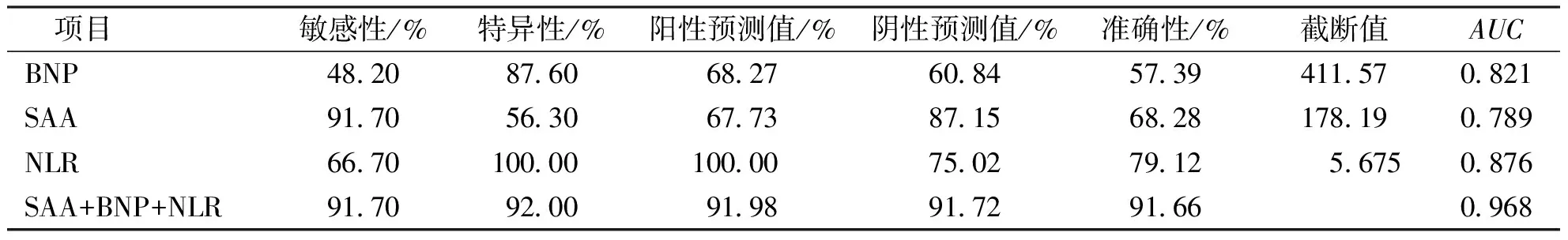
表4 血清NLR、BNP、SAA对COPD合并肺部感染患者住院期间死亡的预测价值Tab.4 Prediction of in-hospital mortality of the COPD patients with pulmonary infection based on serum NLR,BNP and SAA levels
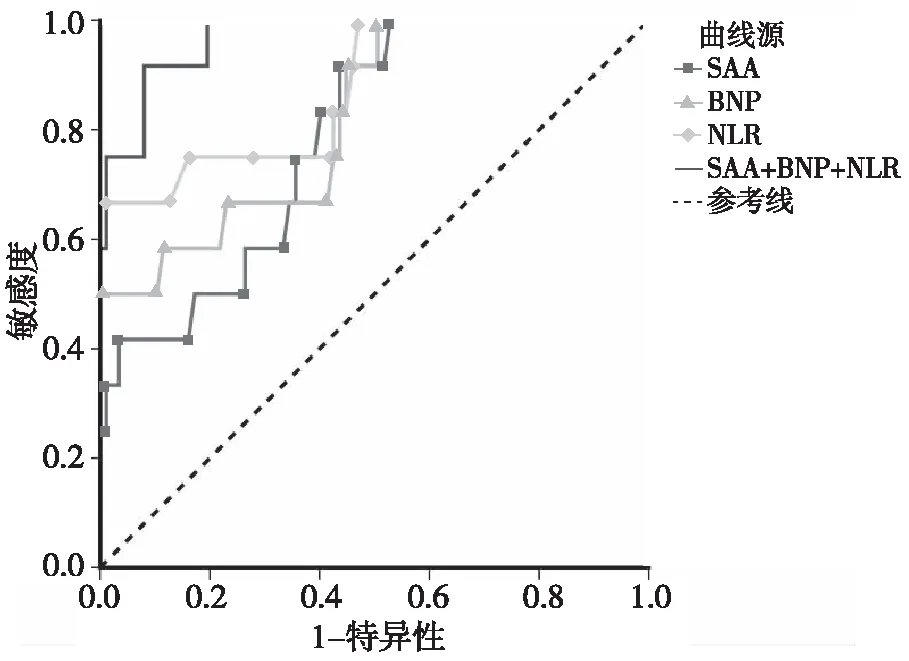
图1 血清NLR、BNP、SAA预测COPD合并肺部感染患者住院期间死亡的ROC曲线Fig.1 ROC curve of the in-hospital mortality prediction of the COPD patients with pulmonary infection based on serum NLR,BNP and SAA levels
3 讨论
COPD是老年呼吸系统系疾病中的常见病、多发病,其发病与粉尘吸入、化学物质吸入、吸烟、呼吸道感染、肺发育不良、气道反应性增高及遗传等因素有关[11]。COPD可影响机体循环系统功能,造成呼吸功能损害,引起各种并发症,危及患者生命[12]。肺部感染是COPD常见并发症之一,可进一步加重COPD病情,影响患者预后,加重患者医疗负担,影响患者生活质量[13]。COPD合并肺部感染的临床转归错综复杂,住院死亡率较高,因此尽早评估COPD合并肺部感染预后并及时给予早期干预措施仍是临床研究的重点。
SAA是一种由肝细胞产生并释放至血液循环的急性时相蛋白,其合成受白细胞介素1(interleukin 1,IL-1)、糖皮质激素(glucocorticoid)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6)等调控,其作用与血清C-反应蛋白(C-reactive protein,CRP)类似,能够反映炎症程度,参与机体各种生理病理过程[14-15]。有研究认为SAA在COPD患者中浓度显著升高,是评估COPD发生及病情危重程度的生物标记物之一[16]。本研究结果显示合并感染组血清SAA水平显著高于COPD组和对照组,COPD组血清SAA水平显著高于对照组,提示SAA在COPD合并肺部感染患者中水平呈现上升趋势。有研究显示COPD合并肺部感染患者外周血中SAA水平明显高于COPD患者[17],与本研究结果一致。 BNP是一种由心室肌细胞合成并分泌的32个氨基酸残基组成的多肽,不仅具有调节血压、舒张血管、促进排钠、利尿、对抗肾素-血管紧张素-醛固酮系统(renin-angiotension-aldosterone system,RAAS)的作用,还具有调节肺血管重构(pulmonary vascular remodeling,PVR)、扩张肺血管、降低肺动脉压(pulmonary artery pressure,PAP)的作用[18-19]。本研究结果显示,合并感染组血清BNP水平显著高于COPD组和对照组,COPD组血清BNP水平显著高于对照组,这与mohammad等[20]的研究结果一致,提示BNP在COPD合并肺部感染患者中呈高表达。NLR是一种新兴的炎性标记物,为中性粒细胞/淋巴细胞比值,可反映中性粒细胞和淋巴细胞水平,评估炎症反应程度,与炎症性疾病发生、发展及预后密切相关[21-22]。近年来NLR在感染性疾病、心血管疾病(cardiovascular disease,CVD)、肿瘤疾病、消化系统疾病、呼吸系统疾病中的应用已有报道[23]。有研究显示COPD合并肺部感染患者血液中炎症细胞水平会迅速上升,导致NLR升高[24],这在本研究中也得到了证实,提示NLR可预测COPD合并肺部感染的发生。分析3项指标升高的原因,当COPD患者合并肺部感染时,导致肺部组织结构异常,通气功能障碍,引起肺部血液受阻,增加肺动脉阻力,导致外周血中BNP升高,同时机体炎症反应加重,导致外周血中NLR、SAA升高。本研究结果显示,死亡组COPD合并肺部感染患者血清NLR、BNP、SAA水平显著高于存活组,提示血清NLR、BNP、SAA水平与COPD合并肺部感染患者住院期间预后有关,本研究后续的Spearman相关分析也证实了这一结论。同时,本研究的ROC曲线还显示外周血NLR、BNP、SAA联合检测对COPD合并肺部感染患者预后具有一定评估价值,血清NLR、BNP、SAA对COPD合并肺部感染患者住院期间死亡的最佳预测值分别为5.675、411.57 ng/L及178.19 mg/L,即COPD合并肺部感染患者入院时血清NLR>5.675、血清BNP水平>411.57 ng/L、血清SAA水平>178.19 mg/L时,则可提示住院期间死亡风险较大。
综上所述,外周血NLR、BNP、SAA联合检测对COPD合并肺部感染患者预后具有一定评估价值,这对指导COPD合并肺部感染患者的临床管理具有重要意义。但本研究样本量较小,研究时间较短,有待加大样本、长期随访进一步研究。
