基于咔唑衍生物的新型磷光主体材料的制备及其性能的研究
2020-06-07沈应中
张 旭 沈应中
(南京航空航天大学 材料科学与技术学院,江苏 南京 210016)
近些年来,有机发光二极管(OLED)由于具有可绕曲、响应快、色域广等优点受到了学术界和商业的广泛关注[1-3]。目前正在逐步实现市场化应用,虽然OLED器件已经较为成熟,但是在延长器件寿命和提高外量子效率等方面仍存在诸多缺陷[4-6]。为了解决上述问题,研发性能出色的OLED材料仍是该领域的研究重点。咔唑及其衍生物由于具有较高的热稳定性、出色的光学和电化学性能而被广泛的研究。由于咔唑为富电子单元,因此其具有传输空穴的特性[7-9]。许多基于咔唑的空穴传输材料已被相继报道。
本文以咔唑为原料,设计合成一系列基于咔唑的磷光主体材料。合成路线简单,产物容易分离提纯,产率较高。材料的结构新颖,表现出较高的热稳定性和出色的光学性能。体现了延长器件使用寿命和提高外量子效率的潜质。
1 实验部分
1.1 药品
咔唑、4-(二苯基胺基)苯基硼酸、4-(1-萘基)苯基硼酸、3,5-二甲基苯硼酸:99 %,其他药品和试剂使用前未纯化。
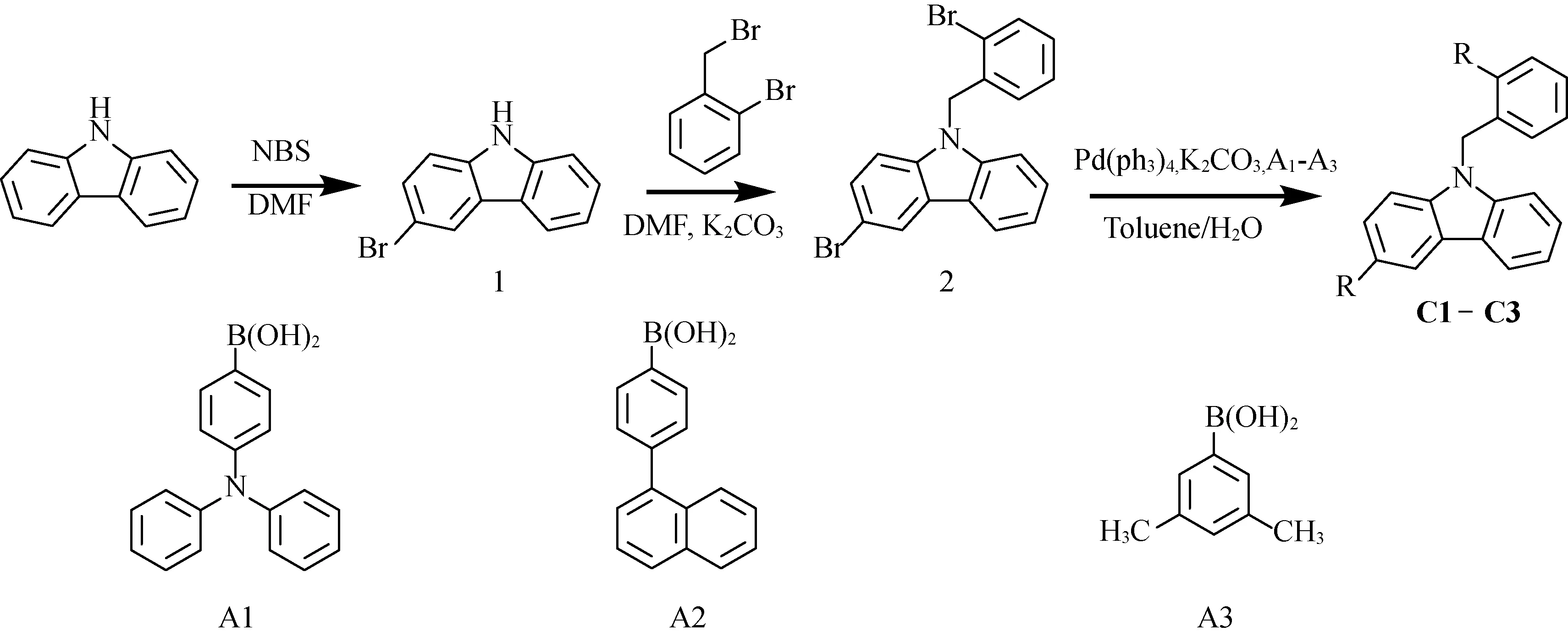
Synthetic route of compound C1-C3
1.2 3-溴咔唑(1)的合成
在100 mL三口瓶中,加入咔唑(0.96 g, 6.00 mmol)、N,N-二甲基甲酰胺 35 mL,在0 ℃搅拌10 min。然后将N-溴代丁二酰亚胺(NBS)(0.58 g,6.00 mmol)溶解到15 mL N,N-二甲基甲酰胺中。然后将配置的NBS的DMF溶液缓慢滴加到母液中,在室温下搅拌1.5 h后,加入蒸馏水30 mL,有白色沉淀析出。过滤,得白色滤饼,用蒸馏水冲洗滤饼2~3次。粗产物用乙醇重结晶,在50 ℃下用真空干燥箱烘干,得白色固体10.22 g,产率80%。
Mp=178~180 ℃.1H NMR(400 MHz, DMSO-d6, δ, ppm): 11.42 (s, 1H, -NH), 8.36 (s, 1H), 8.32 (s, 1H), 8.17 (d,J=8.0 Hz, 1H), 7.45 (m, 4H).13C NMR (101 MHz, DMSO-d6, δ, ppm): 140.6, 138.8, 128.3, 126.8, 124.9, 123.2, 121.9, 121.2, 119.4, 113.3, 111.7, 111.0. Anal. Calcd. For C12H8NBr: C, 58.56; H, 3.28; Br 32.47; N, 5.69. Found: C, 58.53; H, 3.25; Br, 32.52; N, 5.69.
1.3 3-溴-9-(2-苄溴基)咔唑(2)的合成
在250 mL三口瓶中加入3-溴咔唑(1.55, 5.0 mmol)、K2CO3(12.0g, 105 mmol)、邻溴苄溴(0.34g, 5.0 mmol)和N,N-二甲基甲酰胺(DMF) 45 mL。在60 ℃下加热搅拌6 h。TLC点板跟踪,待反应完毕后停止加热,冷却至室温。将反应液缓慢滴加至冰水中,边滴加边搅拌,滴加完毕后在冰水中冷却10 min,有大量白色固体析出,减压抽滤,滤饼用蒸馏水清洗3次。粗产物用乙醇重结晶。得白色固体1.44 g。产率:80 %。
Mp: 210~212 ℃.1H NMR (400 MHz, DMSO-d6, δ, ppm): 8.47 (s, 1H). 8.27 (d,J=8.0 Hz, 1H), 7.73 (d,J=8.0 Hz, 1H), 7.57 (d,J=8.0 Hz, 1H), 7.47 (m, 3H), 7.26 (t,J=8.0 Hz, 1H), 7.20 (t,J=8.0 Hz, 1H), 7.12 (t,J=8.0 Hz, 1H), 6.30 (d,J=6.4 Hz 1H), 5.67 (s, 2H).13C NMR (100 MHz, DMSO-d6, δ, ppm): 141.0, 133.2, 129.7, 128.5, 127.6, 127.1, 124.7, 123.5, 122.3, 121.5, 120.3, 112.0, 111.9, 110.1, 46.7. Anal. Calcd. For C19H13Br2N: C, 54.94; H, 3.16; Br, 38.50; N, 3.37. Found: C, 54.93; H, 3.13; Br, 38.55; N, 3.37.
1.4 化合物C1-C3的合成方法
在氮气保护下,在50 mL三口瓶中加入化合物(2)(0.30 g, 0.723 mmol)、芳基硼酸(1.446 mmol)、Pd(PPh3)4(0.0167 g, 0.0145 mmol),无水K2CO3(0.40 g, 2.89 mmol)、甲苯(15 mL)和水(7.5 mL)。在110 ℃下反应8 h后停止搅拌。冷却至室温。用甲苯萃取反应液,收集有机层,用无水MgSO4干燥过夜。减压抽滤。滤饼用甲苯清洗2~3次。蒸掉溶剂,粗产物用柱层分离(正己烷:二氯甲烷=8:1)。得到白色固体。
1.4.12′-(3-(4-(二苯胺基)苯基)-9H-咔唑-9-基)甲基)-N,N-二苯基-[1,1′-联苯]-4-胺(C1)
Mp=251~253℃.1H NMR (400 MHz, DMSO-d6, δ, ppm): 8.46 (d, J=1.2 Hz, 1H), 8.24 (d, J=7.6 Hz, 1H), 7.66 (m, 3H), 7.49, (d, J=8.4 Hz, 2H), 7.27-7.34 (m, 13H), 7.21 (t, J=7.6 Hz, 1H), 7.04-7.13 (m, 17H), 6.59, (d, J=7.6 Hz, 1H), 5.64 (s, 2H). Anal. Calcd. For C55H41N3: C, 88.8; H, 5.56; N, 5.65. Found: C, 88.70; H, 5.51; N, 5.65.
1.4.29-(4′-(萘-1-基)-[1,1′-联苯]-2-基)甲基)-3-(4-(萘-1-基)苯基)-9H咔唑(C2)
Mp: 258~260℃.1H NMR (400 MHz, DMSO-d6, δ, ppm): 8.63 (s, 1H), 8.32 (d,J=7.6 Hz, 1H), 7.92-8.04 (m, 8H), 7.79 (dd,J=8.4 Hz, 3H), 7.39-7.62 (m, 17H), 7.20-7.27 (m, 2H), 6.70 (d,J=7.6 Hz, 1H), 5.78 (s, 2H). Anal. Calcd. For C51H35N: C, 92.55; H, 5.33; N, 2.12. Found: C, 92.44; H, 5.28; N, 2.11.
1.4.39-(3′,5′-二甲基-[1,1′-联苯]-2-基)甲基)-3-(3,5-二甲基苯基)-9H咔唑(C3)
Mp: 241~243 ℃.1H NMR (400 MHz, DMSO-d6, δ, ppm): 8.45 (s, 1H), 8.26 (d,J=8.00 Hz, 1H), 7.65 (d,J=8.00 Hz, 1H), 7.36 (s, 4H), 7.31-7.27 (m, 3H), 7.22-7.19 (t, 1H), 7.15-7.09 (m, 3H), 7.03 (s, 1H), 6.96 (s, 1H), 6.58 (d,J=8.0 Hz, 1H), 5.59 (s, 2H), 2.36 (d,J=4.0 Hz, 12H).Anal. Calcd. For C35H31N: C, 90.28; H, 6.71, N, 3.01. Found: C, 90.27; 6.66; N, 3.00.
2 结果与讨论
2.1 C1-C3的热稳定研究
从图1中可以看出,C1-C3表现出较高的热分解温度。在氮气保护下,升温速率为10 K/min,当化合物的剩余量为95 %时,分解温度被检测到,其分解温度分别为451、444、413 ℃。较高的分解温度可以使材料在制备器件过程中不易被分解并保持稳定。
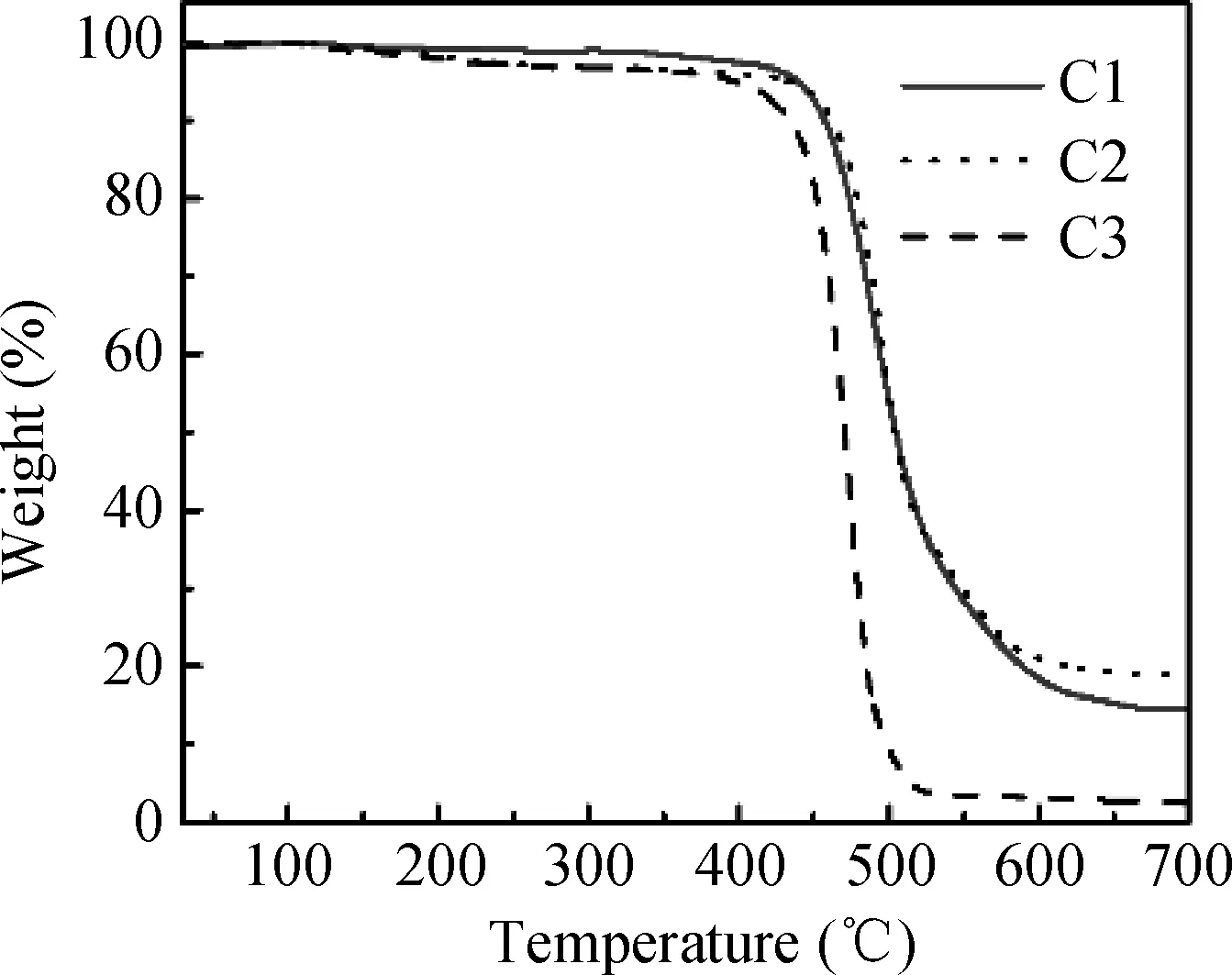
图1 C1-C3的TGA曲线Fig. 1 TGA curves of C1-C3
2.2 C1-C3的光物理性质
图2为化合物C1-C3的二氯甲烷溶液的紫外吸收光谱。C1-C3的最大吸收波长分别为312 nm, 295 nm和274 nm,可以归结为咔唑单元的π-π*跃迁。通过带边吸收法可以计算出三种化合物的光学带宽分别为3.30, 3.48和3.45 eV。

图2 化合物C1-C3的UV-vis图Fig. 2 UV-vis absorption of C1-C3
2.3 C1-C3的光致发光光谱

图3 C1的荧光和磷光光谱图Fig. 3 Fluorescence and phosphorescence spectra of C1
图3-图5为化合物C1-C3的荧光光谱和低温磷光谱。从荧光曲线可以看出,化合物C1-C3的发射峰分别在410, 403和427 nm处,处于深蓝色光区域。通过低温磷光谱,可以计算出其三线态能级分别为2.81, 2.88, 2.92 eV。较高的三线态能级有助于能量从主体材料向客体材料进行传输。
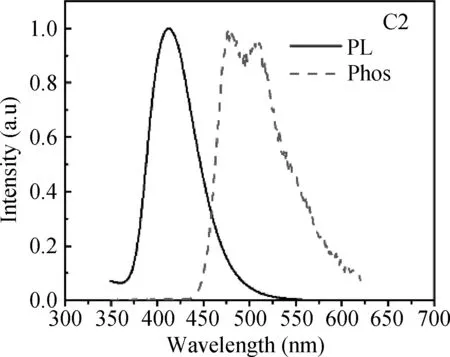
图4 C2的荧光和磷光光谱图Fig. 4 Fluorescence and phosphorescence spectra of C2

图5 C3的荧光和磷光光谱图Fig. 5 Fluorescence and phosphorescence spectra of C3
3 总结
合成了3种新型的基于咔唑的磷光主体材料:2′-(3-(4-(二苯胺基)苯基)-9H-咔唑-9-基)甲基)-N,N-二苯基-[1,1′-联苯]-4-胺(C1)、9-(4′-(萘-1-基)-[1,1′-联苯]-2-基)甲基)-3-(4-(萘-1-基)苯基)-9H咔唑(C2)、9-(3′,5′-二甲基-[1,1′-联苯]-2-基)甲基)-3-(3,5-二甲基苯基)-9H咔唑(C3)。通过核磁和元素分析对目标化合物进行表征。通过热重分析法测量了化合物的分解温度,通过测量化合物的UV-vis和光致发光光谱对化合物的光学性质进行研究,所有化合物都表现出较高的分解温度和三线态能级,表现出作为磷光主体材料的潜质,因此我们该项工作的研究对于促进OLED材料的发展有着积极的意义。
