南洋楹无性系抗寒性研究
2020-06-06曾琪瑶曾炳山黄烈键何卫忠何碧红
刘 英,曾琪瑶,曾炳山,黄烈键,何卫忠,何碧红
(1.中国林业科学研究院 热带林业研究所,广东 广州 510520;2.广东省九连山林场,广东 河源 517100; 3.广东省沙头角林场,广东 深圳 518081)
南洋楹Albizia falcataria为速生树种,其树干通直、圆满,材质稳定,易于加工,为制作胶合板、造纸等优质原料[1];其根系发达,具固氮作用,落叶量大且易腐烂分解,亦是改良土壤的良好树种[2]。我国于1940年前后开始引进南洋楹,在广东电白、增城、惠东、龙门等地均有种植,种植面积约 2.0×104hm2[3]。
南洋楹是一个典型的热带树种,具有畏寒喜暖的习性,其抗寒性较差,限制了其扩大栽培。选择速生、抗寒的优良无性系,是降低寒害风险、提高造林效益的主要措施之一。近年来,中国林业科学研究院热带林业研究所对早期引种林分进行了单株选优及无性系化[4-6],利用若干无性系营造几千亩南洋楹试验示范林。初步观察发现,各无性系抗寒性差异明显。植物的低温危害包括冷害和冻害,前者由0 ℃以上的低温引起,后者则由0 ℃以下的低温造成。不同种类植物、同种植物不同无性系对低温胁迫表现出抗寒性差异,亦伴随着不同抗寒生理指标的变化[7-8]。黄章平等[9]对1、2年生南洋楹幼林进行寒害调查发现,1年生幼树在遭遇5 ℃气温时即可能受到冷害,0 ℃以下低温持续时间长可致整株死亡。调查了0.5 ~2.5年生南洋楹种源/家系试验林的耐寒情况,发现南洋楹在连续10 d 出现1 ~8 ℃的气温天气时出现枝叶干枯等现象[10]。为了更好地了解南洋楹的耐寒性,促进其种植业发展,本研究选择9 个生长表现较好的南洋楹无性系,开展苗期抗寒性的测定,依据相对电导率(REC)、脯氨酸(PRO)含量、超氧化物歧化酶(SOD)活性3 个抗寒生理指标,初步筛选出一批抗寒性较强的无性系应用于生产实践。
1 材料与方法
1.1 试验材料
供试材料为A1、A8、TL17、TL18、B7、D12、S4、S5 和S7 等9个优良南洋楹无性系的组培苗。选取长势较好、无病虫害、规格较为一致(高度约50 cm)的苗木,于2017年12月在中国科学院华南植物园放入智能人工气候箱进行试验。
1.2 低温胁迫处理
参试苗木共135 株,即9 个无性系,5 个温度处理,分3 批次(3 次重复)开展试验。具体而言,每次试验每个无性系处理5 株,除了对照(常温,25 ℃)1 株,另将4 株幼苗放入湿度约65%、温度误差为±0.5 ℃的智能人工气候箱(RXZ 型,宁波江南仪器厂生产)中,依次经过6 h 的6、4、2、0 ℃温度处理后,每个低温处理选取1 株幼苗,取样测定相对电导率(REC)、脯氨酸(PRO)含量、超氧化物歧化酶(SOD)活性。
1.3 取样测定
对于每株参试幼苗,经上述试验处理后,选取其顶芽以下第1 ~3 片发育完满、无病虫害的健康复叶,用蒸馏水冲洗,吸干表面水分,进行生理指标的测定。
REC 的测定参考陈建勋等的方法[11],具体而言,常温或低温胁迫后,每个样品提取0.5 g 叶片,加入15 mL 去离子水,浸提30 min,用上海精密科学仪器有限公司生产的DDS-307A 型电导率仪测定溶液煮沸前的电导率EC1,薄膜封口后,置于100 ℃的恒温浴锅中煮20 min,自然冷却至室温后,测定煮沸后的电导率EC2。依据如下公式计算REC:
REC=(EC1-EC0)/(EC2-EC0)。
式中:EC1和EC2分别为煮沸前、后的电导率;EC0为去离子水的电导率。
PRO 含量采用茚三酮比色法测定[12],SOD 活性的测定参照Giannopolitis & Ries 的方法[13]。
形态观察:低温胁迫处理的苗木采样后置于常温4 h,观察其叶片形态。
1.4 数据处理
运用Microsoft Excel 和SPSS18.0 软件进行数据处理与统计分析[14]。
2 结果与分析
2.1 低温胁迫下南洋楹幼苗叶片的形态观察
9 个无性系分别在6、4 ℃温度下处理6 h,经室内4 h 恢复后,叶片形态未出现冷害症状;在2 ℃ 温度下处理6 h 后,出现不同程度的黄化落叶,其中S5、S7、TL18 黄化落叶率为10%~15%,其它无性系黄花落叶率为20%~30%。在0 ℃处理6 h后,所有无性系均出现顶芽死亡。由此可见,9 个南洋楹无性系的抗寒性差异主要表现在0 ~2 ℃。
2.2 低温胁迫对南洋楹幼苗叶片相对电导率(REC)的影响
随着温度的降低,9 个南洋楹无性系的幼苗REC 表现出2 种变化趁势:B7、S7、D12、S5、TL18、A1 无性系先上升后下降再上升;TL17、S4、A8 无性系单调上升(表1)。9 个无性系的REC 均在25 ℃时最低,0 ℃时最高。无性系TL17和A8 分别在温度降至2 ℃和4 ℃时,其REC 才显著升高(P<0.05);其它7 个无性系在温度降至6 ℃时即显著升高。
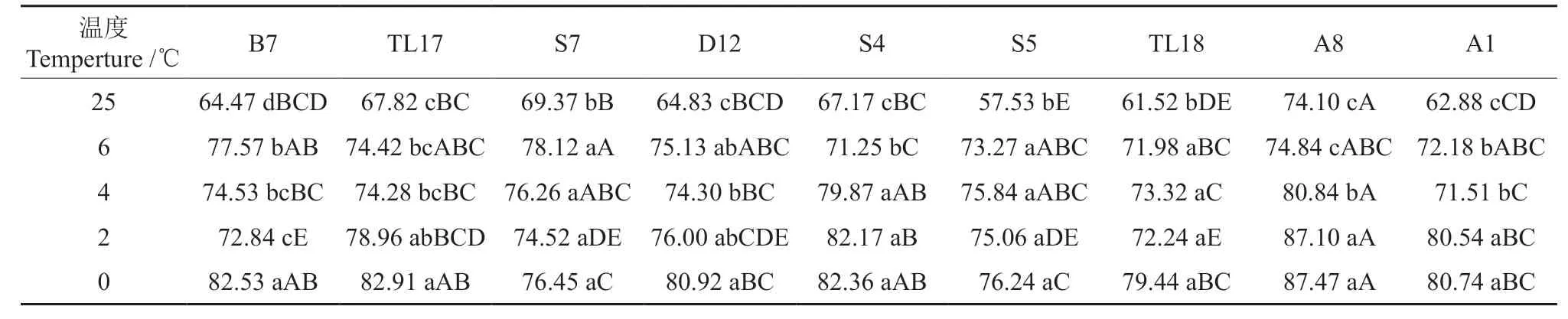
表1 系列低温处理下9 个南洋楹无性系的相对电导率(REC)†Table 1 Relative electronic conductivity of nine Albizia falcatariaclones under a serial of low temperature treatments %
同一温度下不同无性系之间,REC 亦存在显著差异。如,25 ℃时,S5 的REC 最小,与TL18差异不显著(P≥0.05),而显著低于其它无性系;A8 最大,显著高于其它无性系。0 ℃时,无性系S5、S7 的REC 最小,与TL18、A1、D12 差异不显著,而显著低于其它无性系;A8 最大,与B7、TL17、S4 差异不显著,显著高于其它无性系。9 个南洋楹无性系0 ℃时的REC 从小到大的排序为:S5 <S7<TL18 <A1 <D12 <S4 <B7 <TL17 <A8。
2.3 低温胁迫对幼苗叶片脯氨酸(PRO)含量的影响
各无性系随着温度的降低,PRO 含量整体上呈现上升趋势(表2)。在25 ℃时,9 个无性系的PRO 含量均相对较低,但无性系间差异显著 (P<0.05);0 ℃时,9 个无性系的PRO 含量均达到最高值,无性系间PRO 含量差异显著,以A8为最高,与A1 差异不显著(P≥0.05),而显著高于其它无性系;TL17 最低,与S7、D12、S4 和TL18 差异不显著,显著低于其它无性系。
PRO 从25 ℃降至0 ℃的过程中增幅差异明显。TL17 和A1 无性系呈缓慢递增趋势,在0 ~ 25 ℃区间无显著差异,增幅较小;D12 呈现先升后降的趋势;B7、A8 呈现先升高后趋于稳定;S7、S4、S5、TL18 呈现先变化缓慢后急剧升高的趋势。无性系PRO 含量增幅从小到大的排序如下:D12 <TL17 <A1 <S4 <B7 <TL18 <S7 < S5 <A8。

表2 低温胁迫下9 个南洋楹无性系的脯氨酸(PRO)含量Table 2 Response of PRO contents of nine Albizia falcatariaclones under low temperature stress µg·g-1
2.4 低温胁迫对幼苗叶片超氧化物歧化酶(SOD)活性的影响
各无性系SOD 活性随着温度的降低变化规律不明显(表3)。在每个温度下,各无性系间SOD 活性均差异显著(P<0.05)。常温(25℃)时,S7 与S5 含量最高,与S4、D12、TL18 差异不显著(P≥0.05),显著高于A1、B7、TL17、A8;0 ℃时,仅S4 显著高于A8,与其它无性系差异不显著。整体而言,S7、S5、S4、D12 和TL18 的SOD 活性高,TL17、A8、B7 和A1 的SOD 活性低。
2.5 抗寒指标间的相关性
相关性分析结果(表4)表明,REC 与25 ℃下的SOD 活性显著负相关(P<0.05),并随温度降低相关性减弱;2 ℃与25 ℃下的PRO 含量呈显著正相关;从25 ℃降至0 ℃ PRO 含量增幅与0 ℃下的PRO 含量极显著相关(P<0.01),与0 ℃下的SOD 活性显著负相关,而与25 ℃下的PRO 含量相关不显著(P≥0.05)。
2.6 南洋楹无性系抗寒性评价
随着处理温度的降低,以REC 的变化规律最为明显,PRO 含量和SOD 活性的规律性相对较弱,因此选择REC 进行南洋楹无性系抗寒性评价。应用K-均值聚类法进行聚类分析,将9 个无性系分为3 类(表5)。S7、S5、TL18 聚为一类,属于最抗寒的无性系;A8 单独聚为一类,属于抗寒性最差的无性系;A1、S4、D12、TL17、B7 等其它5 个无性系抗寒性居中。表5 列出了各类无性系的REC 以及PRO 含量和SOD 活性差异。

表3 低温胁迫下9 个南洋楹无性系的超氧化物歧化酶(SOD)含量变化Table 3 Response of SOD contents of nine Albizia falcatariaclones under low temperature stress U·g-1

表4 REC 及PRO 和SOD 含量的相关性分析(Pearson 系数)†Table 4 Relationship between REC and contents of PRO and SOD (Pearson coefficient)

表5 南洋楹无性系抗寒性分类与评价Table 5 Classification and evaluation of Albizia falcataria clones based on cold resistance
3 讨 论
植物受到低温胁迫时,会引起细胞膜透性增大,电解质外渗,相对电导率(REC)升高[15],REC 与耐寒性呈负相关。本研究采用REC 指标反映细胞膜的受损伤程度,发现抗寒性相对较差的无性系A8、S4、TL17 呈单调上升趋势,其0 ℃时的相对电导率亦较高,可能与其细胞透性变化不可逆转、恢复能力差有关;而抗寒性较强的无性系S5、S7、TL18、A1、D12、B7 呈先上升后下降再上升的趋势,尤其是S5、S7,其0 ℃时相对电导率最小,抗寒性最强,说明其细胞膜透性变化可逆转,易恢复。
低温胁迫下,为防止细胞过度失水,植物通过主动积累细胞内可溶性物质来降低细胞液的渗透势[16]。可溶性物质主要包括脯氨酸(PRO)、可溶性糖及可溶性蛋白等,为重要的渗透调节物质,可以保持原生质胶体性质及组织内代谢过程的稳定,是一种自我保护物质[17]。然而,其含量高低与抗寒性的相关性仍存在争议,一些学者认为含量与抗寒性呈正相关[15],也有人认为PRO 含量不是越高越好,过量的PRO 会产生伤害效应,是一把“双刃剑”[18]。本研究结果发现,从25 ℃降至0 ℃时PRO 含量增幅与25 ℃下的PRO 含量相关不显著(P≥0.05),而与0 ℃时的PRO 含量极显著相关(P<0.01),说明PRO 含量增幅主要取决于0 ℃时的PRO 含量,由此可见,PRO含量增幅反映其对低温胁迫的防御能力。从25 ℃降至0 ℃时,PRO 含量增幅以TL18、S7、S5、A8 最高,其增幅均在1 倍以上。前3 个无性系在0 ℃时的电导率也最低,说明其对低温胁迫的耐受能力高,而且恢复能力强;而A8 的电导率最高,显示其抗寒性差,但受适度胁迫后恢复能力强。
低温胁迫下植物细胞膜损伤,释放活性氧自由基(O2-),形成氧化胁迫。当发生氧化胁迫时,SOD、POD、CAT 等抗氧化酶会相互作用清除O2-,避免超氧自由基对膜的伤害,从而降低细胞膜的受损伤程度[19],其含量高低说明其清除活性氧的能力,亦与抗寒性密切相关[20]。抗氧化活性越高,植物抵御低温引起的氧化胁迫能力越强。SOD 的相关研究比较多,其变化规律较为复杂,其随低温胁迫增强一般表现出先升后降的单峰变化趋势[21],一些植物表现出双峰变化趋势[22]。本研究中,9 个南洋楹无性系的SOD 活性变化多样,没有明显的规律性,不宜直接用于评定南洋楹的抗寒性,与高京草等[15]对枣树的研究结果一致。高福元等[23]研究4 种彩叶植物SOD 活性对冬季低温的响应亦得出,SOD 活性的高低与植物抗寒性强弱无直接关系。0 ℃下的南洋楹叶片REC 与 25 ℃下的SOD 活性呈显著负相关(P<0.05),说明南洋楹叶片SOD 活性对于低温胁迫的响应相对较弱,其抗寒性取决于常温下的SOD 含量。SOD 活性无明显变化规律,可能与SOD 不是南洋楹清除O2-的主要酶有关,需要研究低温胁迫对POD、CAT 等其它酶的影响,才能更为有效地评价南洋楹无性系清除O2-的能力强弱。
植物受低温胁迫的抗寒性强弱,主要受细胞膜受损程度、启动细胞保护物质合成的强弱程度、清除活性氧自由基O2-的能力的影响。许多植物抗寒性研究表明,抗寒生理指标间存在相关性,而且相关性与试验材料有关,王树刚等[24]即用生理生化指标相关性及主成分分析评价不同小麦品种的抗寒性。本研究发现,南洋楹相对电导率变化比较明显,为抗寒性的主要因子,其次是PRO,再者是SOD。3 项生理生化指标的变化规律相关性有时达到显著水平。因此,在研究经费足够的条件下,今后宜采用更多生理生化指标评价南洋楹无性系的抗寒性。
4 结 论
1)南洋楹无性系的相对电导率(REC)随着温度的降低呈现两种变化趋势:抗寒性相对较差的无性系A8、S4、TL17 呈单调上升趋势,其0 ℃ 时的REC 亦较高;抗寒性较强的无性系S5、S7、TL18、A1、D12、B7 呈先上升后下降再上升的趋势,尤其是S5、S7,其0 ℃时REC 最小,抗寒性最强。
2)无性系随着温度的降低,南洋楹叶片脯氨酸(PRO)含量整体上呈现上升趋势,无性系间差异显著,从25 ℃降至0℃时,PRO 含量增幅以TL18、S7、S5、A8 最高,其增幅均在1 倍以上,细胞的修复能力最强。D12、S4 增幅少于50%,细胞的修复能力弱。
3)南洋楹无性系的叶片超氧化物歧化酶(SOD)活性随着温度的降低变化规律不明显,而且在0 ℃时各无性系间差异大多不显著,不宜用于南洋楹抗寒性评价。
4)通过聚类分析得出,9 个测试无性系中,S7、S5、TL18 的抗寒性最强,A8 最差,与大田无性系示范林观察结果基本一致[6]。
