保元汤对正常小鼠免疫力功能的影响
2020-06-05陈桂芳袁玲玲丁丽娜杨卫平杨静雯王睿睿钱如贵
张 祎,陈桂芳,袁玲玲,丁丽娜,杨卫平,杨静雯,王睿睿,钱如贵
(1.云南中医药大学 中药学院,云南 昆明 650500;2.云南省民族特色养生理论与健康产品工程实验室,云南 昆明 650500;3.昆明邦宇制药有限公司,云南 昆明 650211)
保元汤为明代孙志宏所著《简明医彀》中记载的经典方剂,制法为“人参一钱,黄芪二钱,甘草五分,肉桂二分.右加生姜一片,水煎服”,可大补元气,主治元气虚弱之证[1].根据古代医药典籍记载的药方组成,可以将该方开发为增强免疫力功能的产品,符合来源于经典名方、治未病的现代健康理念,本文完成保元汤提取物对正常小鼠免疫力功能影响的实验研究,为以保元汤为基础配方的健康产品研究开发提供实验依据,也可为古代经典方剂的现代应用提供研究思路.
1 材料与方法
1.1 实验动物
清洁级ICR小鼠,单一性别,体重18~22 g,购自昆明医科大学实验动物中心,合格证号:SCXK(滇)K2015-0002.实验前在动物房环境中适应性饲养1周,饲养环境温度20~26 ℃(日温差≤3 ℃),相对湿度40%~70%,换气次数10~20次/h,气流速度0.1~0.2 m/s,噪音≤60 dB,工作照度>300lx,动物照度15~20lx,12 h明暗交替照明,使用许可证:SYXK(滇)K2017-0005.
1.2 实验材料
刀豆蛋白A,Sigma,批号C6110;2,4二硝基氟苯,成都贝斯特试剂有限公司,批号20180607;青霉素链霉素混合液(100×,批号180625)、姬姆萨染色液(批号20181208)、印度墨水(批号20180730)、MTT(批号298-93-1 ),购自北京奥拓科技有限公司;PBS缓冲液(批号8118127)、RPMI 1640细胞培养液(批号8118314),购自赛默飞世尔仪器有限公司;DM500普通光学显微镜,德国Leica;SpectraMax Plus384酶标仪,美国MD;5810R高速冷冻离心机,德国Eppendorf.
1.3 样品制备
参照文献[2]报告的配方和制备方法,制备200人份的药材处方为:人参300 g、黄芪600 g、肉桂 60 g、生姜300 g、甘草150 g,经水提取,提取物的成人推荐用量为1.75 g/d.
1.4 剂量设计与分组
受试物为1.3制备的提取物,每个试验项目均设立对照组和不同剂量的实验组,每组10~15只动物,其中,实验组分别设0.15、0.30、0.60 g/kg bw剂量组(为人体推荐用量的5、10、20倍),受试物以纯化水配制,配制后2~8 ℃下保存不超过3 d,所有实验组经口灌胃给予不同剂量的受试样品,灌胃容积为20 mL/kg bw,每天1次,每周称量体重1次,并根据动物体重调整灌胃体积,对照组给予等体积的纯化水.
1.5 实验方法
参考文献[3-4]方法,采用小鼠碳粒廓清实验、小鼠腹腔巨噬细胞吞噬鸡红细胞实验和NK细胞活性测定,观察保元汤提取物对正常小鼠非特异性免疫功能的影响;采用小鼠迟发型变态反应、血清溶血素生成实验、ConA诱导小鼠脾淋巴细胞转化实验,观察保元汤提取物对正常小鼠特异性细胞免疫和体液免疫的影响.
1.5.1 小鼠碳廓清实验
选用雌性小鼠60只,按体重随机分为4组,每组15只,连续给药30 d,末次给药后30 min,按 100 mL/kg 尾静脉注入10%印度墨汁,在注射后2、10 min时,小鼠眼眶静脉取血20 μL置于含2 mL 0.1%Na2CO3溶液的试管中混匀,酶标仪测定 600 nm 处吸光度,将动物处死,取其胸腺、脾器官称重,计算吞噬系数、胸腺系数和脾脏系数.
1.5.2 小鼠腹腔巨噬细胞吞噬鸡红细胞
选用雌性小鼠48只,随机分为4组,每组12只,连续给药30 d,在取材前4d给每只小鼠腹腔注射2%压积鸡血红细胞0.2 mL,取材时颈椎脱臼处死小鼠,每只腹腔注射含胎牛血清的FPS液4 mL,吸取腹腔洗液,取0.5 mL洗液加入盛有1%鸡血红细胞悬液0.5 mL的试管内混匀,取0.5 mL混合液于玻片,37 ℃孵育15~20 min,生理盐水冲洗玻片,置甲醇液中固定1 min,再放入Giemsa溶液中染色15 min,最后用蒸馏水冲洗干净,晾干,用40×显微镜下计数细胞吞噬百分率和吞噬指数.
1.5.3 NK细胞活性测定
选用雌性小鼠4只,随机分为4组,连续给药30 d后,颈椎脱臼处死动物,无菌取脾,在FPS液中磨碎,经 1 000 r/min 离心洗涤后,用含10%胎牛血清的RPMI1640完全培养液重悬,活细胞计数并调整浓度2×107个/mL.取靶细胞和效应细胞各100 μL(效靶比50∶1),自然释放孔和最大释放孔分别加入培养液和2.5%Triton 100 μL,于37 ℃、5%CO2培养箱中培养4 h,1 500 r/min 离心5 min,取上清液100 μL,加入LDH基质液100 μL,室温反应3~10 min,加入1 mol/L的HCL 30 μL,酶标仪测定490 nm处吸光度,计算NK细胞活性.
1.5.4 ConA诱导的小鼠脾淋巴细胞转化实验(MTT法)
选用雌性小鼠60只,随机分为5组,连续给药30 d,颈椎脱臼处死动物,无菌取脾,置无菌Hank’s液中磨碎,经 1 000 r/min 离心洗涤后,将细胞悬于1 mL的完全培养液中,活细胞计数并调整浓度3×106个/mL.将脾细胞悬液分两孔加入24孔培养板中,每孔1 mL,一孔加ConA液75 μL,另一孔作为对照,置37 ℃、5% CO2孵箱中72 h,培养结束前 4 h,每孔取上清液0.7 mL,加入不含胎牛血清的RPMI 1640培养液,加入MTT 50 μL,继续培养4 h,加入酸性异丙醇1 mL混匀,酶标仪测定570 nm处吸光度,计算淋巴细胞的增殖转化能力.
1.5.5 DNFB诱导小鼠迟发变态反应
选用雄性小鼠75只,随机分为5组,连续给药10 d,除空白组外,各组动物给药后1 h,在经氯化钡脱毛的腹部皮肤上均匀涂抹1% DNFB混合液 50 μL,给药第15 d,各鼠右耳两面均匀涂抹1% DNFB混合液10 μL,24 h后颈椎脱臼处死动物,剪下左右两耳,用直径8 mm打孔器于同部位切下双耳,称重,计算肿胀度;同时摘取胸腺和脾脏,称重,计算脏器系数.
1.5.6 血清溶血素的测定
选用雌性小鼠60只,按体重随机分为4组,连续给药25 d,每鼠腹腔注射5%绵羊红细胞悬液0.2 mL,继续给药5 d,末次给药后30 min,于眼眶静脉取血,放置1 h,4 000 r/min 离心10 min,取血清用SA缓冲液稀释100倍,依次取血清稀释液0.25 mL、10%绵羊红细胞悬液0.25 mL、补体0.25 mL,混合后于37 ℃恒温30 min,置0~4 ℃冰水中终止反应,离心,以不加小鼠血清(以SA缓冲液代替)的空白管调零,酶标仪测定540 nm处吸光度,计算半数溶血值(HC50).
1.6 统计分析
计量资料以X±SD表示,采用方差分析,方差齐,计算F值≥0.05,P≤0.05,用多个试验组和一个对照组间均数的两两比较方法进行统计(采用LSD方法)比较试验组与对照组差异性,试验组显著水平取P=0.05,极显著水平P=0.01;对非正态分布或方差不齐的数据采用变量转换,或改用秩和检验进行统计分析.
2 实验结果
2.1 保元汤对小鼠非特异性免疫的影响
2.1.1 对小鼠碳廓清的影响
与空白组相比,保元汤对正常小鼠的碳廓清吞噬指数未见显著差异(P>0.05),胸腺/体重比值和脾脏/体重比值也无显著性差异(P>0.05),结果见表1.

表1 保元汤对小鼠碳廓清的影响
2.1.2 对小鼠腹腔巨噬细胞吞噬鸡红细胞功能的影响
与空白组相比,保元汤3个剂量均可显著增加正常小鼠巨噬细胞吞噬鸡红细胞的吞噬百分率(P<0.05),各剂量对吞噬指数均无明显影响(P>0.05),结果见表2.

表2 保元汤对小鼠腹腔巨噬细胞吞噬鸡红细胞功能的影响
注:与空白对照组相比,*/**P<0.05/0.01.
2.1.3 对小鼠NK细胞活性的影响
与空白组相比,保元汤各剂量对正常小鼠NK细胞活性均无增强作用(P>0.05),结果见表3.
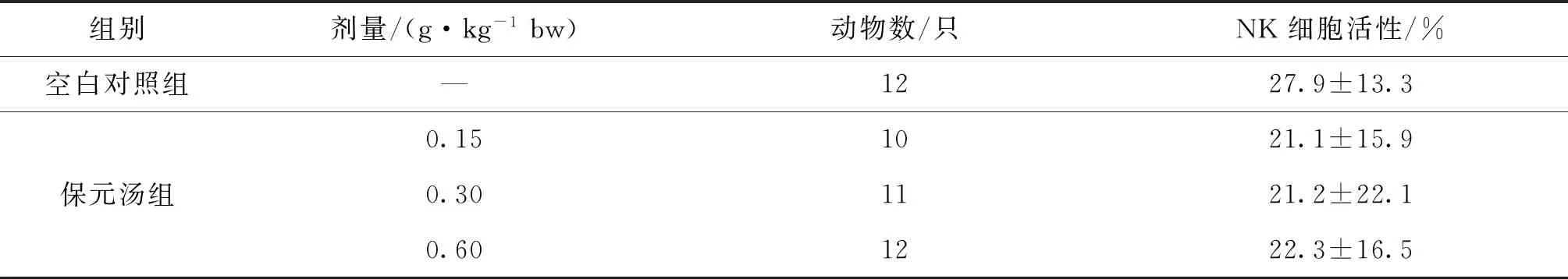
表3 保元汤对正常小鼠NK细胞活性的影响
2.2 保元汤对小鼠特异性免疫的影响
2.2.1 对ConA诱导小鼠脾淋巴细胞转化的影响
与空白组相比,保元汤中、高剂量均表现出具有增强正常小鼠淋巴细胞转化能力的趋势,但差异无统计学意义(P>0.05),结果见表4.

表4 保元汤对ConA诱导小鼠脾淋巴细胞转化的影响
2.2.2 对DNFB诱导小鼠迟发型变态反应的影响
与空白组相比,模型组小鼠耳片肿胀度显著增加(P<0.01),胸腺系数显著降低(P<0.01),脾脏系数未见明显影响(P>0.05);与模型组相比较,保元汤3个剂量均可显著增加模型小鼠耳片肿胀度(P<0.05或P<0.01),且呈现出一定的剂量相关性,具有增强正常小鼠细胞免疫功能;保元汤中剂量可显著增加小鼠胸腺系数(P<0.05),结果见表5.
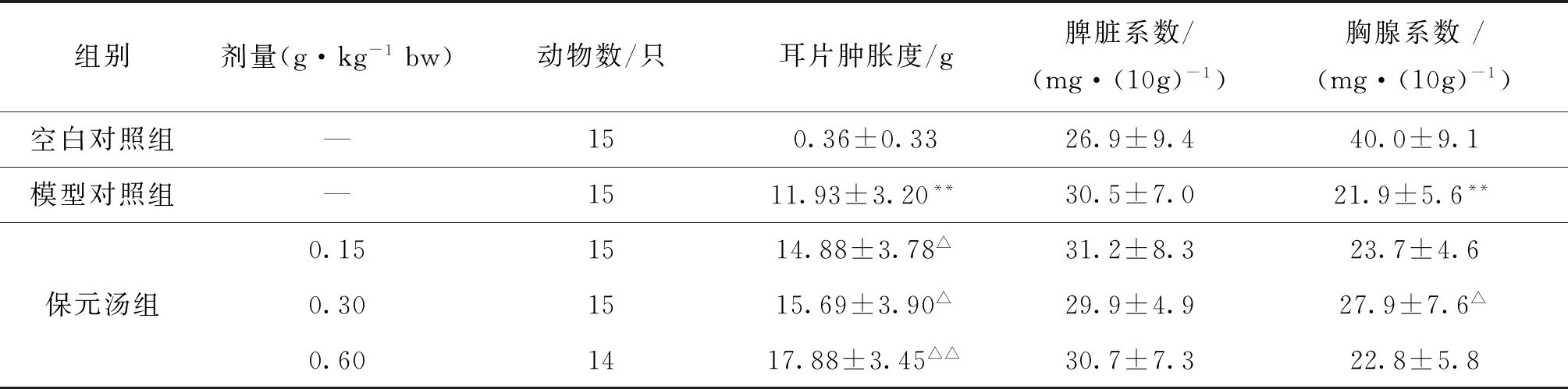
表5 保元汤对DNFB诱导小鼠迟发性超敏反应的影响
注:与空白对照组相比,**P<0.01;与模型对照组相比,△P<0.05,△△P<0.01.
2.2.3 对小鼠血清溶血素生成的影响
与空白组相比较,保元汤3个剂量均可显著促进正常小鼠血清溶血素的生成(P<0.05或P<0.01),具有增强正常小鼠的体液免疫功能,结果见表6.

表6 保元汤对小鼠血清溶血素生成的影响
注:与空白对照组相比,*P<0.05,**P<0.01.
3 讨论与结语
中医药对免疫的认识源远流长,早在两千多年前,我国古代医学著作中就有与免疫有关的记载,如《内经》中提到“正气存内,邪不可干”、“真气从之,精神内守,病安从来”等论点,其中真气就是机体抵抗病邪的“正气”[5].免疫力低下,即中医的“虚症”,以扶正固本作为治病的基本法则[6-7].保元汤用于治疗元气虚弱、精神倦怠、肌肉柔慢等虚症,通过调节五脏六腑气血的阴阳平衡来改善患者的免疫功能,提高患者的免疫力水平[8].现代药理研究发现,保元汤具有免疫调节、促进免疫细胞再生和改善造血功能等多种药理作用,临床上广泛用于气虚、免疫失调引起的多种疾病[9-10].
本实验研究结果表明,保元汤提取物以0.15、0.30、0.60 g/kg bw连续灌胃给药30 d,可通过增强小鼠腹腔巨噬细胞对鸡红细胞的吞噬能力,增强正常小鼠非特异性免疫;连续灌胃给药15 d,可增强正常小鼠DNFB诱发的迟发型变态反应,具有增强正常小鼠特异性细胞免疫功能;连续灌胃给药30 d,可促进正常小鼠血清溶血素生成,具有增强小鼠特异性体液免疫功能.在增强细胞免疫、体液免疫、单核-巨噬细胞功能等3个方面结果均为阳性,说明保元汤提取物能增强正常小鼠的免疫功能,具有开发为增强免疫力功能产品的前景和优势.
在保元汤配方中具有增强免疫力功能的主要组分为人参、黄芪.根据文献[11-13]报道,人参、黄芪单用或配伍使用,均能不同程度增强小鼠多种免疫功能.本实验研究结果显示,保元汤提取物对小鼠碳粒廓清能力、NK细胞活性无显著影响、ConA诱导小鼠脾淋巴细胞转化无显著影响,与文献报道存在一定差异,可能是由于各实验对受试物或组分的剂量要求不同所致,也可能是由于受试物本身的作用特点所在,有待开展进一步的作用机制研究.
