手性硫脲催化不对称合成多取代呋喃酮
2020-06-05黄忠杰
黄忠杰
(闽南师范大学化学化工与环境学院,福建漳州363000)
杂环类化合物一类广泛存在于自然界的有机化合物,它们当中均表现出很强的生物活性,其中最具代表性的例子为生物碱、核酸及激素类化合物[1-2].而呋喃酮类化合物则是一类含氧的杂环类化合物,它也是众多药物分子、天然产物及有机功能材料分子中重要的结构单元(如图1 所示).例如,许多含有呋喃酮片段的分子在抗肿瘤、抗菌、消炎及抗HIV 病毒等方面均表现出优异的生物活性;另外,它们在食品及精细化工领域同样存在广泛的应用,如食品增香剂菠萝呋喃酮、C.I.分三红356 均含有呋喃酮的结构片段[3-4].由于其独特的药理活性,一直吸引着有机合成工作者的研究兴趣.
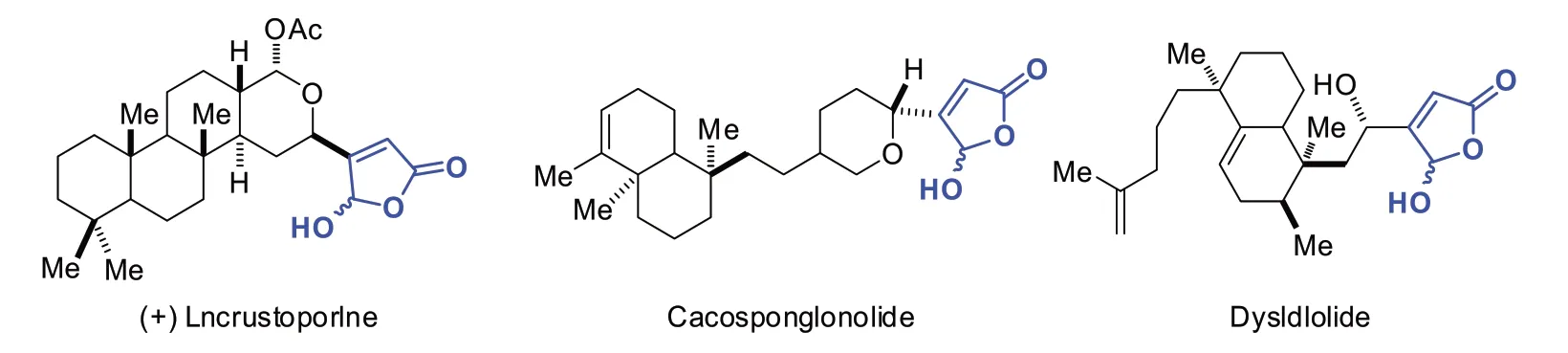
图1 具有生物活性的代表性呋喃酮化合物Fig.1 Representative compound of furanones with biological activity
Carretero等[5]选用了Mo(CO)3(DMF)作为催化剂,在无一氧化碳的气体的存在下,在四氢呋喃溶剂中,室温条件下实现了炔醛类化合物进行分子内的Pauson-Khand反应,高效构建含有呋喃酮结构的[5,5]并环结构产物(如图2所示).该合成方法具有良好的底物适用性,反应条件相对简单温和.
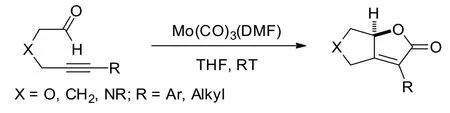
图2 钼催化的Pauson-Khand反应构建呋喃酮结构Fig.2 Mo-catalyzed synthesis of furanones by Pauson-Khand reaction
2007 年,Antonio 等[6]首次报道了烷基取代的羟基-炔丙酯类化合物,在一价铑催化剂的存在下,与有机硼化物发生Michael加成及随后的内脂化反应生成不同取代基的呋喃酮产物(如图3所示).他们的研究表明,铑催化剂、配体、反应溶剂及有机硼衍生物均对反应效率存在显著的影响,通过合理的配置可以方便实现了3种不同取代类型的呋喃酮产物,且均表现出优异的区域选择性.
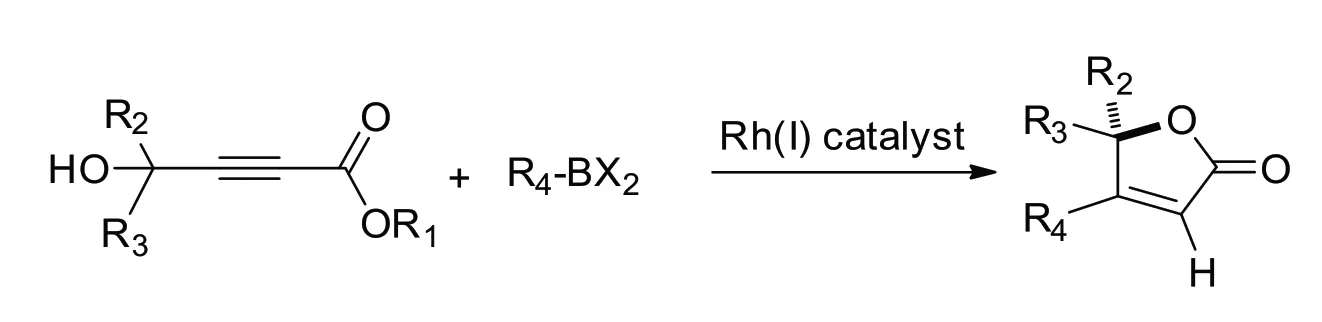
图3 铑催化呋喃酮产物的合成Fig.3 Rh-catalyzed preparation of furanones
Jiang等[7]在2015年开发了一种新的呋喃酮合成方法(如图4所示).他们发现,以α-羟基酮及不同取代基的腈作为反应底物,在碱性的反应条件下,碘化亚铜能有效地催化实现[4+1]环化反应,以简便高效的方法制备出一系列不同取代基的呋喃酮类产物.值得一提的是,该合成方法具有原子经济性、操作简单及条件温和等优点.
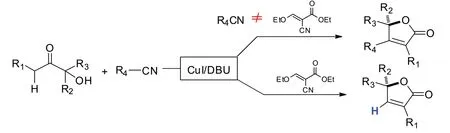
图4 铜催化[4+1]环化反应制备呋喃酮产物Fig.4 Cu-catalyzed[4+1]cyclic reaction to construct furanones
综上所述,呋喃酮类化合物是一类具有重要生物活性的含氧杂环类化合物.到目前为止,虽然已经发展出了一些不同的合成方法,但是上述的方法仍存在一些明显的弊端,如需要使用到昂贵的过渡金属催化剂或需要使用到有毒的试剂.同时对于不对称的合成仍然较少报道.因此,本文尝试发展一种新的不对称合成呋喃酮的方法,即尝试选用手性硫脲作为手性诱导剂,以α-溴代乙酰乙酸乙酯中及(E)-4-甲氧基-β-硝基苯乙烯作为反应原料,开发出一种手性呋喃酮的制备方法.
1 实验部分
1.1 试剂与仪器
甲苯(Toluene)、二氯乙烷(DCE)、乙腈(ACN)、二氯甲烷(DCM)、碳酸钾、碳酸钠、碳酸锂、醋酸钠、醋酸钾、醋酸胺,醋酸、氢化奎尼定及三乙胺等为分析纯试剂;选用青岛海洋化工厂生成的硅胶板为TLC(厚为0.25 mm)检测跟踪板;同样选用生产厂家为青岛海洋化的硅胶,且其粒径大小为200~300目进行柱层析.
核磁共振波谱检测用:Bruker Avance(500 MHz)型核磁共振仪,选用氘代氯仿作为溶剂,选用四甲基硅烷作内标;高分辨质谱(HRMS)由ABI Q-star Elite质谱仪进行测定,且选用离子源为电喷雾电离ESI为条件;IR Prestige-21系列的红外光谱仪,使用KBr 压片的方法.
1.2 实验方法
1.2.1 (E)-4-甲氧基-β-硝基苯乙烯的合成步骤
如图5 所示,取一干燥100 mL 的单口瓶,放入磁子,将称取的对甲氧基苯甲醛(1.8 mL,15 mmol)及醋酸铵(2.9 g,37.5 mmol)溶于30 mL 醋酸中.室温下加入硝基甲烷(2.5 mL,46.5 mmol),接着油浴加热回流4 小时直到TLC 检测原料完全消失.然后将热的反应液直接导入冰水中,减压抽滤得到固体粗产物,粗产物经过柱层析[V(乙酸乙酯)∶V(正己烷)=1∶4]最终得到黄色固体产品(E)-4-甲氧基-β-硝基苯乙烯,分离产率为76%.
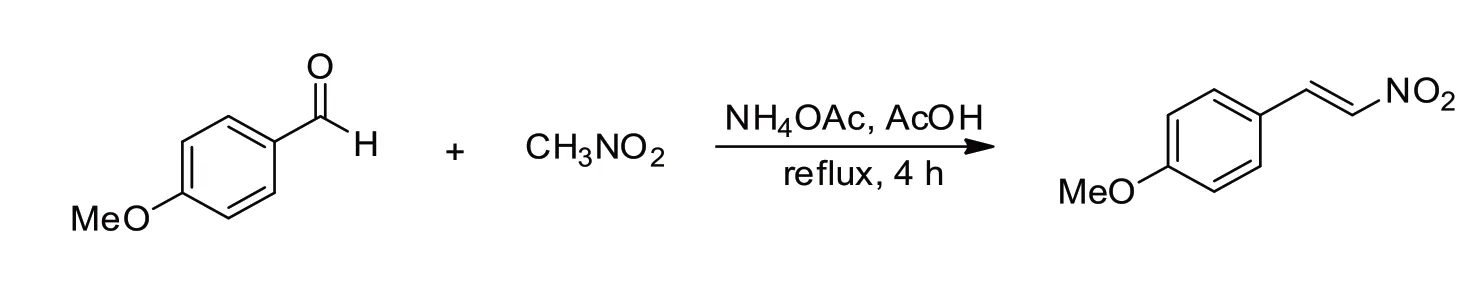
图5(E)-4-甲氧基-β-硝基苯乙烯的合成Fig.5 Synthesis of(E)-1-methoxy-4-(2-nitrovinyl)benzene
1.2.2 呋喃酮的制备方法
取一干燥、干净的单口瓶(10 mL),放入搅拌子,接着将称取的(E)-4-甲氧基-β-硝基苯乙烯(0. 3 mmol)及β-溴代乙酰乙酸乙酯(0.3 mmol)溶于5 mL 二氯甲烷或者甲苯溶剂中.室温下加入碱(碳酸钾、醋酸钠及醋酸钾等)(0.45 mmol),接着在室温下搅拌2 个小时直到TLC 检测原料完全消失.然后反应体系溶液直接在减压的条件下蒸发掉溶剂得到粗产物,粗产物经过柱层析[V(乙酸乙酯)∶V(正己烷)=1∶2]最终得到呋喃酮产物,分离产率为54%~86%.
2 实验结果与讨论
以(E)-4-甲氧基-β-硝基苯乙烯1及β-溴代乙酰乙酸乙酯作为反应原料,考察在非手性环境下的反应活性(如表1所示).首先在没有碱的存在下,没有观察到任何反应的发生.当加入1.5当量的碳酸钠时,在二氯甲烷反应溶剂中,室温条件确实观察到反应底物完全转化,且可以分离得到目标产物,且产率为80%.进一步考察不同的碱性的碱时,发现碱性更强的碳酸钾相比于碱性较弱的醋酸钠只需要更短的时间就能获得类似的产率;而使用等当量的有机碱三乙胺时,该反应也能有效地进行,得到反应的产率为81%.另外,不同的反应溶剂对该反应具有重要的影响.当使用极性较强、配位能力强的溶剂时,如二甲基甲酰胺(DMF)或者乙腈(ACN)时,反应的效率明显降低;而当使用非极性溶剂甲苯时,则反应可以获得类似的反应产率为86%.因此,笔者认为以非极性的溶剂作为反应介质对该反应具有很好的促进作用.接着在手性催化剂的诱导下,继续探究不同的反应条件,以实现不对称合成呋喃酮结构产物的目标.
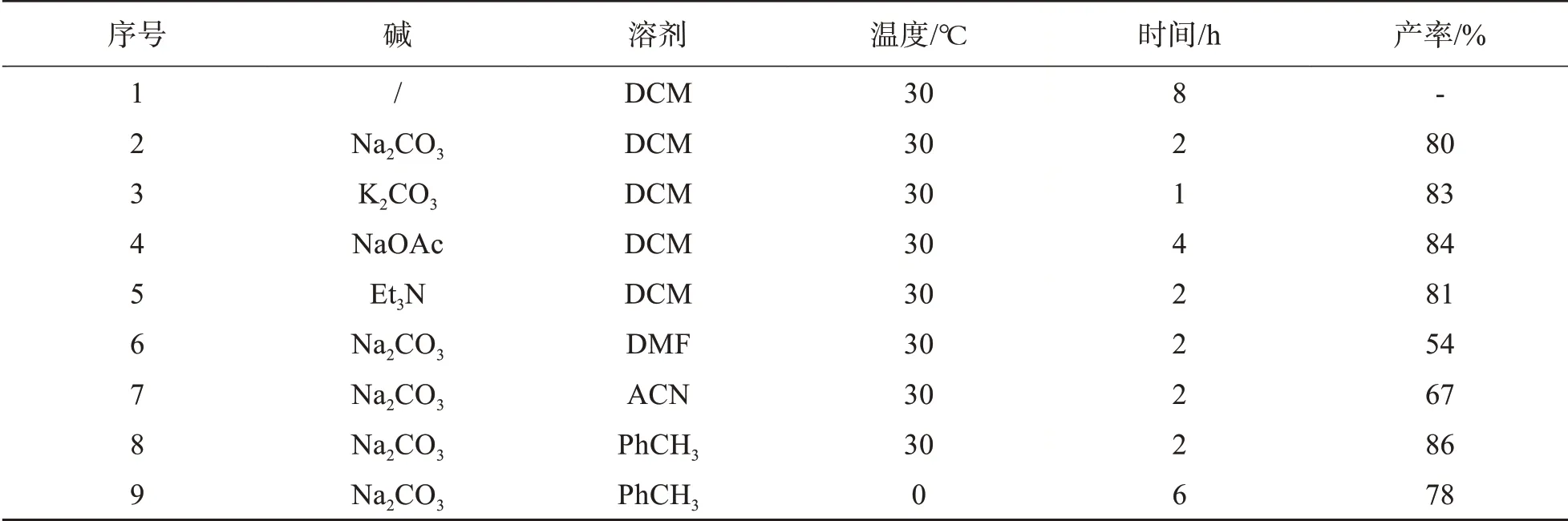
表1 非手性环境下的反应条件筛选Tab.1 Screenings of reaction conditions in an unchiral environment
基于上述非手性环境下的反应条件筛选结果,继续尝试使用手性诱导剂,来实现呋喃酮的不对称合成(如表2所示).首先选用商业可得的1-[3,5-双(三氟甲基)苯基]-3-[(1R,2R)-2-(二甲氨基)环己基]硫脲(cat 1)作为手性诱导剂,碳酸钾作为碱,以甲苯作为反应溶剂,-50℃反应,确实观察到手性诱导现象的存在,得到的对映体过量值(ee)为35%.当选用碱性较弱的碳酸钠作为碱时,0℃下就可以将映体过量值提高到60%,且分离产率为80%,进一步降低反应温度到-78℃时,对映体过量值可以提高到77%,且分离产率没有明显变化.随后,进一步筛选其他碱性更弱的碱发现,使用醋酸钠作为碱,在0℃下反应只能得到43%的对映体过量值,且反应反应时间需要36 h 才能将原料完全转化完全;而对于碳酸锂则需要更长的反应时间(168 h)才能实现完全转化,但是对映体过量值仍然较低(49%).值得注意的是,当选用醋酸钾作为碱时,-40℃反应12 h,可以获得对映体过量值高达80%,且可以同时获得比较高的反应产率.最后,当选用三乙胺作为碱时,发现无论是在0℃,还是-40℃反应均不能得到比较理想的对映体过量值.基于以上的条件筛选,最后确定选用1-[3,5-双(三氟甲基)苯基]-3-[(1R,2R)-2-(二甲氨基)环己基]硫脲作为手性诱导剂,以醋酸钾作为碱,以甲苯作为反应溶剂,-40℃反应可以获得较为理想的对映体选择性及反应产率.
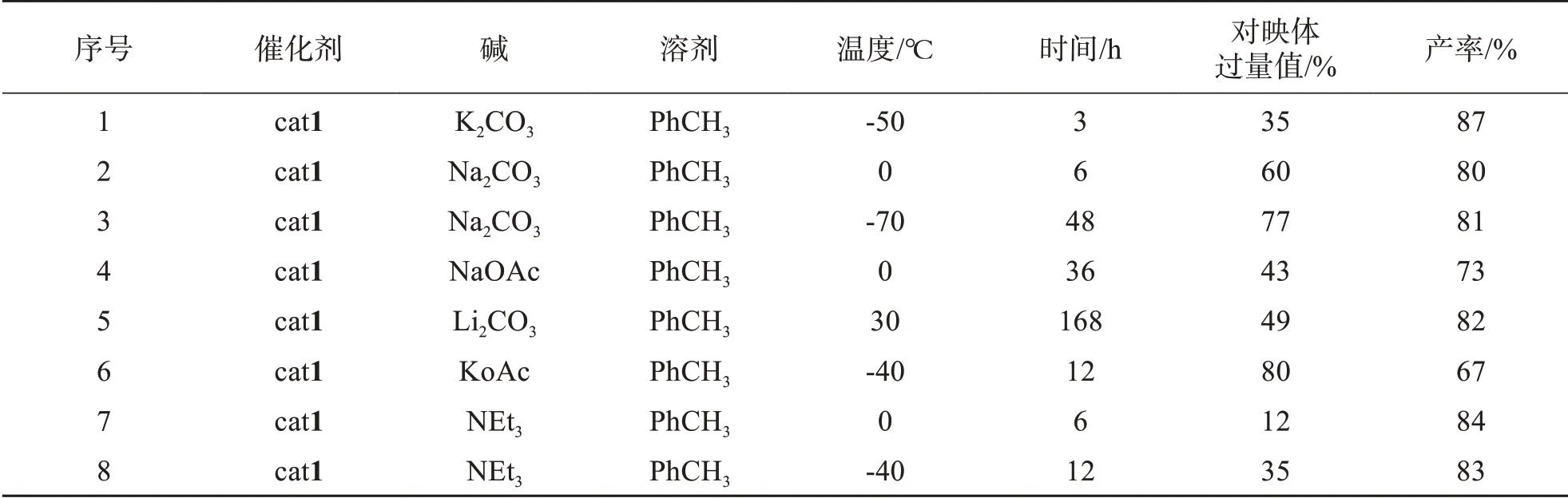
表2 手性环境下的反应条件筛选Tab.2 Screenings of reaction conditions in a chiral environment
2.1 产物的结构表征
由上述得到的呋喃酮结构产物3 的结构表征数据如下所示:核磁共振波谱数据1H NMR (500 MHz,CDCl3) δ 7. 32 (d, J = 8. 5 Hz, 2H), 6. 83 (d, J = 8. 5 Hz, 2H), 5. 18~5. 13 (m, 1H), 4. 86 (dd, J = 12. 7, 7. 2 Hz, 1H), 4. 53~4. 52 (m, 2H), 4. 50~4. 40 (m, 2H), 4. 38~4. 35 (m, 1H), 3. 76 (s, 3H), 1.44 (t, J = 7. 1 Hz,3H);13C NMR (125 MHz,CDCl3) δ 194.6,181.1,158.9,131.2,128.7,114.1,92.6,74.8,66.7,55.2,37.1,14.6;高分辨质谱[HRMS]计算得到C15H17NNaO6(M +Na+):330.095 4,实验测得:330.094 8;红外光谱数据IR (KBr) 3 055, 2 987, 2 916, 2 848, 1 689, 1 597, 1 552, 1 514, 1 444, 1 388, 1 354, 1 265, 1 128, 1 035,738,704 cm-1.
2.2 可能的反应途径
基于上述所得到的反应结果,提出一种该反应可能的反应途径(如图6所示).在碱的环境下,β-溴代乙酰乙酸乙酯2 中的亚甲基脱除一个质子后得到碳负离子中间A,接着在手性硫脲的诱导下与(E)-4-甲氧基-β-硝基苯乙烯1 发生Michael加成反应生成中间产物B.值得一提的是,该步骤是呋喃酮产物形成手性中心的决定步骤.接着中间产物B 再经过碱的第二次脱氢反应,及随后的分子内5-exo-trig 的关环反应生成最终的含有手性中心的呋喃酮产物3.
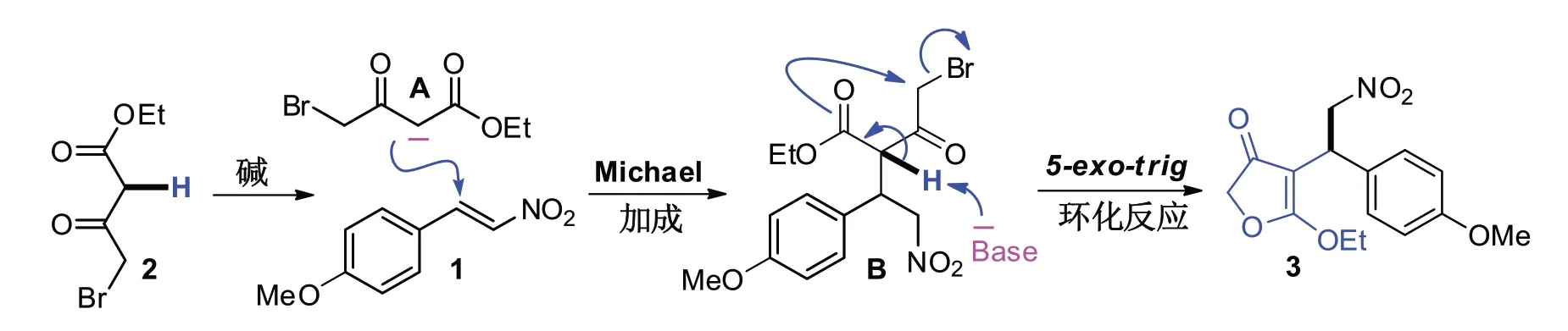
图6 可能的反应途径Fig.6 Possible reaction pathways
3 结论
经过系统的条件筛选优化,其中包含无机碱、反应温度、反应溶剂等反应要素,探索出一种方便、高效制备手性呋喃酮的方法.当选用1-[3,5-双(三氟甲基)苯基]-3-[(1R,2R)-2-(二甲氨基)环己基]硫脲作为手性催化剂,以醋酸钾作为碱,在-40℃的甲苯反应溶剂中,(E)-4-甲氧基-β-硝基苯乙烯1 与β-溴代乙酰乙酸乙酯2发生串联的Michael-5-exo-trig 环化反应,一步构建具有手性中心的呋喃酮产物3.该方法的建立为构建具有重要生物活性的呋喃酮药物分子提供一条可供选择的合成路径,具有重要的应用前景.
