急性运动降低感染风险的免疫调节机制
2020-06-05侯莉娟
陈 巍,侯莉娟
为防控新型冠状病毒(2019-nCoV)感染的肺炎疫情,全国人民积极响应国家号召,居家防护,降低交叉感染风险,但居家导致的体力活动不足可能又带来了新的健康问题。为此,国家体育总局发布《关于大力推广居家科学健身方法的通知》。如何进行科学锻炼才能提高机体免疫力并降低感染风险受到关注。众所周知,运动可对人体免疫功能产生深远影响。规律运动(regular exercise)不但可有效降低心脑血管疾病、恶性肿瘤、2型糖尿病等非传染性疾病的患病风险,而且可减少多种传染性疾病风险,对调节免疫能力具有积极作用(Lavie et al.,2015;Pape et al.,2016)。早期的研究认为,经历长时间大强度急性运动后存在“免疫抑制期”,会增加运动者机会性感染风险。运动后的感染以上呼吸道感染(upper respiratory tract infections,URTI)为代表,从事中等强度规律运动的个体较久坐人群感染发生率明显降低,从事长时间大强度运动后则具有更大感染风险(Nieman et al.,1989;Pedersen et al.,1994)。急性运动降低外周血淋巴细胞计数与功能,以及抑制唾液免疫球蛋白A水平成为解释这一现象的重要理论基础(Horn et al.,2010;Peake et al.,2017;Siedlik et al.,2016)。然而,对急性运动与免疫的关系目前仍存在分歧(Bigley et al.,2014;Campbell et al.,2018;Dhabhar et al.,2018)。正确认识急性运动与免疫功能的关系,对优化运动处方,提高大众科学参加体育活动具有重要意义。本文就急性运动对感染风险及免疫调节的现状进行系统综述。
1 急性运动诱导的免疫应答
免疫(immunity)最初是指维持生物体稳态的防御机制。现代免疫学认为,免疫还包括免疫稳定(homeostasis)与免疫监视(surveillance)。免疫系统可以清除进入人体的微生物或外源性抗原物质以及异常内源性物质,当免疫功能减弱时,人体更容易被感染或出现恶性肿瘤(Goldszmid et al.,2014);另一方面,过度的特异性免疫反应可能导致过敏性疾病或自身免疫性疾病(Dhabhar et al.,2018)。为维持机体健康及预防和治疗各种疾病,机体需要保持免疫功能稳态。
运动免疫学研究主要分为急性运动引起的免疫反应和规律运动引起的免疫适应。规律运动是指在一定时期内进行有规律的重复性运动锻炼;“急性运动”可定义为单次运动,其产生的生物学效应可持续一定时间,并可形成累积效应。急性运动时,运动对血管壁产生的机械剪切力引起外周血淋巴细胞去边集,同时激活交感神经系统,增加儿茶酚胺释放,并激活β2-肾上腺素受体(β2-AR)选择性动员淋巴细胞进入血液,使外周血淋巴细胞计数急剧增加(Simpon et al.,2015;Walsh et al.,2011)。在此过程中,那些表现出与细胞毒性增强和组织迁移有关表型的淋巴细胞亚群被优先动员到外周血中,例如NKdim细胞、CD8+T细胞和γδ T细胞等(Siedlk et al.,2016)。运动停止后的一段时间内,这些淋巴细胞亚群会迅速流出血液,导致短暂性的淋巴细胞计数减少(Dhabhar et al.,2018),同期淋巴细胞流经脾、肺、骨髓和淋巴结,确保了这些外周组织免疫反应得到适宜调节(Campbell et al.,2018)。此外,急性运动似乎还引起了唾液IgA(SIgA)分泌减少,以及外周血免疫细胞功能改变,包括细胞因子产生、细胞增殖与迁移能力、细胞毒性作用等(Simpson et al.,2020)。但上述由急性运动引起免疫细胞快速的重新分布(redeployment)可能作为一种进化保守的免疫机制,在急性应激期间对保护宿主安全具有重要意义。
2 急性运动与上呼吸道感染风险的关系
早期运动免疫学研究认为,参加长时间高强度运动会抑制人体免疫功能,进而增加机会性感染风险;规律的中等强度适量运动(<45 min)可改善免疫功能,降低感染风险(Nieman et al.,1989;Simpson et al.,2020)。此外,极低水平的体力活动和过度运动一样也会降低免疫功能,并据此提出了运动免疫的“J”型曲线。20世纪80年代末提出的“open window”理论也认为长时间高强度的急性运动会削弱人体免疫功能并增加机会性感染风险(Peake et al.,2017)。一般认为,机会性感染是由于某些因素使人体的免疫功能低下,一些在免疫功能正常时不致病的病原微生物能够趁机侵入人体引起感染导致传染性疾病发生。20世纪末以来,体育锻炼、身体活动与机会性感染风险之间的关系成为研究热点,研究者们开展了大量深入研究。
URTI是影响运动员训练和比赛最主要的感染事件,可由多种病毒和细菌等微生物侵袭呼吸道粘膜引发,URTI会严重影响患者数周的生活质量,可诱发多种疾病,包括急性支气管炎、普通感冒、流行性感冒和呼吸窘迫综合征等(Reid et al.,2004),少数人可能还会患上肺炎、脑膜炎、败血症和支气管炎等疾病。目前,尚未见实际可缩短病毒性URTI持续时间的治疗方法,疫苗最多只能在40%~60%的个体中发挥作用(Thomas et al.,2020)。有研究发现,多城市参加马拉松比赛的选手URTI较同一居住区人群增加1倍(Peter et al.,1983)。赛前未报告感染的选手,赛后1周感染发生率约为未参赛人群的6倍。然而,持续时间较短的运动似乎并未增加上呼吸道感染发生率(Nieman et al.,1989)。有研究指出,进行长时间剧烈运动会引起更多的与URTI相关的症状,尤其是在重大体育赛事后的数小时内(Cox et al.,2008;Gleeson et al.,2016)。还有研究认为,运动后URTI的发生与持续的运动疲劳有关(Reid et al.,2004)。
尽管许多运动者的自我报告认为URTI由感染引起,但由于缺乏直接实验证据,URTI是否能够代表实际感染受到越来越多的质疑。Spence等(2007)通过对63名铁人三项和自行车运动员与20名对照受试者进行了采样,发现在37例具有URTI症状的受试者中仅有11例存在细菌、病毒、衣原体或支原体性质的实际感染。可见,并非所有运动后的URTI症状都由感染引发,当运动员频繁出现URTI症状时,应考虑可能存在其他非感染因素(Cox et al.,2008)。例如,运动性过敏、通气量增加导致上皮细胞损伤等情况。此外,参加群体性活动本身可能就会增加新型传染性病原体的感染 风险(Campbell et al.,2018;Choudhry et al.,2007)。从现有证据看,运动后感染风险增加的最主要的因素仍然是人员接触。因此,新冠肺炎疫情防控期间为防止人员聚集,暂停全国各地体育赛事活动是减少感染有效措施。影响运动后感染风险的因素可能还与长途旅行、低压缺氧、辐射、温度骤变、睡眠不足、脱水、感染史、接种史以及关键的免疫防御基因的单核苷酸多态性等因素有关(Campbell et al.,2018;Lesley et al.,2015;Simpson et al.,2020)。事实上,也有长时间大强度运动降低感染的证据。Fondell等(2011)对1 509名20~60岁的瑞典男性和女性进行了随访期为4个月的前瞻性队列研究,发现与低水平体力活动(<45 MET·h·d-1)群体相比,高水平体力活动(≥55 MET·h·d-1)群体自我报告 URTI降低18%。对运动员群体的研究也发现,高水平的训练强度和运动量往往与低患病率相关(Hoffman et al.,2014)。这些现象促使我们重新审视急性运动与免疫之间的关系。
3 急性运动对粘膜免疫功能的影响
粘膜免疫系统(mucosal immune system,MIS)通常是指广泛分布于呼吸道、胃肠道、泌尿生殖道等处的粘膜内的淋巴组织组成的,负责保护粘膜表面,执行局部特异性免疫的主要场所。IgA是粘膜分泌物中最丰富的免疫球蛋白,急性运动对粘膜免疫功能的影响已受到广泛关注,特别是SIgA(Bishop et al.,2009)。其变化可能会影响粘膜系统对病毒感染的保护作用。早期研究发现,长时间剧烈运动后运动者SIgA明显下降,但在24 h内基本可恢复到正常水平(Mackinnon et al.,1989)。由于唾液产生量可能会影响IgA分泌的测量结果,也有一些研究通过测量IgA分泌率(IgA蛋白浓度×唾液流速)评价急性运动对SI-gA的影响,同样支持了早期的相关研究结果(Campbell et al.,2018;Neville et al.,2008)。但Engels等(2018)研究了最大摄氧量(O2max)测试对青春期女性SIgA水平的影响,并对安静状态下SIgA水平与O2max、体力活动、身体成分和饮食之间的关系进行了探讨,结果发现,O2max测试后SIgA的绝对浓度显著增加,并在运动2 h后恢复到运动前水平,同时还观察到受试者O2max与体力活动水平和SIgA的急性变化均相关。
虽然有研究发现,急性运动会抑制SIgA的分泌,但SIgA分泌量和速率的影响因素很多,受睡眠、昼夜节律、心理压力、饮食习惯及口腔健康等的影响(Campbell et al.,2018)。导致SIgA水平在不同时间段内的波动很大,即使是对同一个体间(Rapson et al.,2020)。但是现有研究很少考虑已知影响SIgA分泌的混杂因素,也并未能够证实急性运动能够抑制浆细胞的免疫球蛋白的分泌。有研究认为,剧烈运动后感染的发生率与SIgA水平的变化并不存在直接关系(Antualpa et al.,2018)。可见,确定急性运动是否增加感染风险,使用SIgA作为体液免疫生物标记物是否得当仍存在分歧。更多的研究认为,SIgA是复发性粘膜感染的生物标志物,而与运动状态的关系不大。因此,目前将急性运动后SIgA水平下降作为感染风险增加的标志是不合适的。后续研究应注意排除上述非运动混杂因素的影响。
4 急性运动对淋巴细胞免疫应答的影响
急性运动引起外周血淋巴细胞表型和功能发生明显的时间依赖性变化(Campbell et al.,2009;Simpson et al.,2015)。大强度有氧运动过程中,通常可观察到外周血淋巴细胞计数及功能提高,而运动后的几个小时内,外周血淋巴细胞计数及淋巴细胞功能又低于运动前水平(Cox et al.,2008;Simpson et al.,2015)。基于此,普遍认为高强度急性运动会引起免疫抑制,增加感染风险。然而根据现有研究,急性运动后外周血淋巴细胞计数和功能短暂下降可能是淋巴细胞向周围组织进行了重新分布,进而提高外周组织的免疫监视和调节功能(Dhabhar et al.,2012;Spielmann et al.,2016)。由此可见,运动后外周血淋巴细胞计数与功能改变是否能够准确反应免疫功能抑制值得商榷。
4.1 急性运动对淋巴细胞计数及功能的影响
4.1.1 急性运动对淋巴细胞计数的影响
外周血淋巴细胞计数对急性运动反应呈明显双相性。首先,表现为运动引起淋巴细胞计数明显增多,特别是NK细胞与CD8+T细胞可增加数倍(Splelmann et al.,2016;Walsh et al.,2011)。停止运动后,外周血中淋巴细胞计数急剧下降,在运动后1~2 h达最低点,且低于运动前水平,一般24 h内恢复(Walsh et al.,2011)。急性运动引起的淋巴细胞变化程度和运动强度密切相关,即使持续几分钟的高强度运动,细胞总数也会增加2~3倍,而长时间耐力运动则会增加5~10倍(Campbell et al.,2009)。其中,淋巴细胞和中性粒细胞受到的影响最大,单核细胞受影响较小(Maha et al.,2018)。急性运动后通常也是NK细胞和CD8+T细胞的减少最为明显(Campbell et al.,2009)。Bigley等(2014)的研究发现,持续30 min 65%~90%HRmax强度的急性运动均可诱导外周血NK细胞计数明显变化。因为大量的淋巴细胞在运动后会重新分布至肠道、肺、骨髓等组织(Dhabhar et al.,2018;Rachel et al.,2018)。
4.1.2 急性运动中外周血淋巴细胞计数增加的可能机制
急性运动通过应激反应快速动员淋巴细胞进入外周循环,可将其迅速迁移至受伤或易受病原体侵袭的部位,以便抵抗潜在伤害,这是细胞免疫应答的典型特征(Dhabhar et al.,2018a,2012b)。运动优先动员表达高水平表面粘附分子的淋巴细胞和单核细胞,进而增加其细胞毒性与抗原呈递。例如,NK细胞、γδ T细胞、CD8+T细胞和“非经典”单核细胞的动员比CD4+T细胞、B细胞或“经典”单核细胞要多。较成熟的CD8+T细胞的动员优先于未成熟亚型。例如,中央记忆型T细胞(central memory T cell)、效应记忆型(effector memory,EM)T细胞和CD56dim/CD57+NK 细 胞 等(Campbell et al.,2009;Simpson et al.,2015;Steppich et al.,2000)。血管中除了自由循环的白细胞外,还有部分因血流较缓附着在血管边缘的内皮细胞上,即白细胞边集(leukocytic margination)。急性运动导致血流动力学明显改变从而增加对血管内皮细胞的机械剪切力,使白细胞从边缘池动员到血液主要轴向流中(Steppich et al.,2000)。此外,运动还会通过增加淋巴流量促进白细胞进入外周血,特别是中性粒细胞和大多数单核细胞(Peake et al.,2017)。此过程受多种因素影响,如潜在的病毒感染与睡眠状态等(Bigley et al.,2014;Lesley et al.,2015)。
研究证明,急性运动主要通过淋巴细胞表面的β2-AR动员细胞重新分布,运动过程中由于交感神经系统与下丘脑—垂体—肾上腺轴的活动加强,引起促肾上腺皮质激素释放激素、儿茶酚胺释放增加,驱动淋巴细胞进入循环(Lesley et al.,2015;Rachel et al.,2018)(图1)。由于淋巴细胞β2-AR表达存在差异,导致不同淋巴细胞亚型被动员的速率也存在相应的差异(Clifford et al.,2017;Turner et al.,2016)。在淋巴细胞经典β2-AR信号途径中,β2-AR通过Gαs亚基调节腺苷酸环化酶(adenylate cyclase,AC)活性。β2-AR被儿茶酚胺激活后导致Gα与Gs蛋白的Gβγ亚基复合物解离,通过AC介导ATP转换为cAMP。cAMP激活蛋白激酶A-I(PKA-I)或-II,导致cAMP反应元件结合蛋白(cAMP-response element binding protein,CREB)等转录因子激活,进而调节基因转录,引起生物学效应(Lorton et al.,2015;Rachel et al.,2018)(图2)。急性运动可促进NK细胞β2-AR的敏感性(Bigley et al.,2014)。Fragala等(2011)发现,急性抗阻训练的恢复期淋巴细胞β2-AR表达增加。但目前急性运动对β2-AR信号转导有怎样的影响还未知。急性运动所动员免疫细胞的来源主要包括肝、肺和脾等器官。此外,外周淋巴结、胃肠道、骨髓、胸腺及骨骼肌也含有大量白细胞(Bigley et al.,2015;Dhabhar et al.,2018;Simpson et al.,2015)。
4.1.3 急性运动后外周血淋巴细胞计数减少的可能机制
运动停止后,外周血淋巴细胞计数开始急剧下降,且在运动后2 h达到最低水平(Walsh et al.,2011)。这是因为在运动恢复期由于糖皮质激素的作用,淋巴细胞与单核细胞开始大量离开血液,迁移到外周组织进行重新分布,由于表面粘附分子和趋化因子受体的表达存在差别,导致不同的淋巴细胞亚型具有与组织迁移相一致的表型,这些淋巴细胞所迁移到的位置是更容易遭遇抗原物质的部位(Campbell et al.,2009;Dhabhar et al.,2012)。2019-nCoV以血管紧张素转化酶2(angiotension converting enzyme 2,ACE2)作为受体侵入细胞,由于人体肺泡2型细胞高表达ACE2,肺部因此成为被侵袭的首要靶器官之一。Zou等(2020)通过人体各系统器官的单细胞RNA测序数据,分析相关脏器和细胞类型的ACE2,构建了易受该病毒侵袭的器官风险图,认为气道、食道、肺、心脏、肾、回肠和膀胱等均具有被2019-nCoV侵袭的风险。急性运动后被动员至外周组织的淋巴细胞可能具有更强识别并清除已感染细胞的重要功能,对降低2019-nCoV感染风险可能具有积极作用。
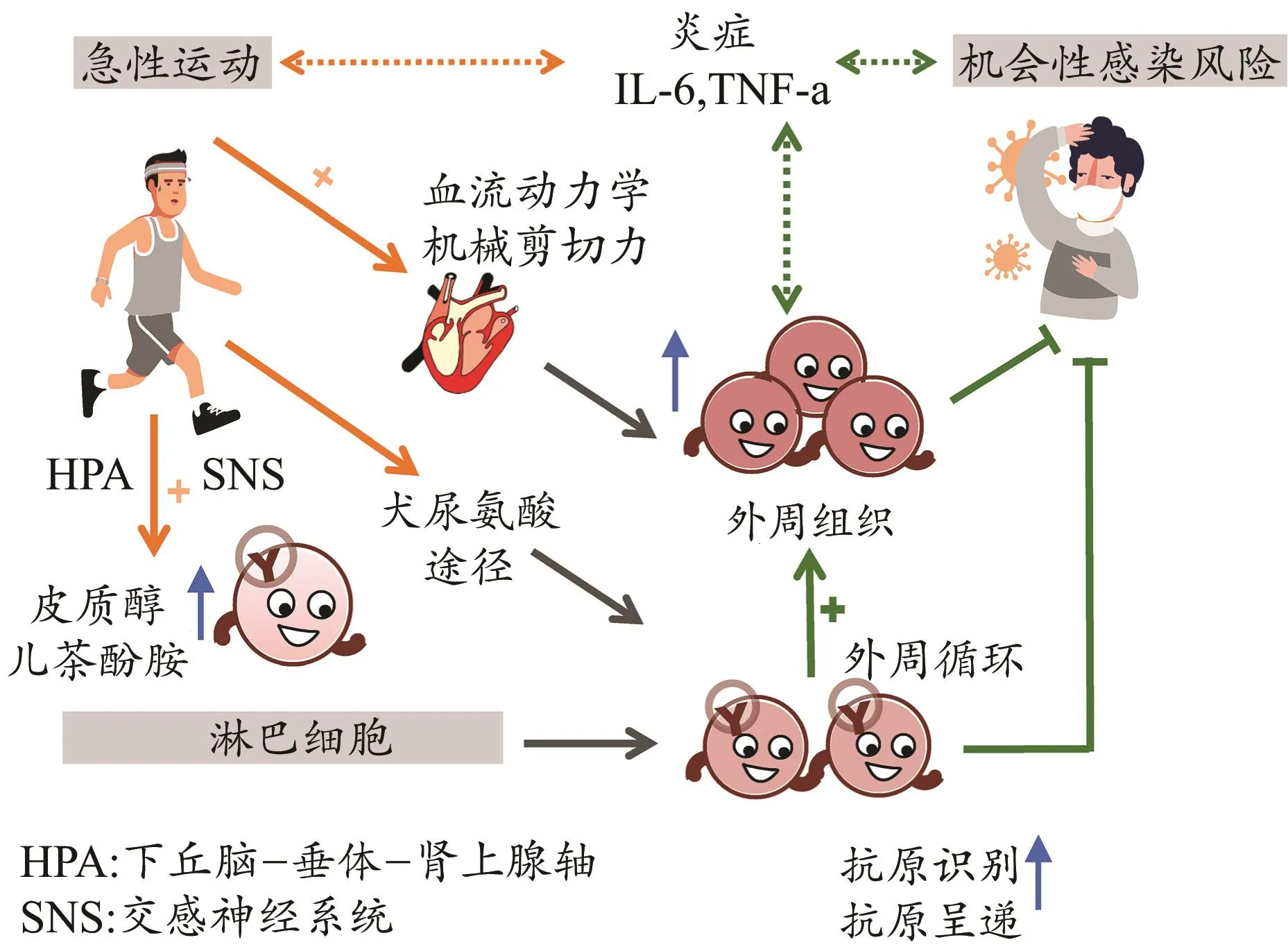
图1 急性运动对淋巴细胞重新分布的影响Figure 1. Effect of Acute Exercise on Lymphocyte Redistribution
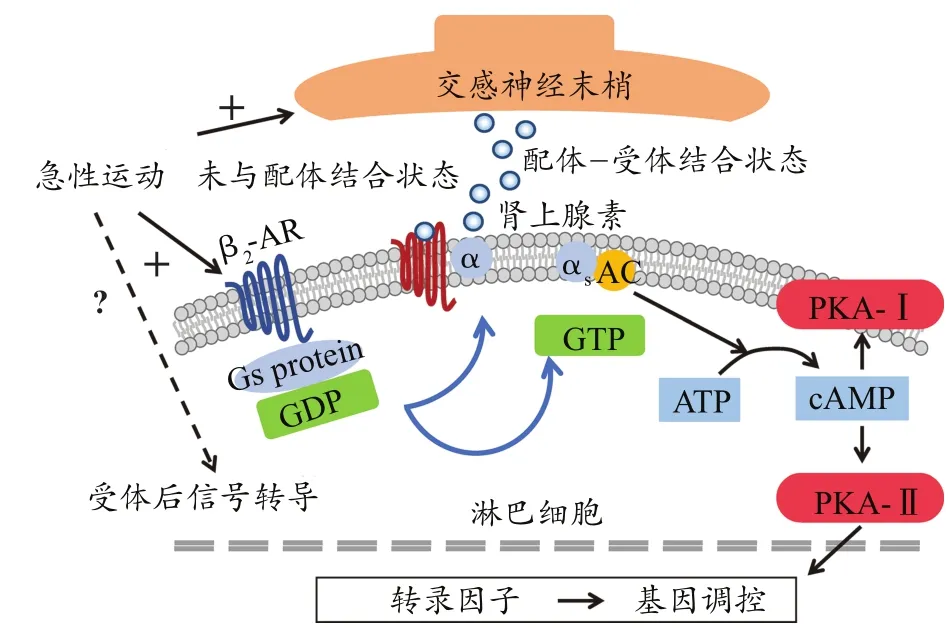
图2 急性运动对淋巴细胞β2-AR信号途径的可能影响Figure 2. Possible Effects of Acute Exercise on the β2-AR Signaling Pathway of Lymphocytes
运动诱导淋巴细胞凋亡也曾被认为是运动后外周血淋巴细胞计数下降的原因之一,且会抑制免疫功能。但有研究发现,运动诱导的细胞凋亡并不会引起明显的炎症反应,而是机体为加速清除受损细胞的必要过程(Campbell et al.,2018;Mooren et al.,2015)。也有研究认为,运动诱导的淋巴细胞凋亡增加只出现在运动后即刻,在运动后淋巴细胞减少时并未表现为凋亡增加。运动后淋巴细胞凋亡会刺激骨髓祖细胞的进一步增殖,这对免疫细胞的稳态可能是有利的(Kruger et al.,2014)。因此,急性运动引起的淋巴细胞凋亡可能很大程度上是“衰老”淋巴细胞的选择性凋亡,使其能够被新生淋巴细胞所替代。另外,细胞自噬可能也是运动抗感染的免疫调节机制之一(戈哲等,2019)。
4.2 急性运动对外周血淋巴细胞功能的影响及相关机制
4.2.1 急性运动对外周血淋巴细胞功能的影响
淋巴细胞增殖反应通常被用于临床免疫功能评估,被认为与运动引起的适应性免疫应答有关。T细胞在抗原刺激下可增殖形成多个效应T细胞克隆,能够识别引起初期反应的抗原,并摧毁表现出抗原特性的细胞(Christen et al.,2019;Goldszmid et al.,2014)。使用不同的促分裂原以刺激淋巴细胞,通过测定淋巴细胞的增殖率评价免疫功能。例如,伴刀豆球蛋白A(concanavalin A,con-A)和植物血凝素(phytohemagglutinin,PHA)经常用来评价T细胞的增殖功能(campbell et al.,2018;Simpson et al.,2015)。Bishop等(2009)的研究发现,以 60%O2max的运动强度进行 120 min 跑步,60 min 后 CD4+和CD8+T细胞向上清液的迁移明显减少,提示T细胞增殖能力与迁移能力下降。此外,NK细胞的细胞毒性评价通常是将人类外周血单核细胞(peripheral blood mononuclear cell,PBMC)与肿瘤靶细胞共同培养,对PBMC中NK细胞和死亡靶细胞进行定量来确定的。因此认为,急性运动会导致NK细胞的细胞毒性增加,在运动恢复期间又会被迅速抑制(Simpson et al.,2015)。但也有研究发现,30 min急性运动的恢复期,外周血NK细胞的细胞毒性效应出现增强(Bigley et al.,2014)。
4.2.2 急性运动引起淋巴细胞功能的变化的可能原因
尽管有研究表明,急性运动降低了淋巴细胞增殖能力,但淋巴细胞增殖是否能够代表运动中或运动后的免疫功能仍有争议。有学者认为,丝裂原会导致普遍的T细胞反应,但这并不代表记忆T细胞的抗原特异性。因为运动引起的外周血单个核细胞的T细胞亚群比例改变,很可能与T细胞功能改变产生混淆(Campbell et al.,2018)。运动后外周血液淋巴细胞计数的短暂变化也会导致总体细胞功能受影响,这受所采样的细胞性能来决定。急性运动引起血液和外周组织间免疫细胞重新分布的巨大变化可能会对这种评估形成较大的误差。虽然运动恢复期外周血T细胞的增殖和迁移能力出现下降,但具有效应功能的T细胞亚群很可能在体内也已进行了迁移。例如,CD8+T细胞亚群在运动中会明显增加,而运动后相同效应CD8+T细胞会被重新分配到外周组织,可能会导致外周血中对体外刺激产生免疫应答的细胞数量减少,从而被认为免疫细胞功能下降(Cox et al.,2008;Spielaann et al.,2016)。对其他免疫细胞功能的评价也存在同样问题。此外,睡眠、潜在的病毒感染均会影响急性运动介导淋巴细胞的细胞毒性效应(Bigley et al.,2014;Campbell et al.,2018;Lesley et al.,2015)。因此,长时间剧烈运动后的数小时内,外周血淋巴细胞及其他免疫细胞比例和功能的变化并不能准确地反映免疫功能。健康青年男性进行1次高强度间歇踏车训练后(100%O2max运动1 min,50 W踏车75 s,重复8组),同样可诱导淋巴细胞亚群重新分布,其中,Th细胞和CD8highT细胞被选择性地优先动员,而且运动后即刻T细胞免疫应答能力得到增强,并未发现运动后恢复期存在免疫抑制(陈华伟等,2017)。Kyung等(2019)采用旋毛虫(T.spiralis)感染小鼠骨骼肌作为感染模型,通过抗原与细胞因子之间相互作用来评价运动对感染的影响,结果发现,受过训练的小鼠急性运动后感染率并未明显增加,并认为运动可通过细胞因子介导抗原特异性免疫应答降低感染率。
4.3 急性运动影响细胞免疫的抗炎症机制
炎症(inflammation)对机体免疫功能具有重要的调节作用。局部炎症可影响效应T细胞与巨噬细胞的活化,进而影响细胞免疫与体液免疫的激活。急性运动后抗炎细胞因子释放有助于缓解系统性炎症反应(Koliamitra et al.,2019;Suzuki et al.,2019)。特别是运动期间从骨骼肌释放的肌肉细胞因子(myokines)在其中可能扮演了重要角色(Penersen et al.,2008)。Koliamitra等(2019)发现,急性运动可通过犬尿氨酸途径促进老年健康女性的调节性T细胞(Tregs)水平,犬尿氨酸途径激活与抗炎症能力提高之间存在相互作用。近年来的研究还发现,运动可下调单核细胞和巨噬细胞上Toll样受体表达,从而减轻其下游炎症信号的级联反应。例如,运动可通过降低血浆游离脂肪酸,抑制Toll样受体4(TLR4)激活,TLR4受体是肥胖患者FFAs激活先天免疫系统的关键受体(Ringseis et al.,2015)。运动还可促进M1型巨噬细胞向M2型转变,并减少巨噬细胞向脂肪组织的浸润,从而减少炎性细胞因子产生。此外,急性运动后可引起白细胞介素-10(interleukin-10,IL-10)大量释放,Cabral等(2019)认为,急性运动的持续时间是决定血浆IL-10水平最重要的影响因素,IL-10是典型的抗炎症细胞因子,其参与了B细胞和CD8+T细胞的活化过程。
5 小结与展望
急性运动导致外周血淋巴细胞计数与功能降低,减少SIgA分泌,引起免疫抑制,经常被用作急性运动后感染发生的理论基础。对急性运动增加感染风险的过度解读在一定程度上成为影响运动参与的桎梏。从现有研究看,SIgA水平受多种非运动因素的影响,其水平与分泌率在不同时间段和个体间均存在较大差异。因此,SIgA是否可作为运动后体液免疫生物标记物还有待探讨。急性运动后数小时内,外周血淋巴细胞计数和功能降低也并不能准确反映免疫抑制。急性运动引起的血液动力改变,以及血浆儿茶酚胺与β2-AR作用引起淋巴细胞重新分布,有利于特定免疫细胞亚型优先迁移至易被病原体感染的外周组织,以提高其免疫监视和调节功能,进而降低感染风险。由于人体对新型病毒及微生物不具有先天免疫,且免疫力低下的人群更容易被感染,因此,急性运动可能对提高新型病毒及其他微生物抵抗力具有积极的影响。目前,研究也在尝试通过急性运动诱导免疫应答以提高疫苗接种效果,抑制恶性肿瘤生长等。后续研究应进一步确定特定形式的急性运动是否可改善人体对特异性抗原的免疫能力及相关机制,并控制非运动混杂因素的影响,这对未来运动免疫学的临床应用具有重要作用。
