克氏原螯虾抗菌肽crustin5基因克隆及其表达分析
2020-06-04李博王凯于晓东刘睿哲蔺思函商静沈秀丽杜志强
李博 王凯 于晓东 刘睿哲 蔺思函 商静 沈秀丽 杜志强


摘要:【目的】深入了解克氏原螯蝦先天免疫过程中抗菌肽的作用与功能,丰富先天免疫中抗菌肽的理论知识,为克氏原螯虾的病害机理研究及防控措施制定提供参考依据。【方法】从克氏原螯虾肝胰腺组织提取总RNA,利用PCR扩增crustin5基因全长cDNA序列,运用DNAMAN 6.0、ProtParam、ProtScale、SOPMA和SWISS-MODEL等在线软件对其进行生物信息学分析,并以实时荧光定量PCR检测crustin5基因在克氏原螯虾各组织中的表达情况。【结果】克氏原螯虾crustin5基因cDNA序列全长954 bp,开放阅读框(ORF)为429 bp,共编码167个氨基酸残基,其编码蛋白相对分子量为16485.42 Da,理论等电点为8.58,为不稳定的疏水性蛋白。克氏原螯虾crustin5蛋白具有典型的crustins家族结构特征,包括N端的信号肽,C端的WAP结构域,以及二者间的半胱氨酸富集区;其二级结构中α-螺旋、β-转角、无规则卷曲和延伸链分别占20.36%、7.78%、58.08%和13.77%。crustin5基因在克氏原螯虾血细胞、肝胰腺、鳃、肠道、肌肉和淋巴器官等6种组织中均有不同程度的表达,以在血细胞中的相对表达量最高,淋巴器官次之,在肌肉组织中的相对表达量最少。【结论】克氏原螯虾抗菌肽crustin5具有典型的crustins家族结构特征,且主要分布在血细胞和淋巴器官中,说明crustin5是在克氏原螯虾的血淋巴中参与先天免疫并发挥抗菌作用。
关键词: 克氏原螯虾;抗菌肽;crustin5基因;先天免疫;表达差异
Abstract:【Objective】To understand the role and function of antimicrobial peptides in the innate immunity of Procambarus clarkii, and enrich the theoretical knowledge of antimicrobial peptides in innate immunity. It provided reference for the study on the mechanism of P. clarkii diseases and the formulation of prevention measures. 【Method】Total RNA was extracted from the liver and pancreas of P. clarkii , and crustin5 gene cDNA full-length sequence was amplified by PCR technology. And bioinformatics analysis was carried out on it by online softwares including DNAMAN 6.0, ProtParam, ProtScale, SOPMA and SWISS-MODEL. crustin5 gene expression in tissues of P. clarkiiwas detected by qRT- PCR. 【Result】 The study found that the crustin5 gene had a full-length cDNA of 954 bp, an open reading frame(ORF) of 429 bp, and encoded 167 amino acid residues. The predicted molecular weight of the protein was 16485.42 Da, and the theoretical isoelectric point was 8.58. The crustin5 protein was unstable hydrophobic protein. It had the characteristic structure of the crustins family, including the N-terminal signal peptide, the C-terminal WAP domain, and rich in hemicarboxy-lamine between them. The secondary structure of protein, alpha-helix, beta-corner, random curl and extension chain accounted for 20.36%, 7.78%, 58.08% and 13.77% respectively. The crustin 5 gene was expressed to different degrees in six tissues(hemocytes, hepatopancreas, gill, intestinal tract, muscle andlymphoid organs). The highest expression was in hemocytes, followed by lymphoid organs, andthe lowest in muscle. 【Conclusion】The crustin5 of P. clarkii antimicrobial peptide has the characteristic structure of crustins family, is mainly distributed in hemocytes and lymphatic organs. It suggests that crustin5 plays an antibacterial role in hemolymph and participate in the innate immunity of P. clarkii.
0 引言
【研究意义】近年来,淡水养殖业发展势头迅猛,尤其是虾类养殖,但同时遭受细菌和病毒等病原体的严重侵害。克氏原螯虾(Procambarus clarkii)又称淡水小龙虾,其在感染细菌和病毒时主要依靠先天免疫进行抵抗(韩珂珂,2019)。在先天免疫过程中,克氏原螯虾会产生一种重要的免疫效应因子,即抗菌肽(Crustin),其对细菌、真菌及病毒等病原体具有广谱的抑制效果。抗菌肽对不同细菌均具有抑菌活性,尤其对革兰氏细菌具有很强的杀伤作用(郭慧等,2013;马春霞等,2017),同时兼具抗病毒作用、免疫调节作用(吴希,2006)及对真菌的杀伤作用(王显伟,2012)。因此,加强克氏原螯虾抗菌肽研究,丰富有关先天免疫中抗菌肽的理论知识,对确保克氏原螯虾养殖业持续健康发展具有重要意义。【前人研究进展】抗菌肽是由DNA编码合成于核糖体的多肽,不同类型的抗菌肽存在许多相似之处,一般为短肽(30~60个氨基酸),具有强阳离子性[等电点(pI)8.9~10.7]等特点(Ferrer et al.,1996;Boulanger et al.,2006)。第一个抗菌肽是由瑞典科学家Boman等于1980年从蜡样芽抱杆菌诱导的惜古比天蚕(Hyalophora cecropia)蛹淋巴液中分离获得(Boman and Steiner,1981),即天蚕素(Cecropins)。此后,诸多学者开始对抗菌肽研究产生兴趣浓厚,并在海洋动物中发现了多种新型的抗菌肽(王晓飞等,2019)。Acosta等(2014)在从罗非鱼鳃组织分离出的鱼素中鉴定获得3种新的抗菌肽,分别是Orech-1、Orech-2和Orech-3;Doiron等(2018)在雪蟹(Chionoecetes opilio)水解产物中发现5种新的抗菌肽,分别是Arthrodial cuticle protein AMP6.0、I-connectin、Hyastatin、Vitellogenin和Slow-tonic S2 myosin heavy chain。随着抗菌肽鉴定种类的增加,为抗菌肽家族的研究与发展奠定了基础。此外,各种抗菌肽间具有相似的结构和特点。Liao等(2013)、Zhong等(2013)分别在夏鲁贻贝(Mytilus coruscus)和巴西蜗牛(Achatina fulica)黏液中发现新的抗菌肽,其共同特点是半胱氨酸含量较高;Qu等(2013)在石斑鱼(Epinephiu scoioides)中发现一种抗菌肽亚型,也具有半胱氨酸含量较高的特点;Park等(2018)发现的Rip-thanatin与Shenkarev等(2012)发现的Aurelin及Zhang等(2015)报道的蛤蜊抗菌肽具有相似结构,均包含2个α-螺旋区和3个二硫键交联。最主要的共同特点是抗菌肽均具有较强抗菌活性,Wei等(2015)从海蛇中提取获得的抗菌肽、Salger等(2016)在白鲈鱼中发现的抗菌肽及Zhuang等(2017)從石斑鱼中鉴定出的抗菌肽,均具有强大的广谱抗菌活性:I类抗菌肽对细菌和纤毛原生动物表现出广谱抗菌活性,III类抗菌肽主要表现出抗原生动物活性,II类抗菌肽的抗细菌和原生动物活性则处于I类抗菌肽与III类抗菌肽之间。【本研究切入点】先天免疫是生物体在进化过程中形成的一种天然防御机制,是生物体开启免疫应答的基础(高洁等,2016),对进入生物体内的抗原性物质有无选择性排斥和清除功能(杜欣军,2007)。无脊椎动物仅依靠先天免疫就能有效抵抗和防御复杂环境中的病原体侵染(孙晨,2011;徐鑫和刘忠渊,2014),抗菌肽是体液免疫中的重要效应分子,但至今有关抗菌肽在克氏原螯虾先天免疫过程中的作用机理鲜见报道。【拟解决的关键问题】克隆克氏原螯虾抗菌肽crustin5基因并进行组织表达特性分析,旨在深入了解克氏原螯虾先天免疫过程中抗菌肽的作用与功能,丰富先天免疫中抗菌肽的理论知识,为克氏原螯虾的病害机理研究及防控措施制定提供参考依据。
1 材料与方法
1. 1 试验材料
健康克氏原螯虾购自内蒙古包头市友谊水产市场,在实验室无菌条件下采集其肝胰腺组织,快速置于液氮中保存,用于总RNA提取。总RNA提取试剂盒(TRIzol Total RNA Reagent)、cDNA第一链合成试剂盒(Thermo Scientific RevertAid First Stand cDNA Synthesis Kit)、PCR反应套装试剂盒、DNA纯化回收试剂盒、质粒DNA小量提取试剂盒及SYBR Premix Ex TaqTM II均购自宝生物工程(大连)有限公司;DL2000 DNA Marker、DNA Ladder 1kb Marker和实时荧光定量PCR引物购自生工生物工程(上海)股份有限公司。主要仪器设备:高速冷冻离心机(盐城凯特实验仪器有限公司),PCR仪(北京线上生物科技有限公司),电泳仪(北京生东科技有限公司),ABI 7500实时荧光定量PCR仪[英潍捷基(上海)贸易有限公司]。
1. 2 总RNA提取
将液氮中的克氏原螯虾肝胰腺组织取出,利用TRIzol Total RNA Reagent提取总RNA,以1.5%琼脂糖凝胶电泳检测其完整性,用灭菌DEPC双蒸水稀释后置于-80 ℃冰箱保存备用。
1. 3 cDNA合成
根据Thermo Scientific RevertAid First Stand cDNA Synthesis Kit说明,以Oligo(dT)18为引物,将提取获得的总RNA反转录合成cDNA,-80 ℃冰箱保存备用。
1. 4 目的基因PCR扩增
依据本课题组前期的克氏原螯虾转录组测序结果,并参照NCBI已公布的各物种抗菌肽基因序列,设计特异性引物(F:5'-CAGCAGGACGCTGAC GGC-3',R:5'-TTACCCTGAACAGGGCTG-3'),以cDNA为模板扩增目的基因。PCR扩增程序:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 40 s,进行35个循环;72 ℃延伸10 min,4 ℃结束反应。取3.0 ?L PCR扩增产物进行1.0%琼脂糖凝胶电泳检测。
1. 5 重组载体构建及序列测定
PCR扩增产物经1.0%琼脂糖凝胶电泳验证后,利用DNA纯化回收试剂盒进行目的基因回收;用DNA小量提取试剂盒提取大肠杆菌pET-28a质粒载体,以EcoRⅠ和XhoⅠ限制性内切酶对目的基因和pET-28a质粒载体进行双酶切,在T4连接酶作用下进行酶联反应,获得的重组质粒pET-28a-crustin5转化大肠杆菌DH5α感受态细胞;同时提取重组质粒pET-28a-crustin5,继续转化BL21(DE3)感受态细胞,筛选阳性克隆送至生工生物工程(上海)股份有限公司进行测序。
1. 6 生物信息学分析
1. 6. 1 目的基因序列分析 使用BLAST對目的基因cDNA全长序列进行分析,并通过ExPASy将其翻译成氨基酸序列。
1. 6. 2 氨基酸序列比对与系统进化树绘制 使用NCBI中的BLAST对目的基因序列和已知基因序列进行对比,利用DNAMAN 6.0对克氏原螯虾crus-tin5氨基酸序列与已知的crustin氨基酸序列进行多序列对比分析,并以MEGA 6.0绘制系统发育进化树,分析其进化关系。
1. 6. 3 目的蛋白理化性质分析 采用ProtParam(https://web.expasy.org/protparam/)对crustin5蛋白进行理化性质预测分析,包括相对分子量、理论等电点、氨基酸组成、蛋白不稳定指数、脂肪系数及亲水性平均系数等,并使用ExPASy中的ProtScale(https://web.expasy.org/protscale/)对crustin5蛋白进行亲/疏水性分析。
1. 6. 4 crustin 5蛋白二、三级结构预测 利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL(http://swissmodel.expasy.org/)分别预测crustin5蛋白二、三级结构。
1. 7 组织差异表达分析
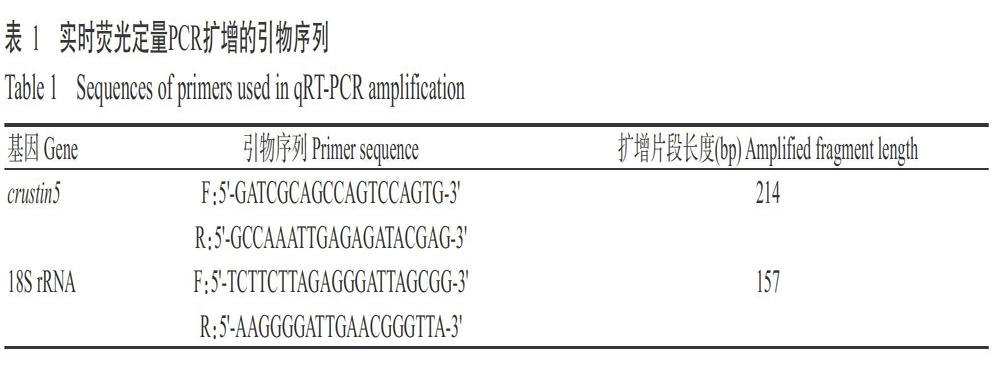
随机挑取暂养1周的健康克氏原螯虾(3尾以上),解剖采集其血细胞、肝胰腺、鳃、肠道、肌肉和淋巴器官等6种组织。提取总RNA后反转录合成cDNA,使用SYBR Premix Ex TaqTM II在ABI 7500实时荧光定量PCR仪进行crustin5基因表达定量分析,以18S rRNA为内参基因。实时荧光定量PCR扩增引物如表1所示,扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 34 s,进行40个循环。利用2-??Ct法换算crustin5基因在克氏原螯虾各组织中的相对表达量。
2 结果与分析
2. 1 克氏原螯虾crustin5基因的PCR扩增结果
PCR扩增产物经1.0%琼脂糖凝胶电泳检测,结果(图1)显示,在500 bp附近有一条单一、清晰的目的条带,与预期结果(429 bp)相符,表明已成功扩增获得克氏原螯虾crustin5基因。
2. 2 重组质粒菌液PCR鉴定结果
以重组质粒pET-28a-crustin5转化DH5α感受态细胞,经扩大培养后挑取阳性菌落进行PCR鉴定,采用1.0%琼脂糖凝胶电泳进行验证,发现在500 bp附近出现一条清晰的目的条带(图2),与预期结果(429 bp)相符。提取重组质粒pET-28a-crustin5后将其转化BL21(DE3)感受态细胞,经菌液PCR鉴定及1.0%琼脂糖凝胶电泳检测,也获得一条与预期结果相符的明亮条带。
2. 3 克氏原螯虾crustin5基因测序分析结果
重组质粒pET-28a-crustin5转化BL21(DE3)感受态细胞后,筛选出阳性克隆送至生工生物工程(上海)股份有限公司进行测序,结果表明,克氏原螯虾crustin5基因cDNA序列全长954 bp,开放阅读框(ORF)为429 bp,共编码167个氨基酸残基(图3)。crustin5蛋白具有典型的crustins家族结构特征,包括N端的信号肽(图中红色字体部分),C端的WAP结构域(灰色区域部分),以及二者间的半胱氨酸富集区。
2. 4 crustin5氨基酸序列同源性分析结果
根据NCBI中的BLAST对比分析结果,挑选出与克氏原螯虾物种相近、基因序列同源性较高的crustin氨基酸序列,并利用DNAMAN 6.0进行多序列对比分析,结果(图4)发现,克氏原螯虾crustin5氨基酸序列与斑节对虾Pm-crustin5氨基酸序列、小褐美对虾Fs-crustin氨基酸序列、圣保罗对虾Fp-crustin氨基酸序列、日本对虾Pj-crustin2氨基酸序列、日本对虾Pj-crustin4氨基酸序列和中国对虾Fc-crustin氨基酸序列的同源性分别为28.65%、27.27%、26.86%、25.71%、23.46%和21.39%,与远海梭子蟹Pp-crustin氨基酸序列、锯缘青蟹Ss-crustin氨基酸序列、紫螯青蟹St-crustin氨基酸序列和中华绒螯蟹Es-crustin1氨基酸序列的同源性分别为19.41%、18.24%、17.65%和17.34%。
2. 5 系统发育进化树分析结果
基于crustin氨基酸序列同源性构建的系统发育进化树(图5)显示,克氏原螯虾(crustin5)与小褐美对虾(Fs-crustin)、圣保罗对虾(Fp-crustin)、中华绒螯蟹(Es-crustin1)、斑节对虾(Pm-crustin5)、远海梭子蟹(Pp-crustin)、锯缘青蟹(Ss-crustin)、紫螯青蟹(St-crustin)、中国对虾(Fc-crustin)、日本对虾(Pj-crustin 2)和日本对虾(Pj-crustin4)聚类在同一个进化分支上,说明其亲缘关系较近,同源性较高。其中,克氏原螯虾crustin5与中华绒螯蟹crustin1的亲缘关系最近。
2. 6 克氏原螯虾crustin5蛋白理化性质预测结果
使用ProtParam对克氏原螯虾crustin5蛋白进行理化性质预测分析,结果显示,克氏原螯虾crustin5蛋白分子式为C705H1089N213O222S12,相对分子量为16485.42 Da,理论等电点为8.58;从主要氨基酸组成及其含量可知,以甘氨酸(Gly)含量最高,占25.1%,丝氨酸(Ser)占7.2%,丙氨酸(Ala)占6.6%,半胱氨酸(Cys)、亮氨酸(Leu)、脯氨酸(Pro)和苏氨酸(Thr)均占6.0%;克氏原螯虾crustin5蛋白不稳定指数为53.27(>40.00),属于不穩定蛋白;其脂肪系数为56.11。
2. 7 克氏原螯虾crustin5蛋白亲/疏水性预测结果
利用ExPASy中的ProtScale对克氏原螯虾crus-tin5蛋白亲/疏水性进行预测,其总平均亲水性系数为-0.074。由图6可看出,克氏原螯虾crustin5蛋白的疏水性氨基酸多于亲水性氨基酸,故属于疏水性蛋白。
2. 8 克氏原螯虾crustin5蛋白二、三级结构预测结果
利用SOPMA预测克氏原螯虾crustin5蛋白二级结构,结果(图7)显示crustin5蛋白二级结构中的α-螺旋、β-转角、无规则卷曲和延伸链分别占20.36%、7.78%、58.08%和13.77%。同时以SWISS-MODEL的自动建模功能对克氏原螯虾crustin5蛋白三级结构进行预测,发现crustin5蛋白可能存在的三级结构如图8所示,与其二级结构预测结果一致。
2. 9 crustin5基因在克氏原螯虾各组织中的分布情况
以18S rRNA为内参基因,采用实时荧光定量PCR检测crustin5基因在克氏原螯虾血细胞、肝胰腺、鳃、肠道、肌肉和淋巴器官等6种组织中的表达分布情况,结果(图9)显示克氏原螯虾crustin5基因在6种组织中均有不同程度的表达,以在血细胞中的相对表达量最高,淋巴器官次之,在肌肉组织中的相对表达量最少。
3 讨论
I型甲壳肽是信号肽序列与WAP结构域间含一个半胱氨酸富含区的抗菌肽。于爱清(2014)从红螯光壳螯虾(Cherax quadricarinatus)血细胞中成功克隆获得一个重要的抗菌肽,简称为Cq-crustin,其氨基酸序列具有I型抗菌肽结构。刘燕等(2018)从墨吉明对虾(Fenneropenaeus merguiensis)中克隆获得crustinⅡ基因,并证实其具有典型的crustins家族结构特征。王月(2018)对从拟穴青蟹(Scylla paramamosain)鉴定获得的2种抗菌肽(Sp-crus3和Sp-crus4)进行比对分析,发现二者均属于I型甲壳肽。此外,宋呈文(2013)在三疣梭子蟹(Portunus trituberculatus)中发现Pt-crustin2和Pt-crustin3氨基酸序列的N端均存在一段信号肽序列,C端则存在一个WAP结构域,且二者间存在一个半胱氨酸富集区。本研究从克氏原螯虾中成功克隆获得一条新的crustin编码基因序列,命名为crustin5。克氏原螯虾crustin5基因cDNA序列全长954 bp,共编码167个氨基酸残基,其编码蛋白相对分子量为16485.42 Da,理论等电点为8.58。克氏原螯虾crustin5蛋白结构预测结果显示,crustin5蛋白具有典型的crustins家族结构特征,包括N端的信号肽,C端的WAP结构域,以及二者间的半胱氨酸富集区。可见,克氏原螯虾crustin5与上述抗菌肽具有相似的结构。
大多数抗菌肽蛋白都能在血淋巴细胞中高表达。柳峰松(2005)研究发现,crustin基因在中国明对虾(F. chinensis)的血细胞、鳃和肠道组织中均有表达。刘燕等(2018)采用荧光定量PCR检测crustinⅡ基因在墨吉明对虾体内的表达分布情况,发现crustinⅡ基因在血细胞中高表达,而在肠道、鳃、肝胰腺、尾部肌肉、胃、眼柄和心脏组织中的表达量非常低,且存在显著差异。本研究结果表明,克氏原螯虾crustin5基因在其血细胞和淋巴器官中的相对表达量也较高,故推测克氏原螯虾抗菌肽crustin5是一种具有良好抗菌活性的抗菌肽分子,在先天免疫系统中发挥重要的抗菌作用。
4 结论
克氏原螯虾抗菌肽crustin5具有典型的crustins家族结构特征,且主要分布在血细胞和淋巴器官中,说明crustin5是在克氏原螯虾的血淋巴中参与先天免疫并发挥抗菌作用。
参考文献:
杜欣军. 2007. 中国明对虾先天免疫的模式识别与效应分子[D]. 济南:山东大学. [Du X J. 2007. Pattern recognition and effector of innate immunity in Chinese shrimp (Fenneropenaeus chinensis)[D]. Jinan:Shandong University.]
高洁,顾刚,陆林,王晓群. 2016. C1q肿瘤坏死因子相关蛋白4研究进展[J]. 国际心血管病杂志,43(2):99-101. [Gao J,Gu G,Lu L,Wang X Q. 2016. Research progress of C1q tumor necrosis factor-associated protein 4[J]. International Journal of Cardiovascular Disease,43(2):99-101.]
郭慧,冼健安,毕建柱,叶超霞,王安利. 2013. 虾类免疫因子的研究进展[J]. 饲料工业,34(22):42-46. [Guo H,Xian J A,Bi J Z,Ye C X,Wang A L. 2013. Research progress in immune factors of shrimp[J]. Feed Industry,34(22):42-46.]
韩珂珂. 2019. 克氏原螯虾三个免疫相关基因Caspase-3C、Lectin和LGBP的功能研究[D]. 南京:南京师范大学. [Han K K. 2019. Functional study of three immune-rela-ted genes,Caspase-3C,Lectin and LGBP in Procambarus clarkii[D]. Nanjing:Nanjing Normal University.]
刘燕,张展雄,李晓筠,梁华芳,陈兆明. 2018. 墨吉明对虾(Fenneropenaeus merguiensis)Crustin II型基因的克隆与原核重组表达[J]. 基因组学与应用生物学,37(1):229-237. [Liu Y,Zhang Z X,Li X Y,Liang H F,Chen Z M. 2018. Cloning and prokaryotic recombinant expression of Crustin II type gene in Fenneropenaeus merguiensis[J]. Genomics and Applied Biology,37(1):229-237.]
柳峰松. 2005. 中国明对虾(Fenneropenaeus chinensis)抗菌因子及模式识别蛋白的研究[D]. 北京:中国科学院. [Liu F S. 2005. Study on antimicrobial factor and pa-ttern recognition protein of Chinese shrimp,Fennerope-naeus chinensis[D]. Beijing:Chinese Academy of Scien-ces.]
马春霞,彭金霞,何苹萍,雷爱莹,马宁,王瑞,黎铭. 2017. 凡纳滨对虾抗菌肽crunstinA在毕赤酵母菌中的表达[J]. 南方农业学报,48(7):1310-1316. [Ma C X,Peng J X,He P P,Lei A Y,Ma N,Wang R,Li M. 2017. Expression of Litopenaeus vannamei antimicrobial peptide crunstinA in Pichia pastoris[J]. Journal of Southern Agriculture,48(7):1310-1316.]
宋呈文. 2013. 三疣梭子蟹(Portunus trituberculatus)抗菌肽crustin的基因克隆和表达分析[D]. 北京:中国科学院大学. [Song C W. 2013. Cloning and expression analysis of antimicrobial peptide crustin of swimming crab Portunus trituberculatus[D]. Beijing:University of Chinese Academy of Sciences.]
孙晨. 2011. 甲壳动物抗菌肽及信号转导和转录激活因子(STAT)的基因克隆与功能分析[D]. 济南:山东大学. [Sun C. 2011. Molecular cloning and functional analysis of crustacean antimicrobial peptides and STAT(signal transducer and activator transcription)[D]. Jinan:Shandong University.]
王显伟. 2012. 十足目甲壳动物C型凝集素功能研究[D]. 济南:山东大学. [Wang X W. 2012. Functional study of C-type lectins from decapod crustaceans[D]. Jinan:Shandong University.]
王晓飞,彭会,陈芳奕,张财亮,黄文树. 2019. 拟穴青蟹抗菌肽Crustin新变体的表达特性与抗菌功能[J]. 厦门大学学报(自然科学版),58(3):358-365. [Wang X F,Peng H,Chen F Y,Zhang C L,Huang W S. 2019. Characterization of expression and antimicrobial activity of a novel crustin isoform from Scylla paramamosain[J]. Journal of Xiamen University(Natural Science),58(3):358-365.]
王月. 2018. 擬穴青蟹甲壳肽(Crustin)的免疫功能研究[D]. 新乡:河南师范大学. [Wang Y. 2018. Functional analyses of crustins in the innate immune system of Mud Crab,Scylla paramamosain[D]. Xinxiang:Henan Normal University.]
吴希. 2006. 重组家蚕抗菌肽CM4抗真菌作用机理的研究[D]. 南京:南京师范大学. [Wu X. 2006. Antifungal mechanism of recombinant Bombyx mori antimicrobial peptide CM4[D]. Nanjing:Nanjing Normal University.]
徐鑫,刘忠渊. 2014. 先天免疫系统中肽聚糖蛋白识别研究进展[J]. 动物医学进展,35(10):94-98. [Xu X, Liu Z Y. 2014. Progress on peptidoglycan recognition protein in innate immune system[J]. Progress in Veterinary Medicine,35(10):94-98.]
于爱清. 2014. 虾蟹类免疫相关基因的研究[D]. 上海:华东师范大学. [Yu A Q. 2014. Studies on immune-related genes of shrimp and crabs[D]. Shanghai:East China Normal University.]
Acosta J,Carpio Y,Valdés I,Velázquez J,Zamora Y,Morales R,Morales A,Rodríguez E,Estrada M P. 2014. Co-administration of tilapia alpha-helical antimicrobial peptides with subunit antigens boost immunogenicity in mice and tilapia(Oreochromis niloticus)[J]. Vaccine,32(2):223-229.
Boman H G,Steiner H. 1981. Humoral immunity in Cecropia pupae[J]. Current Topics in Microbiology and Immuno-logy,95(4):75-91.
Boulanger N,Bulet P,Lowenberger C. 2006. Antimicrobial peptides in the interactions between insects and flagellate parasites[J]. Trends in Parasitology,22(6):262-268.
Doiron K,Beaulieu L,St-Louis R,Lemarchand K. 2018. Reduction of bacterial biofilm formation using marine natural antimicrobial peptides[J]. Colloids and Surfaces B:Biointerfaces,167:524-530.
Ferrer M,kapoor T M,Strassmaier T,Weissenhom W,Skehel J J,Oprian D,Schreiber S L,Wiley D C,Harrison S C.1996. Selection of gp41-mediated HIV-1 cell entry inhibitors from biased combinatorial libraries of non-natural binding elements[J]. Nature Structural Biology,6(10):953-960.
Liao Z,Wang X C,Liu H H,Fan M H,Sun J J,Shen W. 2013. Molecular characterization of a novel antimicrobial peptide from Mytilus coruscus[J]. Fish & Shellfish Immu-nology,34(2):610-616.
Park K E,Jang S H,Lee J,Lee S A,Kikuchi Y,Seo Y S,Lee B L. 2018. The roles of antimicrobial peptide,rip-thanatin,in the midgut of Riptortus pedestris[J]. Developmental & Comparative Immunology,78:83-90.
Qu H,Chen B,Peng H,Wang K J. 2013. Molecular cloning,recombinant expression,and antimicrobial activity of EC-hepcidin3,a new four-cysteine hepcidin isoform from Epinephelus coioides[J]. Bioscience,Biotechnology,and Biochemistry,77(1):103-110.
Salger S A,Cassady K R,Reading B J,Noga E J. 2016. A diverse family of host-defense peptides(piscidins) exhibit specialized anti-bacterial and anti-protozoal activities in fishes[J]. PLoS One,11(8):e0159423.
Shenkarev Z O,Panteleev P V,Balandin S V,Gizatullina A K,Altukhov D A,Finkina E I,Kokryakov V N,Arseniev A S,Ovchinnikova T V. 2012. Recombinant expression and solution structure of antimicrobial peptide aurelin from jellyfish Aurelia aurita[J]. Biochemical and Biophysical Research Communications,429(1-2):63-69.
Wei L,Gao J,Zhang S,Wu S,Xie Z,Ling G,Kuang Y Q,Yang Y,Yu H,Wang Y. 2015. Identification and characterization of the first Cathelicidin from sea snakes with potent antimicrobial and anti-inflammatory activity and special mechanism[J]. The Journal of Biological Chemistry,290(27):16633-16652.
Zhang L,Yang D,Wang Q,Yuan Z,Wu H,Pei D,Cong M,Li F,Ji C,Zhao J. 2015. A defensin from clam Venerupis philippinarum:Molecular characterization,localization,antibacterial activity,and mechanism of action[J]. Develop-mental & Comparative Immunology,51(1):29-38.
Zhong J,Wang W,Yang X,Yan X,Liu R. 2013. A novel cysteine-rich antimicrobial peptide from the mucus of the snail of Achatina fulica[J]. Peptides,39:1-5.
Zhuang Z R,Yang X D,Huang X Z,Gu H X,Wei H Y,He Y J,Deng L. 2017. Three new piscidins from orange-spotted grouper(Epinephelus coioides):Phylogeny,expression and functional characterization[J]. Fish & Shellfish Immunology,66:240-253.
(責任编辑 兰宗宝)
