芒果清除自由基活性成分及抗氧化作用研究
2020-06-04韦会平郑毅韩洪波
韦会平 郑毅 韩洪波


摘要:【目的】明确不同部位、不同成熟度芒果中清除自由基的活性成分含量及其对不同自由基的清除能力、对脂质过氧化(LPO)的抑制能力,为芒果的深度开发及新产品研制提供基础数据。【方法】以凯特芒果为研究对象,采用高效液相色谱法(HPLC)测定不同成熟度(嫩、绿熟和后熟)芒果不同部位(叶片、果皮、果肉和果仁)中的β-胡萝卜素和芒果苷含量,2,6-二氯靛酚滴定法测定维生素C含量,紫外分光光度法测定总酚含量,Fenton反应法检测对羟基自由基(·OH)的清除作用,邻苯三酚自氧化法检测对超氧阴离子自由基(O[2])的清除作用,卵磷脂过氧化法测定抗LPO活性。【结果】绿熟期果肉和果皮中的β-胡萝卜素和维生素C含量均最高,分别超过2.10和120.00 mg/100 g,显著高于其他样品(P<0.05,下同),但果肉与果皮间无显著差异(P>0.05);嫩叶中的芒果苷和总酚含量最高,分别为3.45和6.92 g/100 g,显著高于其他样品。浓度为30 g/L的嫩叶提取物对·OH的清除率达96.71%,对LPO的抑制率达95.83%,芒果嫩叶对 ·OH和LPO的半数清除率或半抑制浓度(IC50)分别为8.89和8.01 g/L。果仁的总酚含量高于4.20 g/100 g,浓度为40 g/L的绿熟果仁提取物对O[2]的清除率达94.61%,IC50为10.76 g/L。【结论】不同成熟度芒果不同部位中,清除自由基的活性成分含量及其对不同自由基的清除率和对LPO的抑制率均存在显著差异。因此,在芒果深加工及开发利用过程中,除了要充分重视叶片、果仁和果皮的重要价值外,还应重视成熟度对果实和叶片成分和品质的影响。
关键词: 芒果;清除自由基;抗脂质过氧化;活性成分;药理作用
0 引言
【研究意义】芒果是我国南方及世界热带地区最主要的特色水果之一。芒果苷、多酚、β-胡萝卜素和维生素C是芒果中具有清除自由基和抗氧化药理作用最主要的4种活性成分(Kabukia et al.,2000;周新远和刘帅,2010;Jahurul et al.,2015;郭新颖等,2019),明确这些成分在芒果各部位的含量及清除自由基、抗氧化作用变化规律,对芒果的深层次开发利用具有十分重要的意义。【前人研究进展】近30年来,国内外对芒果清除自由基、抗氧化活性成分及抗氧化药理作用等已有较多研究报道。在抗氧化活性成分含量方面,周玉蝉等(1994)的研究结果表明,芒果采收时,果肉的β-胡萝卜素含量很低,随后熟期延长,含量逐渐增加;赵家桔等(2014)研究表明,芒果肉中的胡萝卜素类成分在果实发育初期已合成,之后随着果实长大含量逐渐增加,但果肉中β-类胡萝卜素含量在果实成熟前后的变化因品种而异,金煌在采收前后10 d内含量最高且无明显变化,而红玉和贵妃在采收前10 d左右的含量最高,之后随着成熟度增加含量逐渐降低;韦会平等(2016,2018)研究发现,芒果叶中含有丰富的芒果苷,并因品种和季节不同而产生规律性变化。在清除自由基和抗氧化药理作用方面,Kabukia等(2000)、高云涛等(2009)、张丽婧等(2015)、刘焕云等(2019)研究发现,芒果仁和芒果皮中含有多酚类物质,并对脂质过氧化(Lipid peroxidation,LPO)具有一定抑制作用;Kanwal等(2010)研究发现,芒果叶中含有丰富的黄酮类物质;Singh等(2014)在芒果树皮中发现多种三萜类成分,且具有一定抗菌活性;李晓博等(2016)研究表明,芒果肉中含有较高含量的β-胡萝卜素和维生素C等抗氧化物质,并对羟基自由基(·OH)和超氧阴离子自由基(O[2])具有一定清除作用。【本研究切入点】目前有关芒果清除自由基、抗氧化活性成分及抗氧化药理作用的研究资料过于零星和片段,尚无全面而系统分析的研究报道,而无法揭示这些成分含量及药理作用在芒果中的变化规律。【拟解决的关键问题】在前人已有研究基础上,对芒果各主要部位清除自由基的活性成分及抗氧化药理作用进行系统分析,揭示其变化规律,为芒果精深加工和药用开发提供基础数据和科学依据。
1 材料与方法
1. 1 试验材料
所有芒果样品均来自四川省攀枝花市大面积种植的凯特品种,由攀枝花三博士科技有限公司提供。芒果嫩葉为枝条顶端嫩绿色叶片,成熟叶为枝条中部深绿色叶片,老叶为枝条下部老黄叶片;所有叶片均60 ℃烘干,粉碎过40目筛。嫩果为成熟采收前1个月左右的果实,绿熟果为刚达成熟采收标准的果实,后熟果为采摘后经5~10 d后熟达到食用标准的果实;将果实的果皮、果肉和果仁分别取出,打浆机打碎,匀浆机磨成匀浆备用。共有嫩叶、成熟叶、老叶、嫩果皮、绿熟果皮、后熟果皮、嫩果肉、绿熟果肉、后熟果肉、嫩果仁、绿熟果仁和后熟果仁12个样品。试验称取的样品量均为干品量(果皮、果肉及果仁根据其干燥率折算成鲜品量)。
β-胡萝卜素、L-抗坏血酸、芒果苷标准品和没食子酸标准品均购自中国药品生物制品检定所,高效液相色谱(HPLC)流动相用甲醇为色谱纯,水为重蒸水,其余试剂均为分析纯。主要仪器设备:Agilent 1200高效液相色谱仪及化学工作站(Agilent公司)、Evolution300紫外可见分光光度计(上海泽权仪器设备有限公司)、XS205DU电子天平(梅特勒—托利多公司)、电热恒温鼓风干燥箱(上海琅玕实验设备有限公司)、FS-6D流水式粉碎机(广州雷迈机械设备有限公司)、SYU-3-100D超声波提取器(郑州生元仪器有限公司)和T-25型匀浆机(德国IKA公司)。
1. 2 β-胡萝卜素含量测定
参照GB 5009.83—2016及李胤均和谢德芳(2015)的HPLC法稍作修改。称取1.0 g各样品分别置于塑料烧杯中,分别加入15.0 mL 500 g/L氢氧化钾溶液和40.0 mL脱醛无水乙醇,用玻璃棒搅拌均匀后移至250 mL圆底烧瓶内,在60 ℃水浴锅中皂化30 min,用乙醚提取至无色,氮气蒸汽吹干,再用甲醇定容于5 mL容量瓶内,过膜后进行HPLC测定。色谱条件:Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm);流动相:A(水)∶B(甲醇)=2∶8;流速1 mL/min。用β-胡萝卜素标准品溶液测定绘制标准曲线,得到y=18291x+124.81(R2=0.9981),并用标准曲线法测定计算样品中β-胡萝卜素含量。
1. 3 维生素C含量测定
参照GB/T 6195—1986中的2,6-二氯靛酚滴定法稍作修改。称取2.0 g各样品,加入少量20 g/L草酸溶液,冰浴条件研磨成浆,再用20 g/L草酸溶液清洗定容至1000 mL,静置10 min,收集滤液。准确吸取10.0 mL滤液,用2,6-二氯靛酚溶液(已用抗坏血酸标准品标定)滴至微红色、静置15 s不褪色后即为滴定终点,以10.0 mL 20 g/L草酸溶液作空白。每100 g样品中维生素C(Vc)含量计算公式如下:
1. 4 芒果苷含量测定
参照韦会平等(2016,2018)的HPLC法进行测定。取芒果叶样品0.1 g或其他样品1.0 g分别置于具塞锥形瓶中,精密加入30%乙醇25.0 mL,超声处理(400 W,40 kHz)30 min,放冷,取续滤液用HPLC进行测定。色谱条件:Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm),流动相为乙腈-0.2%冰醋酸水溶液(15∶85,v/v),检测波长258 nm,柱温为室温,进样量20 μL。用芒果苷标准品配制标准溶液,测定得到标准曲线方程为y=28203x+277.07(R2=0.9991)。用标准曲线法测定计算各样品中芒果苷含量。
1. 5 总酚含量测定
参照李晓博等(2016)采用紫外分光光度法进行测定。用1%盐酸—甲醇溶液作溶剂,配制浓度为0.2、0.4、0.6、0.8和1.0 mmol/L的没食子酸标准溶液,于280 nm处测其吸光值,测定绘制标准曲线,得到y=8.51x+0.039(R2=0.9972)。称取0.4 g各样品,加入少许经预冷的1%盐酸—甲醇溶液,冰浴条件研磨匀浆后,转入20 mL刻度试管中,研钵经1%盐酸—甲醇溶液冲洗后一并转至试管中,定容至刻度,混匀,于4 ℃避光振荡提取20 min,过滤,收集滤液,在280 nm处测其吸光值,并根据标准曲线计算样品中总酚含量。
1. 6 ·OH清除率测定
1. 6. 1 不同样品·OH清除率比较 参照张建胜等(2008)的方法稍作修改,利用Fenton反应检测抗氧化物对·OH的清除作用。称取各样品1.0 g,用含1%盐酸和50%甲醇(v/v)的盐酸—甲醇溶液匀浆,定容至40.0 mL,避光放置2 h后离心,期间晃动数次,上清液用甲醇稀释定容至50.0 mL作样品溶液备用。同时配制浓度为20 g/L的甘露醇作阳性参照品溶液备用。按顺序分别取1.5 mL 0.15 mol/L PBS缓冲液(pH 7.4)、0.2 mL 260 μg/mL番红溶液、0.7 mL 2 mmol/L EDTANa2-Fe2+、1.0 mL上述样品溶液和0.8 mL H2O2混匀后,于37 ℃水浴保温30 min,在510 nm处测其吸光值。空白组以等体积的蒸馏水代替样品溶液,对照组以等体积的蒸馏水代替样品溶液和EDTANa2-Fe2+溶液,每组3个平行,根据下式计算清除率:
1. 6. 2 清除·OH量效曲线分析 分别取0.25、0.5、1.0、1.5和2.0 g芒果嫩叶样品,按1.6.1方法进行样品处理,并测定·OH清除率。处理得到的芒果叶提取物浓度分别为5、10、20、30和40 g/L。
1. 7 O[2]清除率测定
1. 7. 1 不同样品O[2]清除率比较 参照李晓博等(2016)的方法稍作修改,利用邻苯三酚自氧化体系测定总抗氧化物对O[2]的清除作用。样品溶液配制方法同1.6.1,同时配制浓度为20 g/L的维生素C作阳性参照品溶液备用。取4.5 mL 0.05 mol/L Tris-HCl缓冲液(pH 8.25),加入1.0 mL样品溶液,25 ℃保温25 min,再加入0.4 mL 25 ℃预温的3 mmol/L邻苯三酚;混匀反应4 min后,加入0.5 mL浓盐酸,迅速测定325 nm处吸光值。空白组以等量Tris-HCl代替样品液。每组3个平行。根据下式计算清除率:
1. 7. 2 清除O[2]量效曲线分析 分别取0.5、1.0、1.5、2.0和2.5 g绿熟芒果仁样品,按1.7.1方法进行样品处理,并测定O[2]清除率。处理得到的芒果仁提取物浓度分别为10、20、30、40和50 g/L。
1. 8 LPO抑制率测定
1. 8. 1 不同样品抗LPO作用比较 参照张建胜等(2008)的方法稍作修改,用卵磷脂过氧化法测定各样品的抗LPO作用。样品溶液和维生素C阳性参照品溶液配制方法同1.6.1。取0.5 mL卵磷脂溶液[用200 mg卵磷脂溶解于30.0 mL 10 mmol/L PBS(pH 7.4),冰浴振荡],加入1.0 mL PBS缓冲液(pH 7.4)、0.5 mL样品溶液和1.0 mL 2.5 mmol/L EDTANa2-Fe2+,混勻后于37 ℃水浴中反应45 min,再加入28%(w/v)的三氯乙酸2.0 mL和1%(w/v)的2-硫代巴比妥1.0 mL,混匀后置于100 ℃沸水浴中加热10 min,冷却后在532 nm处测其吸光值A样,用PBS缓冲液调零,空白管用PBS缓冲液代替样品测吸光值A0。根据下式计算LPO抑制率:
1. 8. 2 抗LPO量效曲线分析 分别取0.25、0.5、1.0、1.5和2.0 g芒果嫩叶样品,按1.8.1方法进行样品处理,并测定LPO抑制率。处理得到的芒果叶提取物浓度分别为5、10、20、30和40 g/L。
1. 9 统计分析
各处理每个样品3次重复,取其平均数作测定值,用SPSS 19.0(LSD法)对试验数据进行差异显著性分析。用Excel 2017绘制药物量效曲线,进行曲线拟合得到曲线方程,并计算半数清除率或半抑制浓度(IC50)。
2 结果与分析
2. 1 β-胡萝卜素含量及变化规律
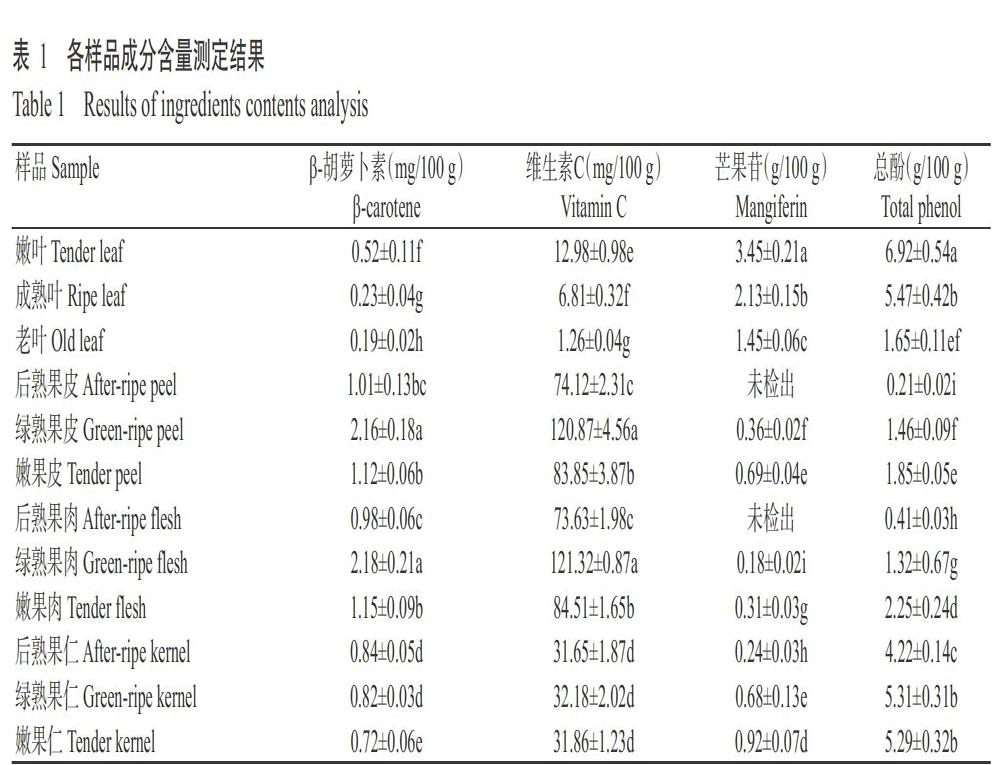
各样品β-胡萝卜素含量测定结果见表1。芒果果肉、果皮、果仁和叶片中均含有β-胡萝卜素,以果肉中含量最高,果皮次之,叶片含量最低;无论嫩果、绿熟果和后熟果,其果皮与果肉中的β-胡萝卜素含量均无显著差异(P>0.05,下同);果实成熟程度对果肉和果皮中的β-胡萝卜素含量有显著影响(P<0.05,下同),绿熟期果肉和果皮中的含量在2.15 mg/100 g以上,分别是嫩果和后熟果的1.90和2.10倍以上。叶片老嫩程度对其β-胡萝卜素含量也有显著影响,叶片越嫩,含量越高,嫩叶中的β-胡萝卜素含量为0.52 mg/100 g,分别是成熟叶和老叶的2.26和2.74倍。
2. 2 维生素C含量及变化规律
各样品维生素C含量测定结果见表1。芒果果肉、果皮、果仁和叶片中均含有维生素C,以果肉中含量最高,果皮次之,叶片的含量最低;无论嫩果、绿熟果和后熟果,其果皮与果肉中的维生素C含量均无显著差异;果实成熟程度对果肉和果皮中的维生素C含量有显著影响,绿熟期果肉和果皮中的维生素C含量在120.50 mg/100 g以上,分别是嫩果和后熟果的1.40和1.60倍以上;叶片老嫩程度对其维生素C含量也有显著影响,叶片越嫩,含量越高,嫩叶中的维生素C含量为12.98 mg/100 g,分别是成熟叶和老叶的1.91和10.30倍。
2. 3 芒果苷含量及变化规律
各样品芒果苷含量测定结果见表1。以叶片中的芒果苷含量最高,果仁次之,而果皮和果肉中含量极少;叶片老嫩程度对其芒果苷含量影响显著,嫩叶的含量为3.45 g/100 g, 分别是成熟叶和老叶的1.62和2.38倍;嫩果仁的芒果苷含量为0.92 g/100 g,分别是绿熟果仁和后熟果仁的1.35和3.83倍。
2. 4 总酚含量及变化规律
各样品总酚含量测定结果见表1。以嫩叶含量最高,果仁含量次之,果皮和果肉中含量相对较少。总体来看,叶片或果实的老嫩程度对叶片或果实中总酚含量有显著影响,果实成熟度越高,总酚含量越低,尤其是已完成后熟的果皮或果肉中含量极低。嫩叶中的总酚含量高达6.92 g/100 g,分别是成熟叶和老叶的1.26和4.19倍。嫩果仁和绿熟果仁中的含量无显著差异,均在5.25 g/100 g以上,显著高于后熟果仁(4.22 g/100 g)。
2. 5 ·OH清除率及变化规律
各样品对·OH清除率的测定结果见表2。嫩叶、成熟叶、嫩果皮和绿熟果皮对·OH的清除率显著高于同浓度的对照甘露醇,排序为嫩叶>成熟叶>绿熟果皮>嫩果皮>甘露醇;老叶、嫩果肉和绿熟果肉对·OH的清除率与同浓度的甘露醇相当,彼此间无显著差异;果仁也具有一定的清除·OH作用,但弱于同浓度的甘露醇。叶片老嫩程度对·OH清除率有显著影响,叶片越嫩,清除率越高,嫩叶的清除率达93.86%,分别是成熟叶和老叶的1.10和1.29倍。后熟过程显著降低果肉和果皮对·OH的清除率。
从上述结果可知,所有样品中以嫩叶对·OH的清除率最高,故选用嫩叶进行量效曲线分析,结果见图1。随着嫩叶提取物浓度增加,其对·OH的清除率逐渐升高;提取物浓度为30和40 g/L时,·OH清除率分别为96.71%和97.12%,二者间差异不显著。说明当提取物浓度达30 g/L后,·OH清除率不再随着浓度的增加而显著升高。通过Excel曲线拟合得到的量效曲线方程为y=-0.1109x2+6.8444x-2.0796(R2=0.9719),由此推算得到芒果嫩叶对·OH清除率的IC50为8.89 g/L。
2. 6 O[2]清除率及变化规律
由表2可知,果仁、嫩叶和成熟叶对O[2]的清除率显著高于同浓度的对照维生素C;果肉和果皮也有一定的清除O[2]作用,但均非常弱;叶片老嫩程度对O[2]清除率有显著影响,叶片越嫩,清除率越高;后熟过程显著降低果肉和果皮对O[2]的清除率,但果仁成熟程度对O[2]的清除率无显著影响。
从上述测定结果可知,果仁对O[2]的清除效果最佳,且成熟度对果仁清除O[2]的效果无显著影响,故选用绿熟果仁作试验材料进行量效曲线分析,结果见图2。随着绿熟果仁提取物浓度的增加,其对O[2]的清除率也不断提高;提取物浓度为40和50 g/L时,清除率分别为94.61%和94.92%,二者间无显著差异,说明当提取物浓度达40 g/L后,O[2]清除率不再随着浓度增加而显著升高。通过Excel曲线拟合得到的量效曲线方程为y=-0.0488x2+4.0741x+11.8380(R2=0.9815),由此推算得到芒果绿熟果仁对O[2]清除率的IC50为10.76 g/L。
2. 7 抗LPO活性及变化规律
由表2可知,各樣品对LPO均有一定的抑制作用,抑制率由高到低依次为叶>果仁>果皮>果肉;芒果叶(老叶除外)和果仁对LPO的抑制率均显著高于同浓度的对照维生素C,而果肉和果皮对LPO的抑制率均显著低于同浓度的维生素C;老嫩程度对芒果叶的LPO抑制率影响极大,叶片越嫩,抑制率越高;成熟度对果仁的LPO抑制率无显著影响,但对果皮和果肉的LPO抑制率有显著影响,成熟度越高,抑制率越低。
从上述结果可知,所有样品中以嫩叶对LPO的抑制率最高,故选用嫩叶进行量效曲线分析,结果见图3。随着嫩叶提取物浓度增加,LPO抑制率不断提高;提取物浓度为30和40 g/L的抑制率分别为95.83%和96.31%,二者间无显著差异,说明当提取物浓度达30 g/L后,抑制率不再随浓度的增加而显著升高。通过Excel曲线拟合得到的量效曲线方程为y=-0.0775x2+5.1357x+13.8530(R2=0.9916),由此推算得到芒果嫩叶抗LPO的IC50为8.01 g/L。
3 讨论
在所有水果中,芒果中的维生素A含量最高,故芒果有“热带水果之王”的称号。β-胡萝卜素作为维生素A原,在抗癌、预防心血管疾病、防止老化和衰老引起的多种退化性疾病方面具有重要作用;维生素C则在人体抗体及胶原形成、组织修补、氨基酸和叶酸代谢、铁和碳水化合物利用、脂肪和蛋白质合成,以及维持免疫功能、保持血管完整、促进非血红素铁吸收、抑制酪氨酸酶形成等方面发挥重要作用;芒果苷作为一种强氧化剂,具有抗炎、修复细胞、护肝利胆及降尿酸等重要药理作用;酚类化合物常作为还原剂、单线态氧猝灭剂、超氧自由基清除剂、金属螯合剂和氧化酶抑制剂,具有很强的抗氧化作用(Kanwal et al.,2010;李燕,2017;郭新颖等,2019)。这4类物质是目前研究较多的芒果生物活性成分,且均具有较强的清除自由基和抗氧化作用。近年来大量的研究证明,氧自由基(特别是·OH和O[2])及其诱导的LPO反应与许多疾病的发生有密切联系,如老年性白内障、动脉粥样硬化、脑动脉痉挛、老年性痴呆、癌症和衰老等(郭新颖等,2019)。因此,国内外学者正积极地筛选具有清除氧自由基和抗LPO功能的有效药物(周新远和刘帅,2010;Jahurul et al.,2015;郭新颖等,2019)。与前人的相关研究相比,本研究对芒果清除自由基的活性成分含量、抗氧化药理作用及其变化规律进行了更全面细致地分析。研究结果表明,不同成熟度芒果不同部位中,4种清除自由基活性成分含量的差异显著,且对不同自由基的清除率及对LPO的抑制率存在明显差异。了解这些变化规律,对芒果的精深加工和药用开发具有重要意义。
从成分分析结果来看,果肉和果皮中的β-胡萝卜素和维生素C含量最高,果仁次之,叶片中含量最低。果实成熟度越高,果肉和果皮中的β-胡萝卜素和维生素C含量越低,而果仁的含量无显著差异。对β-胡萝卜素的测定结果与周玉婵等(1994)的研究结果相反,而与赵家桔等(2014)对金煌芒果的研究结果基本一致,可能与研究材料的品种、产地、采收时期等不同有关。
本研究结果表明,芒果嫩叶的芒果苷和总酚含量均最高,果仁中的总酚含量也较高,而果肉和果皮中的芒果苷和总酚含量均非常低,与Kabukia等(2000)、张丽婧等(2015)、韦会平等(2016)、刘焕云等(2019)的研究结果基本一致。但本研究进一步发现,老嫩程度或成熟程度对叶和果仁中芒果苷和总酚含量均有显著影响,且呈一定的规律性变化。
芒果叶片、果仁、果皮和果肉对·OH和O[2]均有清除作用,对LPO也有抑制作用,与Kabukia等(2000)、李晓博等(2016)、刘焕云等(2019)的研究结果基本一致。本研究还发现,不同成熟度芒果的不同部位对不同自由基的清除能力及对LPO的抑制能力存在显著差异,且呈一定的规律性变化。此外,本研究首次测定了芒果对不同自由基進行清除及对LPO进行抑制的量效曲线,求出各自的IC50,可为今后芒果新产品的研发提供基础数据。
4 结论
不同成熟度芒果不同部位中,β-胡萝卜素、维生素C、芒果苷和总酚等活性成分含量及对不同自由基的清除率、对LPO的抑制率均存在显著差异,且呈一定的规律性变化。总体而言,以嫩叶中芒果苷和总酚含量最高、清除·OH和抑制LPO的能力最强;绿熟期果肉和果皮中β-胡萝卜素和维生素C含量最高;果仁对O[2]的清除能力最强。在芒果深加工及开发利用过程中,除了要充分重视芒果叶、果仁和果皮独特的价值外,还应重视成熟度对果实和叶片成分及品质的影响。
参考文献:
高云涛,付艳丽,李正全,蒋进超. 2009. 超声与双水相体系耦合提取芒果核多酚及活性研究[J]. 食品与发酵工业,35(9):167-172. [Gao Y T,Fu Y L,Li Z Q,Jiang J C. 2009. Study on the ultrasound extraction coupling with two-phase aqueous system in the extraction of polyphenols from mango nuclear and its antioxidantion activity[J]. Food and Fermentation Industries,35(9):167-172.]
郭新颖,史玉坤,陈峰,陆娟. 2019. 5种中药提取物清除自由基的体外抗氧化活性研究[J]. 化学工程师,33(9):74-78. [Guo X Y,Shi Y K,Chen F,Lu J. 2019. Study on scavenging free radicals and antioxidant activity in vitro for 5 kinds of traditional Chinese medicine extracts[J]. Chemical Engineer,33(9):74-78.]
李晓博,胡文忠,姜爱丽,刘程惠. 2016. 芒果果肉抗氧化成分测定及其对自由基清除能力的研究[J]. 食品工业科技,37(10):161-164. [Li X B,Hu W Z,Jiang A L,Liu C H. 2016. Study on the antioxidant components and antioxidant capacity of the Mangifera indica Linn pulp[J]. Scien-ce and Technology of Food Industry,37(10):161-164.]
李燕. 2017. 芒果核多酚分离、纯化及其抗氧化活性研宄[D]. 大连:大连工业大学. [Li Y. 2017. Study on separation,purification and antioxidant activity of polyphenol from mango kernel seeds[D]. Dalian:Dalian Polytechnic University.]
李胤均,谢德芳. 2015. 套袋对芒果营养品质的影响研究[J]. 热带农业科学, 35(4):11-15. [Li Y J,Xie D F. 2015. Effects of bagging on the nutritional quality of mango[J]. Chinese Journal of Tropical Agriculture,35(4):11-15.]
刘焕云,王艳哲,李敬,李飞. 2019. 芒果皮多酚的微波辅助提取及体外抗氧化活性研究[J]. 中国调味品, 44(3):1-4. [Liu H Y,Wang Y Z,Li J,Li F. 2019. Study on microwave-assisted extraction of polyphenols from mango peel and their antioxidant activities in vitro[J]. China Condiment,44(3):1-4.]
韦会平,赵牧,田金凤,李勇,刘文权,王丹,何妍羲. 2016. 四川攀西干热河谷区芒果叶中芒果苷含量变化规律研究[J]. 南方农业学报,47(12):2134-2138. [Wei H P,Zhao M,Tian J F,Li Y,Liu W Q,Wang D,He Y X. 2016. Mangizferin content variation of mango leaves in dry-hot valley area of Panxi region,Sichuan[J]. Journal of Sou-thern Agriculture,47(12):2134-2138.]
韦会平,郑毅,韩洪波,尚远宏. 2018. 酯提除杂法高效提取分离芒果叶芒果苷[J]. 南方农业学报,49(1):130-135. [Wei H P,Zheng Y,Han H B,Shang Y H. 2018. Extraction and isolation of mangiferin from mango leaves by ethylacetate impurity-removing[J]. Journal of Southern Agriculture,49(1):130-135.]
张建胜,王雪梅,高云涛,董学畅,李吉昌,李干鹏. 2008. 伸筋草提取物体外清除活性氧自由基及抗氧化作用研究[J]. 云南中医中药杂志,29(3):38-39. [Zhang J S,Wang X M,Gao Y T,Dong X C, Li J C,Li G P. 2008. Study on scavenging free radicals of reactive oxygen and antioxidant activity of extracts of Euphorbiae in vitro[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Me-dica,29(3):38-39.]
张丽婧,张岭,李林子,胡文敏,陈建国,梅松,刘冬英,刘臻,王茵. 2015. 芒果皮提取物对高脂血症大鼠血脂、肝功能及脂质过氧化的影响[J]. 毒理学杂志,29(4):294-298. [Zhang L J,Zhang L,Li L Z,Hu W M,Chen J G,Mei S,Liu D Y,Liu Z,Wang Y. 2015. Effects of mango peel extract on blood lipid,liver function and lipid peroxidation in rats with hyperlipidemia[J]. Journal of Toxicology,29(4):294-298.]
趙家桔,周兆禧,朱敏,赵丽,高爱平,陈业渊,王家保. 2014. 3个品种芒果发育及后熟过程中类胡萝卜素含量的变化研究[J]. 西南农业学报,27(5):2124-2130. [Zhao J J,Zhou Z X,Zhu M,Zhao L, Gao A P,Chen Y Y,Wang J B. 2014. Changes of carotenoids during dynamic deve-lopment and ripening of mango fruits[J]. Southwest China Journal of Agricultural Sciences,27(5):2124-2130.]
周新远,刘帅. 2010. “希望之果”——芒果[J]. 中老年保健,(2):36-37. [Zhou X Y,Liu S. 2010. Fruit of hope-mango[J]. Elderly Health Care,(2):36-37.]
周玉蝉,唐友林,谭兴杰. 1994. 紫花芒果后熟过程中主要类胡萝卜素含量的变化[J]. 热带亚热带植物学报,2(2):77-79. [Zhou Y C,Tang Y L,Tan X J. 1994. Changes of major carogenoid contents during ripening of mango fruit(Mangifera indica L. cv. Zihua)[J]. Journal of Tropical and Subtropical Botany,2(2):77-79.]
Jahurul M H A,Zaidul I S M,Ghafoor K,Al-Juhaimi F Y,Nyam K L,Norulaini N A N,Sahena F,Omar A K M. 2015. Mango(Mangifera indica L.) by-products and their valuable components:A review[J]. Food Chemistry,183:173-180.
Kabukia T,Nakajimaa H,Araia M,Arai M,Ueda S,Kuwabara Y,Dosako S. 2000. Characterization of novel antimicrobial compounds from mango(Mangifera indica L.) kernel seeds[J]. Food Chemistry,71(1):61-66.
Kanwal Q,Hussain I,Latif Siddiqui H. 2010. Antifungal activity of flavonoids isolated from mango(Mangifera indica L.) leaves[J]. Natural Product Research,24(20):1907-1914.
Singh R,Singh S K,Maharia R S,Garg A N. 2014. Identification of new phytoconstituents and antimicrobial activity in stem bark of Mangifera indica(L.)[J].Journal of Pharmaceutical and Biomedical Analysis,105:150-155.
(责任编辑 罗 丽)
