再生稻根际促生菌的分离、筛选与鉴定
2020-06-04许丽宁徐敬棋邵彩虹吴文革陈鸿飞林文雄
许丽宁 徐敬棋 邵彩虹 吴文革 陈鸿飞 林文雄


摘要:【目的】對再生稻根际土壤开展根际促生菌的分离、筛选与鉴定,为开发和生产促进再生稻腋芽萌发的微生物肥料提供资源和技术支持。【方法】采用稀释分离法从再生稻根际土壤中分离根际促生菌,以无菌培养基处理为对照,通过盆栽试验筛选具有促进再生稻腋芽萌发生长作用的根际促生菌,并进行促生菌株的16S rDNA鉴定和促生活性测定。【结果】从再生稻根际土壤中分离获得4株菌株(ZSD1、ZSD2、ZSD3和ZSD4),革兰氏染色结果表明,ZSD1菌株为革兰氏阴性菌,ZSD2、ZSD3和ZSD4菌株为革兰氏阳性菌。再生稻促生盆栽试验结果显示,ZSD1、ZSD2和ZSD3菌株具有促生能力,与对照相比,ZSD1、ZSD2和ZSD3菌株处理的再生稻分蘖数分别多61.76%、45.59%和102.94%,单株产量分别为13.17、11.68和16.83 g,分别比对照提高66.08%、47.29%和112.23%,差异达显著水平(P<0.05),ZSD3菌株的促生效果最佳,其次为ZSD1菌株。促生活性测定结果显示,ZSD1、ZSD2和ZSD3菌株均具有解磷、解钾、固氮和产生长素(IAA)的能力,其中解磷和产IAA能力排序为ZSD1菌株>ZSD2菌株>ZSD3菌株,固氮和解钾能力排序为ZSD3菌株>ZSD1菌株>ZSD2菌株。16S rDNA序列比对结合形态生物学分析结果表明,ZSD1菌株为沙雷氏菌(Serratia),ZSD2菌株为纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis),ZSD3菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。【结论】分离筛选出的ZSD1、ZSD2和ZSD3菌株具有较强的促进再生稻腋芽生长效应,以ZSD3菌株的促生能力最强,可为今后开发再生稻生物菌肥提供菌种资源。
关键词: 再生稻;根际促生菌;分离筛选;菌株鉴定;促生活性
Abstract:【Objective】In this study,isolation,screening and identification of plant growth-promoting rhizobacteria fromratooning rice were determined,in order to provide resources and technical supports for the development and production of microbial fertilizer to promote the axillary buds germination of ratooning rice. 【Method】The plant growth-promo-ting rhizobacteria were isolated from the rhizosphere soil fromratooning rice by diluting and separating method. With the aseptic culture medium treatment as control,the plant growth-promoting rhizobacteria which could promote the axillary buds germination fromratooning rice were screened by pot experiment and were identified by 16S rDNA. Additionally,the growth promoting characteristics of plant growth-promoting rhizobacteria of ratooning rice were determined. 【Result】Four strains(ZSD1, ZSD2, ZSD3 and ZSD4) were isolated from the rhizosphere soil of ratooning rice. Gram staining found that ZSD1 strain was gram-negative,ZSD2,ZSD3 and ZSD4 strain were gram-positive bacteria.The results of pot experiment showed that the strains ZSD1,ZSD2 and ZSD3 had the ability of promoting the axillary bud germination of ratooning rice.Compared with the control,the tiller numbers of ratooning rice were 61.76%,45.59%,102.94% higher and the single plant yield were 66.08%,47.29%,112.23% higher in the treatment of ZSD1(13.17 g),ZSD2(11.68 g) and ZSD3(16.83 g) stain,respectively. The differences were significant(P<0.05). ZSD3 strain had the strongest promoting effect,followed by ZSD1 strain. The assay of growth-promoting activity showed that ZSD1, ZSD2 and ZSD3 strains had the ability of dissolving phosphorus,dissolving potassium, fixing nitrogen and producingauxin(IAA). The abilities of dissolving phosphorus and producing IAA ranked as ZSD1 strain>ZSD2 strain>ZSD3 strain. The abilities of fixing nitrogen and dissolving potassium ranked as ZSD3 strain> ZSD1 strain> ZSD2 strain. 16S rDNA sequence alignment and morphological analysis showed that ZSD1 strain was Serratia, ZSD2 strain was Lysinibacillus fusiformis and ZSD3 strain was Bacillus amyloliquefaciens. 【Conclusion】The ZSD1,ZSD2 and ZSD3 strains isolated from the rhizosphere soil of ratooning rice have strong effects on promoting the growth of axillary buds in ratooning rice,the promotion effects of ZSD3 is the strongest, which could be used to develop the bio-bacterial fertilizer of ratooning rice.
0 引言
【研究意义】近年来,随着水稻种植面积的不断减少及单产增长率的逐年下降,再生稻已成为种植一季稻热量有余而双季稻热量不足地区及双季稻改为单季稻地区提高水稻复种指数、增加稻田有效面积和稻谷产量的有效措施(杨东等,2007)。有研究表明单位面积再生分蘖数对再生稻产量贡献度最大(杨惠杰等,2005),当前,提高再生稻分蘖数主要依赖化肥的施用,但长期大量施用化肥不仅会导致农田生态环境、土壤理化性状及微生物群落受到不同程度破坏,还会促使作物病虫害增多(刘正柱,2004),增加生产成本。为了克服使用化肥的诸多负面影响,科研人员已在多种作物上开展以生物菌肥部分替代化肥的相关研究,并获得良好效果(王豹祥等,2011;常梅,2013;何志刚等,2013;荣良燕等,2014;张志鹏等,2019)。因此,分离筛选能促进再生稻分蘖数的植物根际促生菌,以此为基础生产能部分替代化肥以减少化肥施用量的微生菌肥具有重要意义。【前人研究进展】植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)是指能在植物根际定殖,可使土壤中某些无效元素有效化、合成某些物质和(或)抑制或减轻某些植物病害从而促进植物生长的有益菌类(崔晓双等,2015),研究人员已在多种作物上分离筛选到PGPR。在经济作物上,荣良燕等(2011)筛选出PGPR菌株191和LHSⅡ,其对黄瓜枯萎病菌、西瓜枯萎病菌和立枯丝核菌均具有良好的抑制效果;罗静静(2015)从棉田中筛选得到的2株枯草芽孢杆菌能有效防治棉花连作障碍;李想等(2017)从烟草根际筛选得到枯草芽孢杆菌、地衣芽孢杆菌和解淀粉芽孢杆菌,其均具有广谱抗菌作用。在粮食作物上,王平等(1999)从小麦根圈细菌中筛选得到7株对小麦根腐病原菌及5株对小麦全蚀病原菌有抑制作用的PGPR菌株;焦峰等(2005)发现PGPR与化肥配合施用,能提高水稻的株高、根系活力、穗数、穗粒数和千粒重,较单施化肥增产26.0%;胡雪(2010)从水稻根际分离得到4株能提高水稻生物量和1株有效防治稻瘟病及纹枯病的PGPR菌株;刘泽平等(2018)从水稻根际土壤分离纯化得到3株具有较强促生能力的促生菌(Bacillus megaterium LZP03、B. huizhouensis LZP05和B. subtilis LZP06)。【本研究切入点】虽然已在水稻和多种作物上分离筛选出具有促生和(或)生防功能的PGPR,但目前可用于促进再生稻腋芽萌发生长的PGPR鲜有报道。【拟解决的关键问题】从再生稻根际土壤中分离、筛选、鉴定PGPR并测定其促生能力,以期为开发和生产促进再生稻腋芽萌发的微生物肥料提供资源和技术支持。
1 材料与方法
1. 1 试验材料
水稻品种甬优2640购自福州农丰源种业有限公司,LB培养基、固氮液体培养基、解磷液体培养基、解钾液体培养基、琼脂粉、胰蛋白胨和氯化钠等试剂均购自北京索莱宝生物科技有限公司。
LB培养基:胰蛋白胨10.00 g,酵母提取物5.00 g,氯化钠10.00 g,蒸馏水1000 mL,pH 7.0~7.4;固氮液体培养基:葡萄糖10.00 g,磷酸氢二钾0.20 g,硫酸镁0.20 g,氯化钠0.20 g,硫酸钙0.20 g,碳酸钙5.00 g,蒸馏水1000 mL,pH 7.0~7.2;解磷液体培养基:葡萄糖10.00 g,硫酸铵0.50 g,氯化钾0.30 g,氯化钠0.30 g,硫酸镁0.30 g,硫酸锰0.03 g,硫酸亚铁0.03 g,磷酸三钙8.00 g,蒸馏水1000 mL,pH 7.0~7.5;解钾液体培养基:蔗糖5.00 g,氯化铁0.005 g,硫酸镁0.50 g,碳酸钙0.10 g,磷酸氢二钠2.00 g,钾长石粉2.00 g,pH 7.0~7.5。
1. 2 PGPR分离与纯化
于2016年9月采用五点采样法从福建农林大学教学基地试验田采集具有强再生力水稻品种甬优2640再生季根际土样,混匀作样品,采用稀释分离法对土样微生物进行分离纯化;称取10 g土壤置于三角瓶中,加入90 mL无菌水,120 r/min振荡30 min,获得土壤悬液,将其依次稀释,制成10-1~10-6不同稀释度的土壤悬液;取10-3~10-6各稀释梯度样品0.1 mL涂抹于LB固体培养基上,每个浓度重复3次,培养基倒置于30 ℃培养箱培养1 d后,选取菌落数适宜的平板挑取单菌落,采用平行划线方法进行纯化,连续划线分离3次,确认为纯化的细菌。
1. 3 PGPR筛选及促生效果测定
PGPR筛选及促生效果试验采用桶栽法,将分离得到的菌株接种至LB液体培养基中,34 ℃、220 r/min振荡培养48 h,得到浓度为106~108 CFU/mL的菌株发酵液;桶栽塑料桶上口径30 cm、下口径23 cm、高30 cm,每桶装土12 kg,桶栽3株,每个菌处理和对照各6桶,3次重复,收割后3 d开始处理,处理时不施用化肥,只用浓度为106~108 CFU/mL菌株发酵液灌根,每桶浇灌菌株发酵液500 mL,隔3 d再浇灌1次,共2次,以强化菌在根际的定殖;對照浇灌相同体积的无菌培养基,处理方法相同。浇入后每隔7 d记录1次再生分蘖数的变化,于再生稻成熟期,每处理取3株考察单株穗数、穗粒数、结实率、千粒重和单株产量。
1. 4 菌株鉴定
1. 4. 1 形态学鉴定 将分离筛选得到的菌株接种在划线的LB固体培养基上,28 ℃培养24 h,观察菌落颜色、形状、透明度及表面边缘隆起程度等性状,并进行革兰氏染色观察。
1. 4. 2 分子生物学鉴定 采用细菌基因组提取试剂盒OMEGA D3350-01[生工生物工程(上海)股份有限公司]提取筛选得到的菌株基因组总DNA,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR反应体系:10×Taq Buffer 5 ?L,dNTP 1 ?L,引物2 ?L,TaqDNA聚合酶1 ?L,模板2 ?L,ddH2O补足至50 ?L。PCR反应条件:94 ℃预变性5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1.5 min,进行30个循环;72 ℃延伸10 min(屈青松等,2016)。用1%琼脂糖凝胶电泳和凝胶成像系统Gel Doc XR+(美国伯乐公司)观测扩增结果,将PCR扩增产物送至铂尚生物技术(上海)有限公司测序,所得16S rDNA序列与NCBI数据库进行同源性比对,利用MEGA 5.0的邻接法构建系统发育进化树,进行遗传进化分析。
1. 5 促生活性测定
将分离得到的菌株分别接种于盛有LB液体培养基的试管中过夜活化,得到活化菌株。
将1 mL活化菌株接种于50 mL经灭菌含有L-色氨酸的LB液体培养基中,以不接种为空白对照,接种后28 ℃、150 r/min振荡培养7 d,取1 mL上清液加入2 mL Salkowski反应液,混匀后,于室温下暗处反应30 min,采用紫外分光光度计UV-1900[翱艺仪器(上海)有限公司]测定OD530(张东艳等,2016),计算产生长素(IAA)量。
将1 mL活化菌株接种于50 mL经灭菌的解磷液体培养基中,以不接种为空白对照,接种后28 ℃、150 r/min振荡培养7 d,采用钼蓝比色法测定解磷量(马骢毓等,2016)。
将1 mL活化菌株接种于50 mL经灭菌的解钾液体培养基中,以不接种为空白对照,接种后28 ℃、150 r/min振荡培养7 d,取10 mL菌液10000 r/min离心10 min后,取上清液采用火焰分光光度计FP6410(上海仪电分析仪器有限公司)测定解钾量(鲍士旦,2000)。
将1 mL活化菌株接种于50 mL经灭菌的固氮液体培养基中,以不接种为空白对照,接种后28 ℃、150 r/min振荡培养7 d,取10 mL菌液10000 r/min离心10 min后,取上清液采用凯氏定氮仪KDN-08A(上海昕瑞仪器仪表有限公司)测定固氮量(鲍士旦,2000)。
1. 6 统计分析
采用Excel 2013和DPS v14.10进行数据整理和差异显著性分析。
2 结果与分析
2. 1 菌株分离纯化结果
在LB固体培养基上通过平行划线方法进行菌株分离纯化,得到4株菌株,分别编号为ZSD1、ZSD2、ZSD3和ZSD4。4株菌株的菌落形态见表1,ZSD1、ZSD2和ZSD4菌株的菌落基本形态特征均为圆形,淡黄色,边缘整齐,表面突起湿润;ZSD3菌株的菌落基本形态特征为圆形,乳白色,边缘不整齐,表面扁平粗糙。
进一步对4株菌株进行革兰氏染色镜检,由图1可知,ZSD1菌株革兰氏染色呈红色,属于革兰氏阴性菌(G-);ZSD2、ZSD3和ZSD4菌株革兰氏染色呈紫色,属于革兰氏阳性菌(G+)。
2. 2 PGPR菌株的筛選及促生效果测定结果
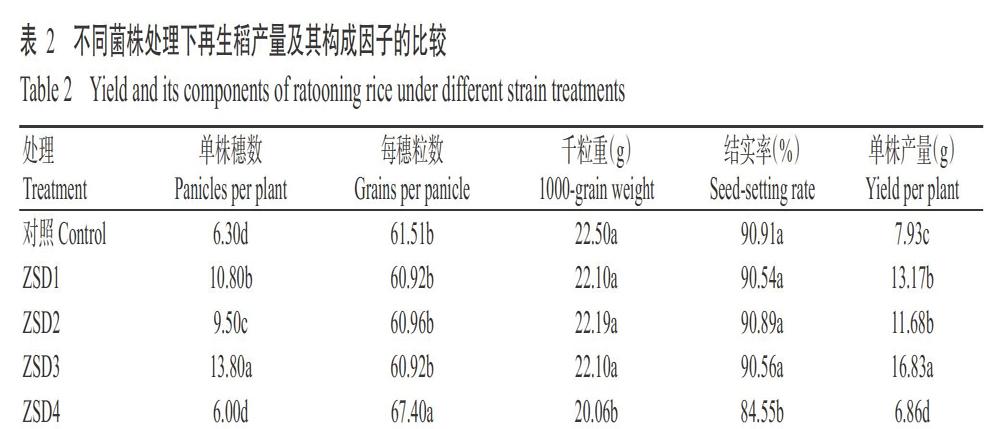
盆栽促生结果如图2和表2所示。由图2可知,与对照相比,在浇入菌株发酵液后的14 d内,ZSD1、ZSD2和ZSD3菌株处理的再生稻分蘖数呈快速增长趋势,之后增长速度变缓,至浇入菌株发酵液后第35 d,ZSD1、ZSD2和ZSD3菌株处理的再生稻分蘖数分别比对照多61.76%、45.59%和102.94%,差异达显著水平(P<0.05,下同),ZSD4菌株处理的再生稻分蘖数与对照无显著差异(P>0.05,下同),表明ZSD1、ZSD2和ZSD3菌株具有较强的促进再生稻腋芽萌发成蘖能力。
由表2可知,再生稻成熟期ZSD1、ZSD2和ZSD3菌株处理的单株产量分别为13.17、11.68和16.83 g,分别比对照显著提高66.08%、47.29%和112.23%,而ZSD4菌株处理的单株产量较对照显著减少13.49%,ZSD3菌株处理的单株产量显著高于ZSD1、ZSD2和ZSD4菌株处理。从产量构成因子(表2)来看,与对照相比,再生稻成熟期ZSD1、ZSD2和ZSD3菌株处理间的每穗粒数、千粒重和结实率差异均不显著,造成产量差异的主要因子是单株穗数,ZSD3菌株处理的再生稻单株穗数显著多于ZSD1和ZSD2菌株。可见,分离筛选得到的ZSD1、ZSD2和ZSD3菌株均具有促进再生稻腋芽萌发成蘖的能力,促生能力依次为ZSD3菌株>ZSD1菌株>ZSD2菌株,而ZSD4菌株无促生效果。
2. 3 菌株促生活性测定结果
由表3菌株促生活性测定结果可知,ZSD1、ZSD2和ZSD3菌株均具有解磷、解钾、固氮和产IAA的能力,但3株菌株有所不同。解磷和产IAA能力由高到低排序为ZSD1菌株>ZSD2菌株>ZSD3菌株,ZSD1菌株的解磷能力较ZSD2和ZSD3菌株分别高22.77%和226.51%,产IAA能力比ZSD2菌株高109.88%,是ZSD3菌株的24.95倍,差异均达显著水平。固氮和解钾能力由高到低排序为ZSD3菌株>ZSD1菌株>ZSD2菌株,ZSD3菌株的解钾能力较ZSD1和ZSD2菌株分别高78.47%和423.10%,固氮能力较ZSD1和ZSD2菌株分别高43.60%和160.22%,差异均达显著水平。
2. 4 PGPR菌株鉴定
将菌株16S rDNA测序结果与NCBI上GenBank数据库进行同源性比对,经BLAST比对分析发现,ZSD1菌株16S rDNA序列与Serratia sp. strain N1SM32的同源性达99.93%,ZSD2菌株16S rDNA序列与Lysinibacillus fusiformis strain RB-21的同源性达99.86%,ZSD3菌株16S rDNA序列与B. amyloli-quefaciens subsp. SDF002的同源性达100.00%。基于16S rDNA序列同源性构建的系统发育进化树分析(图3)显示,ZSD1菌株与Serratia聚为一支,ZSD2菌株与L. fusiformis聚为一支,ZSD3菌株与B. amyloliquefaciens聚为一支,将分子生物学鉴定与上述菌落形态结构和菌株革兰氏染色结果结合,可确定ZSD1菌株为沙雷氏菌(Serratia),ZSD2菌株为纺锤形赖氨酸芽孢杆菌(L. fusiformis),ZSD3菌株为解淀粉芽孢杆菌(B. amyloliquefaciens)。
3 讨论
近年来,PGPR微生物菌肥在多种作物化肥减施增产上表现出良好的应用效果(荣良燕等,2011;罗静静,2015;李想等,2017;曹媛媛等,2019)。在水稻上,梁运江等(2001)研究发现在减少50%化肥的基础上配施生物菌肥能使水稻增产74%;叶喜文等(2005)研究发现PGPR促生菌肥在水稻上施用,分蘖末期每平方米分蘖数较单施化学肥料处理平均增加20个,增产26%;de Salamone等(2012)在水稻大田条件下联合使用荧光假单胞菌(Pseudomonas fluorescens)和巴西固氮螺菌(Azospirillum brasilense),可使水稻收获指数和产量提高16.0%和20.2%;Pham等(2017)发现在盆栽条件下接种斯氏假单胞菌(P. stutzeri)A15可使水稻苗和根的干重显著提高。本研究的再生稻盆栽促生试验结果表明,与对照相比,浇入ZSD1、ZSD2和ZSD3菌株发酵液后35 d,再生稻分蘖数分别增加61.76%、45.59%和102.94%,单株产量分别提高66.08%、47.29%和112.23%,差异达显著水平。从产量构成因子来看,ZSD1、ZSD2和ZSD3菌株处理再生稻产量提高的主要原因是促进再生分蘖数,刘爱中等(2008)研究表明影响再生稻产量最主要的因子是有效穗数,而有效穗数均来自再生苗;从再生稻有效穗数来看,具有促生功能的3株菌株在促生效果上有所不同,以ZSD3菌株的促生能力最强,显著强于ZSD1和ZSD2菌株。由此可见,ZSD1、ZSD2和ZSD3菌株的促生主要是通过促进腋芽萌发、增加再生稻分蘖数来提高再生稻产量。
PGPR最早在马铃薯上分离发现,迄今为止,国内外研究者从各种植物根际分离筛选获得大量具有植物促生和生防作用的PGPR,主要种类有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、沙雷氏菌属(Serratia)及伯克霍尔德氏菌属(Burkholderia)等20多个种属(王彪等,2019)。本研究筛选得到的ZSD1菌株属于沙雷氏菌,ZSD2菌株属于纺锤形赖氨酸芽孢杆菌,ZSD3菌株属于解淀粉芽孢杆菌。芽孢杆菌属和沙雷氏菌属在促进植物生长和生防作用上已有较多研究报道,而纺锤形赖氨酸芽孢杆菌较多见于环境修复和生防方面的报道,在促进植物生长方面的报道相对较少(Vendan et al.,2010;Trivedi et al.,2011;Singh et al.,2013)。PGPR促進植物生长的机理可分为直接作用和间接作用,其中,直接作用是指PGPR可使土壤中某些无效元素有效化或合成某些物质(固氮、溶钾、溶磷和产IAA等),从而促进植物生长;间接作用是指有些PGPR可抑制或减轻某些植物病害的发生,并通过诱导植物系统抗性以提高植物自身对疾病的防卫机制,从而降低对植物生长发育及产量收获的不良影响(田婧等,2016)。从菌株的促生活性可知,本研究分离筛选得到的沙雷氏菌、纺锤形赖氨酸芽孢杆菌和解淀粉芽孢杆菌均具有解磷、解钾、固氮和产IAA能力。氮、磷、钾是再生稻腋芽萌发生长所必需的大量元素;同时,氮和磷还是信号物质,氮经硝化作用形成的硝态氮作为信号分子可激活一系列基因表达和内源激素(细胞分裂素);土壤中磷含量增加可抑制根中独角金内酯的合成,而独角金内酯会抑制作物分枝的发生。可见,ZSD1、ZSD2和ZSD3菌株具有的解磷、解钾和固氮能力可为再生稻腋芽萌发生长提供营养,还可能是腋芽解除休眠的信号因子,但具体原理有待进一步研究。此外,这3株菌株具有产IAA能力,土壤中低浓度IAA可促进根系生长,林文等(2001)研究表明再生稻腋芽萌发与根系机能有着显著的相关性,即这3株菌株具有的产IAA能力还可通过促进再生稻根系生长进而促进腋芽萌发生长。本研究结果还表明,3株菌株的固氮、解磷、解钾和产IAA能力不同,解磷和产IAA能力从高到低排序为ZSD1菌株>ZSD2菌株>ZSD3菌株;固氮和解钾能力从高到低顺序为ZSD3菌株>ZSD1菌株>ZSD2菌株,且盆栽促生结果显示,ZSD3菌株的促生能力最强,显著强于ZSD1和ZSD2菌株,可推断ZSD3菌株比ZSD1和ZSD2菌株具有更强的固氮、解钾能力可能是ZSD3菌株处理再生稻产量高于ZSD1和ZSD2菌株的原因,其具体促生机制有待进一步探讨。
4 结论
本研究从再生稻根际土壤中分离得到4株菌株(ZSD1、ZSD2、ZSD3和ZSD4),通过再生稻促生盆栽试验,筛选出3株具有高效促进再生稻腋芽萌发分蘖的PGPR菌株(ZSD1、ZSD2和ZSD3菌株),以ZSD3菌株的促生效果最强,其次为ZSD1菌株,可为今后开发再生稻生物菌肥提供菌种资源。
参考文献:
鲍士旦. 2000. 土壤农化分析[M]. 第3版. 北京:中国农业出版社. [Bao S D. 2000. Soil agro-chemistrical analysis[M]. The 3rd Edition. Beijing:China Agriculture Press.]
曹媛媛,陈春,郭婷婷,钱叶,张程飞,何相怡,李婷,Lay Khi-en Duc,唐欣昀,邵文韬,王晓波,邱丽娟. 2019. 亲和性促生菌DW12-L的定殖及其对大豆生长的影响[J]. 江苏农业学报,35(4):776-783. [Cao Y Y,Chen C,Guo T T,Qian Y,Zhang C F,He X Y,Li T,Lay K D,Tang X Y,Shao W T,Wang X B,Qiu L J. 2019. Colonization of soybean affinity rhizobacteria strain DW12-L and its effects on soybean growth[J]. Jiangsu Journal of Agricultural Sciences,35(4):776-783.]
常梅. 2013. 保护地黄瓜施用生物菌肥肥力效应研究[J]. 北方园艺,(4):177-178. [Chang M. 2013. Study on fertility effects of applying biological bacterial fertilizer on cucumber in protected field[J]. Northern Horticulture,(4):177-178.]
崔曉双,王伟,张如,张瑞福. 2015. 基于根际营养竞争的植物根际促生菌的筛选及促生效应研究[J]. 南京农业大学学报,38(6):958-966. [Cui X S,Wang W,Zhang R,Zhang R F. 2015. Screening of plant growth-promoting rhizobacteria based on rhizosphere nutrition competiveness and investigation of their promoting effects[J]. Journal of Nanjing Agricultural University,38(6):958-966.]
何志刚,王秀娟,董环,娄春荣,牛世伟,于涛. 2013. PGPR菌肥对马铃薯产量与肥料利用率影响的初步研究[J]. 中国土壤与肥料,(2):100-103. [He Z G,Wang X J,Dong H,Lou C R,Niu S W,Yu T. 2013. A preliminary study of the application of PGPR fertilizer on the potato[J]. Soils and Fertilizers Sciences in China,(2):100-103.]
胡雪. 2010. 水稻根际促生菌的分离鉴定及其对水稻作用效果的研究[D]. 武汉:华中农业大学. [Hu X. 2010. Isolation and identification of plant growth-promoting rhizobacteria and study of the effects on rice growth[D]. Wuhan:Huazhong Agricultural University.]
焦峰,吴金花,党爱河,叶喜文,郑树生. 2005. 水稻施用植物生长促进菌效果初探[J]. 中国农学通报,21(10):223-225. [Jiao F,Wu J H,Dang A H,Ye X W,Zheng S S. 2005. Preliminary report of a kind of PGPR application on rice[J]. Chinese Agricultural Science Bulletin,21(10):223-225.]
李想,刘艳霞,夏范讲,蔡刘体,张恒,石俊雄. 2017. 烟草根际促生菌(PGPR)的筛选、鉴定及促生机理研究[J]. 中国烟草学报,23(3):111-118. [Li X,Liu Y X,Xia F J,Cai L T,Zhang H,Shi J X. 2017. Screening,identification and plant growth-promotion mechanism of tobacco plants rhizobacteria[J]. Acta Tabacaria Sinica,23(3):111-118.]
梁运江,许广波,郑哲,刘文利,魏铁铮. 2001. 生物菌肥对水稻营养特性及增产效果的初步研究[J]. 土壤通报,32(2):88-89. [Liang Y J,Xu G B,Zheng Z,Liu W L,Wei T Z. 2001. Effects of bacterial manure on nutritional status and yields of rice[J]. Chinese Journal of Soil Sciences,32(2):88-89.]
林文,李义珍,姜照伟,郑景生. 2001. 再生稻根系形态和机能的品种间差异及与产量的关联性[J]. 福建农业学报,16(1):1-4. [Lin W,Li Y Z,Jiang Z W,Zheng J S. 2001. Morphologic and functional difference of root systems among ratooning rice varieties and its correlation with yield[J]. Fujian Journal of Agriculture Sciences,16(1):1-4.]
刘爱中,张胜文,屠乃美. 2008. 稻桩贮藏同化产物的分配与再生稻腋芽再生率及产量构成的关系[J]. 华北农学报, 23(3):190-193. [Liu A Z,Zhang S W,Tu N M. 2008. The relationship between distribution of assimilation production stored instubble and ratooning rate of axillary buds and yield characteristics of ratooning rice[J]. Acta Agriculture Boreali-sinica,23(3):190-193.]
刘泽平,王志刚,徐伟慧,陈文晶,吕智航,王春龙,史一然. 2018. 水稻根际促生菌的筛选鉴定及促生能力分析[J].农业资源与环境学报,35(2):119-125. [Liu Z P,Wang Z G,Xu W H,Chen W J,Lü Z H,Wang C L,Shi Y R. 2018. Screen,identification and analysis on the growth-promoting ability for the rice growth-promoting rhizobacteria[J]. Journal of Agricultural Resources and Environment,35(2):119-125.]
刘正柱. 2004. 有机无机配方肥料的开发及其效果的研究[D]. 南京:南京农业大学. [Liu Z Z. 2004. A study on organo-mineral fertilizers and their effects crop growth[D]. Nanjing:Nanjing Agriculture University.]
罗静静. 2015. 连作棉田PGPR菌株的定殖性能及抗菌活性物质研究[D]. 乌鲁木齐:新疆农业大学. [Luo J J. 2015. The study on antimicrobial active substances and colonization ability of PGPR strains in continuous cropping cotton field[D]. Urumqi:Xinjiang Agricultural University.]
马骢毓,张英,孙广正,刘婷,姚拓. 2016. 披碱草根际促生菌筛选及其接种剂的促生作用[J]. 植物营养与肥料学报,22(4):1039-1048. [Ma C Y,Zhang Y,Sun G Z,Liu T,Yao T. 2016. Identification of plant growth promoting rhizobacteria Elymus dahuricus and their effectives[J]. Plant Nutrition and Fertilizer Science,22(4):1039-1048.]
屈青松,彭萬里,翟立明,刘晓,林榕姗. 2016. 马铃薯内生细菌的分离鉴定及种群多样性分析[J]. 中国蔬菜,(6):41-46. [Qu Q S,Peng W L,Zhai L M,Liu X,Lin R S. 2016. Isolation and identification of endophytic bacteria and analysis of population diversity in different potato varieties[J]. China Vegetables,(6):41-46.]
荣良燕,姚拓,冯今,杜笑村,李儒仁,陈龙. 2014. PGPR微生物肥代替部分化肥对豌豆生长的影响[J]. 草原与草坪,34(1):7-12. [Rong L Y,Yao T,Feng J,Du X C,Li R R,Cheng L. 2014. Effect of partly replacing chemical ferti-lizer by PGPR biofertilizer on pea growth[J]. Grassland and Turf,34(1):7-12.]
荣良燕,姚拓,赵桂琴,柴强,席琳乔,王小利. 2011. 产铁载体PGPR菌筛选及其对病原菌的拮抗作用[J]. 植物保护,37(1):59-64. [Rong L Y,Yao T,Zhao G Q,Chai Q,Xi L Q,Wang X L. 2011. Screening of siderophore-producing PGPR bacteria and their antagonism against the pathogens[J]. Plant Protection,37(1):59-64.]
田婧,李邵,马宁,连青龙,鲁少尉,鲍顺淑. 2016. 植物根际促生菌作用机理研究进展[J]. 安徽农业科学,44(10):1-2. [Tian J,Li S,Ma N,Lian Q L,Lu S W,Bao S S. 2016. Research progress of the action mechanism of plant growth-promoting rhinoacteria[J]. Journal of Anhui Agricultural Sciences,44(10):1-2.]
王豹祥,李富欣,张朝辉,吴风光,席淑雅,朱宝,曹育博,刘天翔,邱立友. 2011. 应用PGPR菌肥减少烤烟生产化肥的施用量[J]. 土壤学报,48(4):812-822. [Wang B X,Li F X,Zhang C H,Wu F G,Xi S Y,Zhu B,Cao Y B,Liu T X,Qiu L Y. 2011. Effect of application of PGPR on chemical fertilizer application rate for flue-cued tobacco[J]. Acta Pedologica Sinica,48(4):812-822.]
王彪,潘英豪,侯佳蓝,戚昱琦,陈爱明,王娜. 2019. 一种桑树细菌性病原内生拮抗细菌的筛选、鉴定及其生防活性[J]. 微生物前沿,8(3):110-120. [Wang B,Pan Y H,Hou J L,Qi Y Q,Chen A M,Wang N. 2019. Screening, identification of an antagonistic endophyte to pathogens of mulberry bacterial diseases from mulberry leaves and its biocontrol activity[J]. Advances in Microbiology,8(3):110-120.]
王平,冯新梅,王国新,董彪,李阜棣. 1999. 小麦根圈细菌中PGPR的筛选及其初步鉴定[J]. 华中农业大学学报,18(4):352-356. [Wang P,Feng X M,Wang G X,Dong B,Li F D. 1999. Screening and identification of PGPR strains isolated from the rhizosphere of winter wheat(Triticum aestivum L.)[J]. Journal of Huazhong Agricultural University,18(4):352-356.]
杨东,董瑞霞,张水金,谢鸿光,涂诗航,郑家团. 2007. 再生稻生产效益与栽培技术研究[J]. 江西农业学报,19(9):28-30. [Yang D,Dong R X,Zhang S J,Xie H G,Tu S H,Zheng J T. 2007. Production benefit and cultivation techniques of ratooning rice[J]. Acta Agriculture Jiangxi,19(9):28-30.]
杨惠杰,郑景生,姜照伟,李义珍,卓传营,张上守. 2005. 再生稻超高产库的结构特征[J]. 福建农业学报,20(2):65-68. [Yang H J,Zheng J S,Jiang Z W,Li Y Z,Zhuo C Y,Zhang S S. 2005. The sink structure character of super high-yielding ratooning rice[J]. Fujian Journal of Agriculture Sciences,20(2):65-68.]
叶喜文,焦峰,吴金花,郑树生,张合豫,周元明. 2005. PGPR促生菌肥在水稻上应用效果研究[J]. 黑龙江八一农垦大学学报,17(1):9-11. [Ye X W,Jiao F,Wu J H,Zheng S S,Zhang H Y,Zhou Y M. 2005. An applied effect test of PGPR bio-fertilizer on rice[J]. Journal of Heilongjian August First Land Reclamation University,17(1):9-11.]
张东艳,刘晔,吴越,王国文,万兵兵,姜瑛. 2016. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报,38(1):104-110. [Zhang D Y,Liu Y,Wu Y,Wang G W,Wan B B,Jiang Y. 2016. Isolation and identification of IAA-producing strains from peanut rhizosphere and its promoting effects on peanut growth[J]. Chinese Journal of Oil Crop Sciences,38(1):104-110.]
张志鹏,蔡燕飞,段继贤,王宗抗. 2019. 复合微生物菌肥在小麦上的应用肥效研究[J]. 广东农业科学,46(10):1-6. [Zhang Z P,Cai Y F,Duan J X,Wang Z K. 2019. Study on the fertilizer efficiency of compound biofertilizer applying in wheat[J]. Guangdong Agricultural Sciences,46(10):1-6.]
de Salamone G,Funes J M,Di Salvo L P,Escobar-Ortega J S,DAuria F,Ferrando L,Fernandez-Scavino A. 2012. Inoculation of paddy rice with Azospirillum brasilense and Pseudomonas fluorescens:Impact of plant genotypes on rhizosphere microbial communities and field crop production[J]. Applied Soil Ecology,61:196-204.
Pham V T,Rediers H,Ghequire M G,Nguyen H H,De M R,Vanderleyden J,Spaepen S. 2017. The plant growth-promoting effect of the nitrogen-fixing endophyte Pseudomonas stutzeri A15[J]. Archives of Microbiology,199(3):513-517.
Singh R K,Kumar D P,Solanki M K,Singh P,Srivastva A K,Kumar S,Kashyap P L,Saxena A K,Singhal P K,Arora D K. 2013. Optimization of media components for chitinase production by chickpea rhizosphere associated Lysinibacillus fusiformis B-CM18[J]. Journal of Basic Microbiology,53(5):451-460.
Trivedi P,Spann T,Wang N. 2011. Isolation and characterization of beneficial bacteria associated with citrus roots in Florida[J]. Microbial Ecology,62(2):324-326.
Vendan R T,Yu Y J,Lee S H,Rhee Y H. 2010. Diversity of endophytic bacteria in ginseng and their potential for plant growth promotion[J]. Journal of Microbiology,48(5):559-565.
(責任编辑 罗 丽)
