壳聚糖修饰二氧化硅载紫杉醇纳米粒的制备、释放及对A549细胞作用研究
2020-06-03曹艳瑕吴超安宇
曹艳瑕,吴超,安宇
(1.锦州医科大学,辽宁 锦州 121000;2.朝阳市第二医院,辽宁 朝阳 122000;3.辽宁广播电视大学锦州分校,辽宁 锦州 121000)
近几十年,人们研发将抗癌药物选择性输送至肿瘤组织的药物递送系统(DDS)已取得一定成就,然而,避免药物在靶点之前提前释放以及药物经肿瘤细胞摄取后能够快速释放是提高药物治疗效果和降低毒副作用亟待解决的关键问题[1]。基于肿瘤内部或外部环境因素特点(诸如pH[2-3]、氧化还原[4-5]、酶[6-7]、温度[8]等)研发刺激响应型的智能DDS引起广泛关注。介孔二氧化硅纳米粒(MSN)具有表面积大、孔径可调、生物相容性好及表面易于修饰等优势,作为刺激响应性DDS的药物载体表现出巨大潜力。研究表明大多数肿瘤细胞内部环境具有两个特点:(1)肿瘤细胞胞浆中谷胱甘肽(GSH)浓度至少比正常细胞高3倍[3,9-10]9428-9439,二硫键在细胞内液体中易被GSH裂解;(2)肿瘤细胞的pH值(5.0~7.0)低于正常细胞的pH值[11-12]。这对于研发氧化还原和pH双重刺激响应性DDS具有重要意义。壳聚糖(CS)是一种具有良好生物相容性和生物可降解性的阳离子聚合物,具有良好的生物相容性、生物降解性和高度的pH敏感性[2,13-14]1-16。因此,本研究设计CS-SS-MSN作为难溶性广谱抗肿瘤药物PTX的药物载体实现PTX在肿瘤细胞中双重刺激响应性释放,旨在改善PTX的水溶解度和提高其生物利用度、降低其对正常组织细胞的毒副作用。探索该递送系统对A549细胞的体外抗肿瘤效果。
1 仪器与材料
AL204电子天平(梅特勒-托利多仪器有限公司)、KQ-250B型超声波清洗仪(昆山市超声仪器有限公司)、DF-101S恒温磁力搅拌器(郑州市亚荣仪器有限公司)、TG22-WS台式高速离心机(上海赵迪生物科技有限公司)、JEM-1010透射电镜(日本电子株式会社)、BT-Zeta100型Zeta电位纳米粒度分子量分析仪(丹东百特仪器有限公司)、IRAffinity-1红外光谱仪、LC-2030 高效液相色谱仪(日本岛津公司)、HS-DSC-101差示扫描量热仪(上海和晟仪器科技有限公司)、HBS-1096酶标分析仪(深圳良谊仪器有限公司)、CytoFLEX流式细胞仪(贝克曼柯尔特商贸(中国)有限公司)、ZEISS LSM 700激光共聚焦显微镜(上海莱瑟光谱仪器分析技术有限公司)。
紫杉醇PTX(纯度≥98%,西安天丰生物科技有限公司,批号批号:20151015),壳聚糖(纯度≥98%,山东福瑞达生物化工有限公司),十六烷基三甲溴化铵(CTAB),正硅酸乙酯(TEOS),3-巯基丙基-三甲氧基硅烷(MPTMS)(阿拉丁)、十二烷基硫酸钠(SDS)、谷胱甘肽(GSH)(国药集团化学试剂有限公司),甲醇(色谱醇,天津光复精细化工有限公司),噻唑兰(MTT),Hoechst 33342,罗丹明鬼笔环肽,异硫氰酸荧光素(FITC),胰酶,RPMI-1640培养基(北京鼎国昌盛生物科技有限公司),Annexin V-FITC凋亡试剂盒(南京建成生物工程研究所),其余试剂为市售分析纯。
2 方法与结果
2.1 CS-SS-MSN的制备[7,15]147-156
2.1.1 MSN-SH的制备
取1 g CTAB、200 mL去离子水和80 mL氨水溶液置于锥形瓶,混合溶液在室温条件下搅拌30 min至混合均匀,然后在20 min内滴加5 mL TEOS。搅拌12 h后将混合物离心,沉淀物经水洗3次后干燥,产物在550 ℃的空气氛围下煅烧5 h即得MSN。取适量MSN分散于60 mL无水乙醇中,再加入1 mL MPTMS。77 ℃的N2氛围下回流12 h,沉淀物经无水乙醇洗涤3次后干燥,即得到巯基功能化MSN(MSN-SH)。
2.1.2 MSN-SS-COOH的制备
将2,2’-二吡啶基二硫醚溶于THF中,然后加入NaHCO3溶液20 mL和3-硫基丙酸的THF溶液10 mL,搅拌4 h后蒸发除去混合物中的THF,经二氯甲烷洗涤3次后,并调节pH至2.0~3.0进行沉淀。通过乙酸乙酯萃取,干燥后即得白色沉淀物(Py-SS-COOH)。然后将MSN-SH分散在25 mL无水乙醇中,加入50 mg Py-SS-COOH,室温搅拌24 h,离心收集产物,经无水乙醇洗涤3次后干燥。即得产物MSN-SS-COOH。
2.1.3 CS-SS-MSN的制备
将0.2 g CS溶于2%醋酸溶液中搅拌4 h至CS完全溶解。然后加入MSN-SS-COOH 搅拌24 h,混合物经离心,沉淀物经蒸馏水和无水乙醇各洗涤3次,干燥即得CS-SS-MSN。
2.1.4 载药
采用吸附平衡法制备进行载药。取200 mg CS-SS-MSN/MSN混悬于PTX的二氯甲烷溶液中(2 mL,100 mg/mL),超声分散后搅拌24 h。产物经离心、干燥,即得CS-SS-MSN-PTX/MSN-PTX。精密称量5.0 mg CS-SS-MSN-PTX /MSN-PTX置于10 mL容量瓶,加甲醇溶解并稀释至刻度。静置1 h,离心,取上清液为供试品,HPLC法测定PTX浓度并计算载药量。
2.2 表征
2.2.1 TEM采用透射电子显微镜观察MSN-SH的形貌和介孔结构。
2.2.2 FT-IR采用傅立叶红外分光光谱仪检测CS-SS-MSN-PTX的修饰情况。
2.2.3 DSC采用差示扫描量热法检测PTX在CS-SS-MSN-PTX中存在状态。
2.3 体外响应性释放实验
2.3.1 pH和氧化还原响应性体外释放度考察
按照《中华人民共和国药典》2015版释放度测定法第二法。考察CS-SS-MSN-PTX的pH和氧化还原响应性释放。精密称量相当于3.0 mg PTX 的PTX、MSN-PTX、CS-SS-MSN-PTX分散于pH=7.4 PBS、pH=5.0 PBS、pH=7.4 PBS(10 mM GSH)和pH=5.0 PBS(10 Mm GSH)4种不同释放介质。释放条件如下:温度为37.0 ℃,转速为100 rpm。投药后按照预定时间(1、2、4、6、8、12、24、36、48、72 h)取样4 mL,取样后补充等量空白释放介质。通过HPLC法对PTX进行定量分析,计算PTX的累积释放度。
2.3.2 色谱条件
色谱柱为Agilent TC- C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(65∶35);流速为1 mL/min;检测波长为227 nm,柱温为30 ℃,进样量为20 μL。
2.4 体外细胞实验
2.4.1 细胞培养
A549细胞置于1640培养基培养(10%胎牛血清、100 U/mL青霉素和1%链霉素)。培养环境:温度为37 ℃,5%二氧化碳。每隔两天更换1次培养基。细胞传代过程中采用0.25%胰蛋白酶进行消化。
2.4.2 细胞摄取实验
首先采用 FITC 对CS-SS-MSN进行标记。具体方法:将2 mg FITC分散在2 mL乙醇中并搅拌至完全溶解,然后将100 mg CS-SS-MSN分散于 FITC乙醇溶液(1 mg/mL),避光搅拌24 h后,离心收集产物,产物经无水乙醇洗涤至上清液无色,即得FITC-CS-SS-MSN。将细胞密度为5×104的A549细胞接种于共聚焦皿。配制50 μg/mL FITC-CS-SS-MSN混悬液加入共聚焦皿,在37 ℃培养1、2 h后弃去培养基,PBS洗涤3次,经4%多聚甲醛溶液固定10 min。0.1% Triton X-100于4℃培养10 min,1%的白蛋白在37 ℃封闭30 min后染色。最后荧光共聚焦显微镜下观察A549细胞对FITC-CS-SS-MSN的摄取情况。
2.4.3 细胞毒性实验
将细胞密度为1×104的A549细胞接种于96孔板,37 ℃ 孵育24 h。精密称取MSN、CS-SS-MSN、PTX、MSN-PTX和CS-SS-MSN-PTX(相当于1 mg的PTX),将样品分散于2% HPMC,加入适量RPMI-1640培养基稀释成不同浓度药物溶液,各浓度设置6个复孔,各复孔加100 μL的药物溶液,同时以空白培养基作为对照。培养48 h后各孔加5 mg/mL MTT溶液20 μL,孵育4 h弃去培养基,加150 μL DMSO,通过酶标仪在OD=492 nm处对细胞活率定量分析。
3 结果与讨论
3.1 CS-SS-MSN-PTX的制备
3.1.1 CS-SS-MSN的制备
通过在MSN表面修饰二硫键与CS制备的CS-SS-MSN见图1。首先,采用硅烷偶联剂MPTMS使MSN表面修饰巯基制备MSN-SH。进一步利用Py-SS-COOH和巯基间的交换反应制备MSN-SS-COOH。最后通过MSN的羧基与CS的氨基之间的酰胺化反应将CS以共价键连接到MSN的表面。
3.1.2 载药
通过HPLC对载药量进行定量分析。MSN-SH-PTX载药量为27.76%±2.07%,CS-SS-MSN-PTX的载药量为25.32%±2.36%。CS-SS-MSN-PTX载药量稍有减少的原因归结于修饰过程中CS封堵MSN部分介孔孔道。
3.2 表征
3.2.1 TEM
通过TEM对制备的MSN-SH的形貌进行表征。见图2,MSN-SH呈单分散的球形颗粒,介孔结构清晰,粒径分布约为130 nm。丰富的介孔结构提供足够的空间来容纳药物分子并有效限制药物粒径,一定程度上改善水难溶性药物PTX的溶解度和溶出速率。
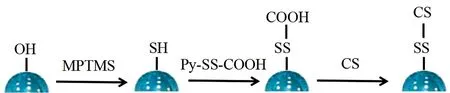
图1 MSN-SS-CS的制备流程示意图

图2 MSN-SH的透射电镜图
3.2.2 FT-IR
通过红外光谱仪对CS-SS-MSN的合成过程进行表征。见图3,与MSN-SH相比,羧基特征峰在1718 cm-1处出现表明MSN表面成功引入Py-SS-COOH。另外酰胺键特征峰在1650 cm-1处出现,1718 cm-1特征峰减弱表明羧基基团的显著减少是与CS的氨基发生酰胺化反应,表明CS-SS-MSN成功被制备。
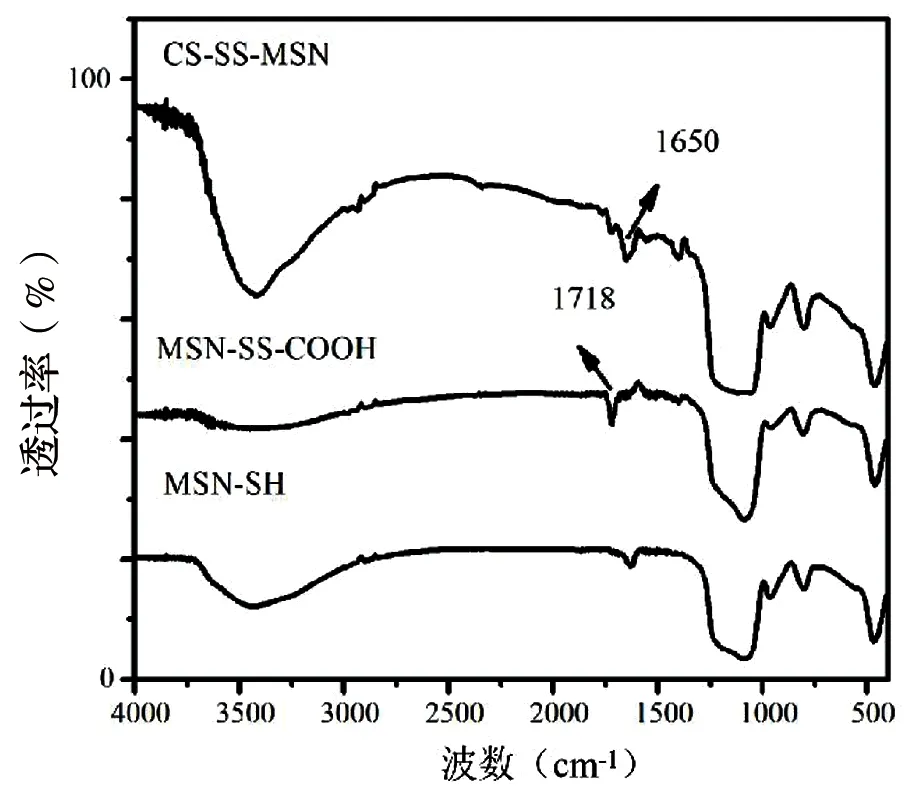
图3 MSN-SH、MSN-SS-COOH和CS-SS-MSN的红外光谱图
3.2.3 DSC
通过差式扫描量热法对样品PTX、MSN-SH、CS-SS-MSN、MSN-SH-PTX、CS-SS-MSN-PTX、PM(MSN-SH和PTX物理混合)和CSPM(CS-SS-MSN与PTX的物理混合)进行检测,结果见图4。结果表明:PTX的熔融吸热峰在223 ℃,同时该熔融吸热峰在PM和CSPM样品中可见,表明将PTX和MSN-SH、CS-SS-MSN物理混合方式未能改变PTX的晶型状态,然而空白载体和载药系统中均未见PTX的熔融吸热峰,表明PTX以无定型状态负载于MSN-SH、CS-SS-MSN的介孔结构。无定型状态的水难溶性药物PTX无晶格能的束缚,其溶解度和溶出速率将得到显著改善。

图4 PTX、药物载体和载药体系的DSC曲线图
3.3 体外响应性释放实验
通过两种pH=7.4和pH=5.0的PBS中是否添加10 mM的GSH作为不同的释放条件来测定MSN-SH-PTX和MSN-SS-CS-PTX中PTX的累积释放度,评价MSN-SS-CS-PTX的氧化还原和pH双重响应性药物释放特性,结果见图5。MSN-SH-PTX在pH=7.4和pH=5.0的PBS中72 h药物累积释放量分别为82.62%±2.85%和83.79%±2.66%。表明MSN-SH显著改善水难溶性药物PTX的溶出速率,进一步验证了DSC的结果。在不添加10 mM GSH的情况下,MSN-SS-CS-PTX在pH=5.0的PBS中累积释放量为43.00%±1.36%显著高于pH=7.4的21.04%±1.85%,表明MSN-SS-CS-PTX在酸性环境中有利于PTX的释放,MSN-SS-CS-PTX表现出敏感pH响应药物释放特性主要是源于MSN表面经CS修饰后具备CS的特性,在酸性条件下CS膨胀溶解,从而打开MSN的介孔孔道促进负载的PTX释放。而在中性条件无此特性,CS对负载的PTX产生屏蔽作用,阻碍PTX释放。此外,在添加10 mM GSH的情况下,PTX的释放速率和累积释放度进一步显著增加,在pH=5.0为80.90%±2.23%和pH=7.4为35.18%±2.09%。同比无GSH组,MSN-SS-CS-PTX表现出敏感氧化还原响应性药物释放特性。这是因为GSH将MSN-SS-CS-PTX的-SS-还原为-SH,二硫键的裂解导致修饰在MSN表面的CS脱落,使负载PTX直接暴露在释放介质中,通过MSN的孔道更快更直接的释放。总之,基于肿瘤细胞中的pH低于正常细胞中的pH,肿瘤细胞内GSH的浓度显著高于正常细胞中的水平,MSN-SS-CS-PTX通过二硫键和CS的氧化还原和pH响应性调控PTX在到达肿瘤部位之前释放和到达肿瘤细胞内快速释放的特性对于提高PTX生物利用度和降低其毒副作用具有重要意义。
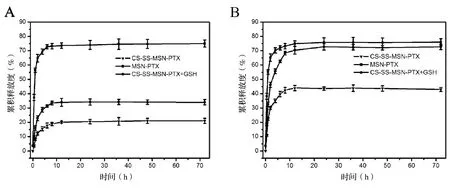
图5 MSN-SS-CS-PTX and MSN-SH-PTX的累积释放率 pH=7.4 PBS(A)和pH =5.0 PBS(B)
3.4 细胞实验
3.4.1 细胞摄取实验
通过CLSM观察A549细胞在1、2 h对FITC-MSN-SS-CS的摄取情况。结果见图6,根据图中荧光变化的情况表明FITC-MSN-SS-CS能够通过细胞膜进入细胞质,且呈时间依赖性。
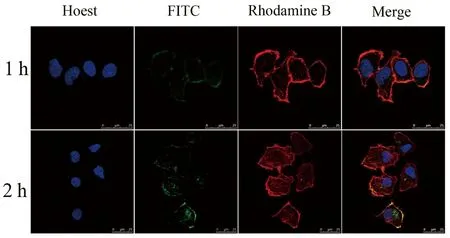
图6 A549细胞摄取的激光共聚焦图像
3.4.2 细胞毒性实验
通过MTT法考察系列浓度的空白载体MSN-SH和MSN-SS-CS对A549细胞的作用结果评价空白载体对A549细胞的生物相容性。结果见图7(A),A549细胞与浓度(5~500 μg/mL)的MSN-SS-CS和MSN-SH孵育48 h后表现出轻微的毒性,但细胞存活率均高于80%,表明空白载体MSN-SS-CS和MSN-SH对A549细胞具有良好的生物相容性。通过系列浓度的PTX、MSN-SH-PTX和MSN-SS-CS-PTX对A549细胞的细胞抑制率评价细胞毒性,结果见图7(B)。PTX、MSN-SH-PTX和MSN-SS-CS-PTX共同孵育的A549细胞在5~500 ng/mL的PTX表现出细胞毒性呈浓度依赖性,且在同一浓度条件的细胞抑制率情况为MSN-SS-CS-PTX>MSN-SH-PTX>PTX。这是基于实体瘤的高通透性和滞留效应(EPR效应),MSN-SS-CS-PTX和MSN-SH-PTX的纳米效应较PTX更易浓集于A549细胞,更重要的是MSN-SS-CS-PTX在CS和二硫键的作用下避免了PTX在进入A549细胞内提前释放,进一步提高A549细胞内PTX浓度,导致MSN-SS-CS-PTX对A549细胞抑制效果优于MSN-SH-PTX。
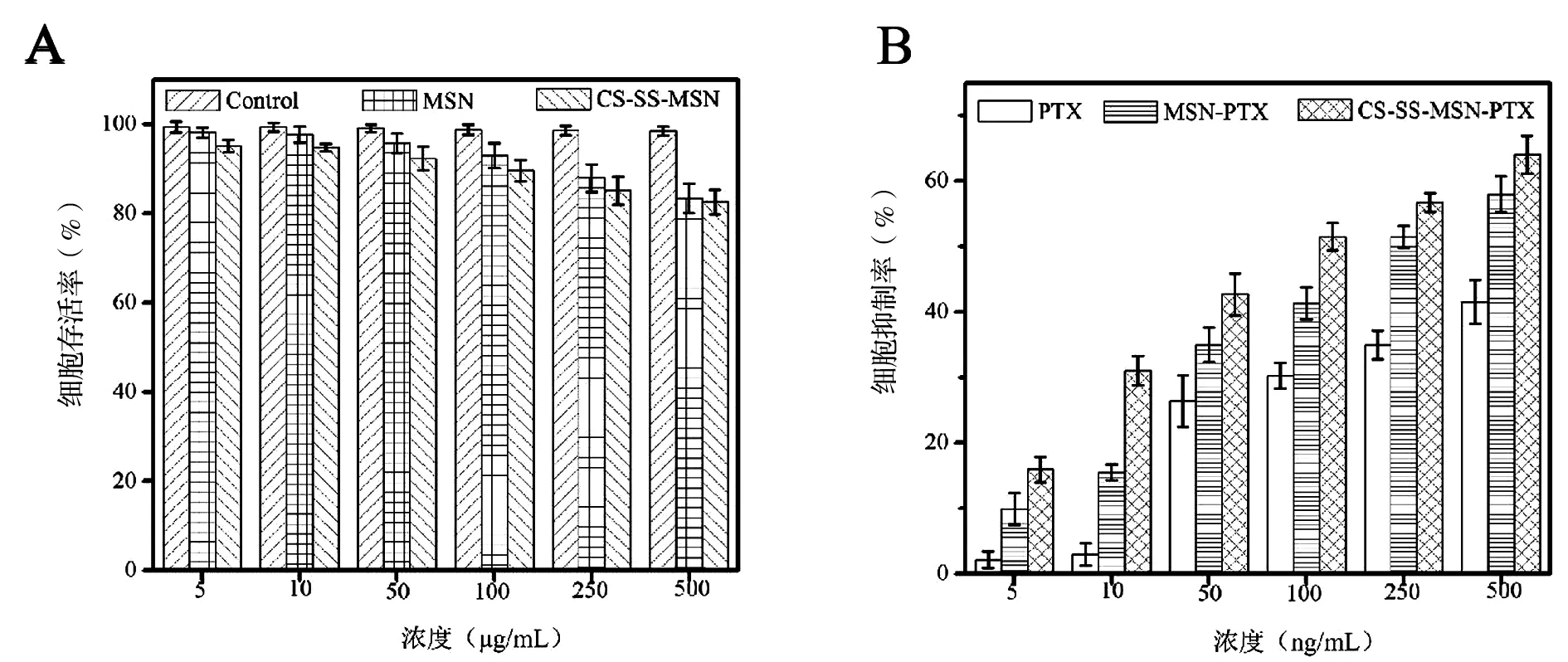
图7空白载体及载药系统对A549的细胞存活率和抑制率
4 结 论
本研究成功制备氧化还原和pH双刺激响应型药物递送系统MSN-SS-CS-PTX,PTX负载到MSN-SS-CS的介孔结构中,其溶解度和溶出速率得到显著改善。体外释放结果表明MSN-SS-CS-PTX显示出氧化还原和pH双刺激响应性药物释放特性。细胞实验结果表明MSN-SS-CS-PTX对A549表现出显著的抑制作用。综上所述MSN-SS-CS是具有氧化还原和pH双刺激响应性释放的药物载体,为改善疏水性化疗药物疗效及降低毒副作用提供有效解决途径。
